1株腈水合酶产生菌株的筛选、鉴定及酶学特性
,, , , ,, ,,*
(1.鲁东大学生命科学学院,山东烟台 264025; 2.鲁东大学农学院,山东烟台 264025)
对羟基苯乙酰胺是合成肾上腺素受体阻滞药阿替洛尔及其衍生物的关键中间体,因此对羟基苯乙酰胺的合成一直广受关注[1-4]。对羟基苯乙酰胺的生产方法主要有化学合成法和生物转化法。化学合成法反应条件剧烈,需要强酸、高温等条件,容易发生副反应、收率低、污水难以处理、环境不友好,限制了在规模化工业生产中的应用[5-6]。而生物转化法通常常温常压下反应、条件温和、催化专一性强、对应选择性高,将会是工业生产对羟基苯乙酰胺的最佳选择[7-9]。腈水合酶(Nitrile hydratase,NHase)是一种金属酶,可以催化腈类物质合成酰胺类化合物,是实现生物转化法生产对羟基苯乙酰胺的关键因素[10]。
NHase广泛存在于微生物群体中,在红球菌[11](Rhodococcussp.)、假单胞菌[12](Pseudomonassp.)、假诺卡氏菌[13](Pseudonocardiasp.)、农杆菌[14](Agrobacteriumsp.)、芽孢杆菌[15](Bacillussp.)、棒杆菌[16](Corynebacteriumsp.)及短杆菌[17](Brevibacteriumsp.)等微生物中均有发现,研究较为广泛。Nitto公司采用3株产NHase的微生物生产丙烯酰胺,产量得到不断提高。但也发现所产NHase不稳定,易失活,且受底物及产物的抑制作用较为强烈[18]。赵爱民等[19]利用筛选到的一株产NHase马红球菌(Rhodococcusequi),对其合成NHase的发酵条件进行优化,酶活较初筛时提高约95倍。马士忠等[20]筛选出一株底物广谱性的NHase的产生菌株诺卡氏菌KY1023,能高效地催化乙腈和丙烯腈的水解,分别转化为相应的酰胺化合物,转化率均超过98%。微生物NHase虽然具有很好的催化活性,在工业上仅限于丙烯酰胺和烟酰胺的生产,仍未广泛地应用于其他腈类化合物,主要因为这些微生物NHase的酶活不够高,半衰期短、对应选择性和反应浓度不高,尚不具备工业价值[21]。通过筛选针对性底物的新型微生物NHase或可解决以上问题。
截至目前国内外对阿氏芽孢杆菌(Bacillusaryabhattai)的开发利用较少,研究发现它可用作土壤益生菌和香草醛生产菌株,尚未见该菌产NHase的相关报道。本研究室从济宁农田土壤中分离出一株较高NHase活性的菌株,对其进行种属鉴定和NHase酶学特性研究,为NHase的产业化生产及酶法制备酰胺化合物奠定基础。
1 材料与方法
1.1 材料与仪器
微生物分离样品 采集自济宁农田土壤;细菌基因组DNA提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒 北京鼎国生物技术有限责任公司;Taq DNA聚合酶 TaKaRa公司;细菌微量生化鉴定管 北京奥博星生物技术有限责任公司;豆粕水解液 山东阳成生物科技公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
分离平板培养基:葡萄糖10 g/L,对羟基苯乙腈4 g/L,蛋白胨10 g/L,酵母浸粉5 g/L,MgSO40.1 g/L,KH2PO40.2 g/L,CoCl20.05 g/L,琼脂20 g/L,pH7.0;斜面保藏培养基:酵母浸粉5 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂20 g/L,pH7.0;基础发酵培养基:葡萄糖20 g/L,对羟基苯乙腈2 g/L,蛋白胨5 g/L,酵母浸粉5 g/L,豆粕水解液10 g/L,MgSO40.1 g/L,硫酸铵2 g/L,KH2PO40.15 g/L,MgSO40.1 g/L,CoCl20.05 g/L,pH7.0。灭菌条件均为:121 ℃灭菌20 min。
LDZX-75KB高压灭菌锅 上海申安医疗器械厂;ZF-5手持式紫外灯 南京隆顺仪器仪表有限公司;PCR仪 美国Bio-Rad公司;SPX-150B-Z生化培养箱 广东省医疗器械厂;ZWY-111G恒温振荡摇床 上海智城分析仪器制造有限公司;TGL-16B高速离心机 上海安亭科学仪器厂;高效液相色谱仪(high performance liquid chromatography,HPLC)(色谱柱为Waters C18柱(250 mm×4.6 mm,10 μm)) 美国Waters公司。
1.2 实验方法
1.2.1 产NHase菌株的分离筛选 称取采集到的土样5 g溶于50 mL无菌水中,混匀后静置沉降,取上清液进行适当稀释后,涂布于分离培养基平皿上,置于培养箱28 ℃条件下培养3 d,挑选单菌落接入含1 mL基础发酵培养基的96孔板,28 ℃下220 r/min振荡培养3 d,加入8 g/L的对羟基苯乙腈并调节pH为7.0转化30 min,10000 r/min离心5 min,取2 μL上清液点样于GF254硅胶板,层析展开1 h(正丁醇∶冰乙酸∶水=5∶1∶2),手持式紫外灯254 nm荧光显色,观察对羟基苯乙酰胺生成情况并挑选色斑大、颜色深的菌株进行复筛。复筛条件为:500 mL三角瓶装50 mL基础发酵培养基、28 ℃、180 r/min摇床振荡培养72 h,发酵结束后10000 r/min离心5 min取上清液测定酶活力,挑选酶活力高的菌株进行鉴定。
1.2.2 菌株鉴定
1.2.2.1 菌株形态及生理生化鉴定 观察复筛得到的菌株在分离培养基上的菌落表观特征,同时对菌体进行革兰氏染色并观察。对待测菌株进行糖醇发酵试验、甲基红试验、硝酸盐还原试验、丙二酸盐利用、接触酶试验和明胶液化等生理生化指标测定,具体参照《常见细菌鉴定手册》[22]。
1.2.2.2 分子生物学鉴定 利用细菌基因组提取试剂盒抽提菌株的基因组DNA,以此为模板利用原核生物16S rDNA通用引物进行PCR扩增。引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),反应体系为25 μL,条件为:预变性94 ℃ 5 min;93 ℃ 45 s,55 ℃ 1 min,72 ℃ 70 s,30个循环;延伸 8 min[23]。PCR产物由上海生工生物工程有限公司测序。测序结果在GenBank数据库BLAST比对,选取相似性高且是有效发表的菌株序列,运用MEGA 5.0的Neighbor-Joining(NJ)法构建系统发育树。
1.2.3 酶活力测定 取1 mL,pH7.0、50 mmol/L磷酸盐缓冲液(含100 mmol/L对羟基苯乙腈),添加适量发酵液,25 ℃反应20 min,立刻加入1 mL三氯乙酸终止反应。10000 r/min离心20 min,HPLC测定对羟基苯乙酰胺含量。液相色谱条件为C18色谱柱(250 mm×4.6 mm,10 μm),柱温25 ℃;检测波长:254 nm;流动相:甲醇∶水∶四氢呋喃∶乙酸(35∶65∶1∶1,v/v),流速:1 mL/min[24]。酶活力定义:在pH7.0、温度37 ℃的条件下,每1 min转化生成1 μmol对羟基苯乙酰胺所需的酶量为1个酶活力单位U。
1.2.4 NHase的分离纯化 发酵液12000 r/min离心20 min去除菌体,清液为粗酶液;加硫酸铵至饱和度为35%,4 ℃静置4 h沉淀杂蛋白,高速离心机12000 r/min离心20 min,收集上清液;继续加入硫酸铵至饱和度为60%,在4 ℃静置4 h后,12000 r/min离心20 min,弃上清液收集沉淀。用pH7.0的Tris-HCl(0.05 mol/L)缓冲液复溶,透析,再经DEAE-Sepharose离子交换层析、Sefinose TMCL-6B凝胶过滤层析纯化后用于酶学性质分析[7]。
1.2.5 酶学性质分析
1.2.5.1 最适温度及稳定性测定 酶液分别在反应温度为25~70 ℃(梯度为5 ℃)、pH7.0条件下测定酶活力,以最高酶活力为100%,确定最适温度。将酶液分别在25~60 ℃(梯度为5 ℃)、pH7.0下处理1 h后冰浴,取样在最适反应温度下测定残余酶活力,以未处理时酶活力为100%,研究酶的热稳定性。
1.2.5.2 最适pH及稳定性测定 将酶液分别在pH为4.0~9.5(梯度为0.5)的50 mmol/L缓冲溶液配制的催化体系反应,底物浓度为100 mmol/L,在50 ℃条件下反应,设最高酶活力为100%,确定NHase的最适反应pH。将酶液分别在pH为4.0~9.0(梯度为0.5)的缓冲溶液体系中4 ℃处理1 h,取样在50 ℃、最适反应pH下测定剩余酶活力,以未处理时酶活力为100%,研究NHase的pH稳定性。
1.2.5.3 金属离子对酶活力影响 在酶反应体系中分别加入1 mmol/L的Fe2+、Cu2+、Mg2+、Co2+、Zn2+、Al3+、Ca2+、Fe3+、Mn2+金属离子化合物,在50 ℃、pH7.0条件下催化反应,以未加金属离子的酶反应体系为参照,酶活力设为100%,研究不同金属离子对NHase活力的影响。
1.2.5.4 米氏常数的测定 将酶液分别与0.1、0.2、0.3、0.4、0.6、0.8、1.0 mM浓度的对羟基苯乙腈底物溶液在50 ℃、pH7.0条件下反应6 min,通过测定酶活力计算酶的反应初速度,通过米氏方程的双倒数形式(Lineweaver-Burk plot)计算酶的Km及Vmax。
1.2.5.5 底物特异性测定 分别选100 mmol/L的对羟基苯乙腈、3-氰基吡啶、4-氰基吡啶、苯乙腈、2-氨基丁腈、苯甲腈、苯丙腈为底物与酶反应,测定酶活力,以对羟基苯乙腈为标准对照,酶活力设为100%,研究酶的底物特异性。
2 结果与分析
2.1 产NHase菌株的分离
由图1可知,以对羟基苯乙腈为诱导物和底物,在分离培养基上稀释涂布挑选单菌落,接种到96孔板发酵初筛,加对羟基苯乙腈转化30 min,用TLC法检测催化产物对羟基苯乙酰胺,通过比移值和产物色度分析,对菌株产生NHase的能力做初步的评判,初筛得到的18株菌株进行摇瓶发酵复筛,培养结束后测定发酵液酶活力,发现菌株Jn-102产酶效果最佳,酶活力达到3.6 U/mL,进一步对该菌株进行种属鉴定和NHase酶学特性研究。

图1 菌株Jn-102转化产物TLC检测Fig.1 TLC test of transformation products from strain Jn-102注:1:对照;2、3:Jn-102菌株转化产物。
2.2 菌株Jn-102的鉴定
2.2.1 菌体及菌落形态及生理生化指标鉴定 Jn-102菌株在分离培养基上培养结果如图2A所示,菌落呈乳白或微黄色、近圆形、培养16 h菌落光滑湿润、24 h菌落表面干燥有褶皱、边缘不规则,易挑取;显微镜观察结果如图2B所示,菌体细胞呈杆状、多数单个分散存在、个别分裂后不断裂,革兰氏阳性,培养72 h后观察芽孢着生在菌体侧端位置,椭圆形或柱形。生理生化检测结果表明,菌株Jn-102 VP试验、氧化酶、触酶、脲酶、酯酶及磷酸酶试验阳性,甲基红、吲哚试验阴性,能同化多数糖醇,不能利用鼠李糖和山梨醇,5% NaCl培养基中生长良好,试验结果详见表1。依据《常见细菌系统鉴定手册》,结合上述试验结果,将菌株Jn-102初步鉴定为芽孢杆菌属(Bacillussp.)。
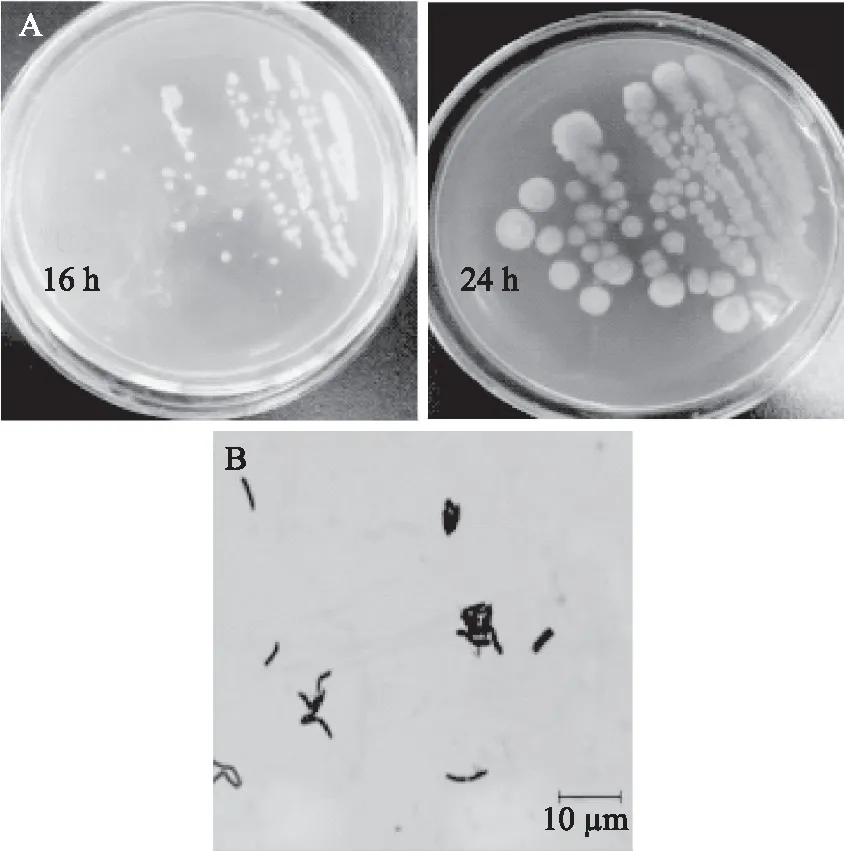
图2 菌株Jn-10216h和24 h的菌落形态(A)及革兰氏染色结果(B)(×1000)Fig.2 Colony morphological characteristics(A)and gram staining(B)of strain Jn-102(×1000)

表1 菌株Jn-102的生理生化特征Table 1 Physiological and biochemical characters of bacillus strain Jn-102
2.2.2 菌株分子生物学鉴定 经测序确定菌株Jn-102 16S rDNA序列长度为1382 bp,提交基因序列信息到NCBI GenBank,得到登录号MF990906,选取与其同源性高且已定名菌株的相关序列信息,用ClustalX 1.83进行序列比对,用MEGA 5.0中的Neighbor-Joining法构建系统发育树,结果如图3所示,可以看出菌株Jn-102和Bacillusaryabhattai的遗传进化距离最近,与已知菌株Bacillusaryabhattai(EF114313)的同源性达到99%以上。结合形态学、生理生化特性指标,鉴定菌株Jn-102为阿氏芽孢杆菌(Bacillusaryabhattai)。

图3 基于16S rDNA序列的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA sequences simility of selected strains注:节点数字表示bootstrap支持率,1000次重复。
2.3 NHase的分离纯化
BacillusaryabhattaiJn-102 NHase纯化结果如表2所示,最终得到NHase的回收率为20.1%,纯化倍数为13.9 倍,比活力355.98 U/mg。
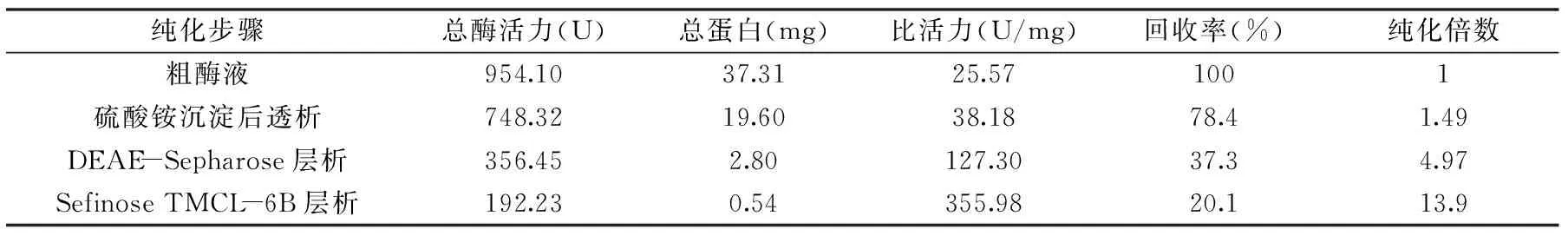
表2 Bacillus aryabhattai Jn-102 NHase分离纯化结果Table 2 Summary of the purification steps of NHase from Bacillus aryabhattai Jn-102
2.4 酶学特性分析
2.4.1 最适温度及稳定性测定 由图4A可以看出,BacillusaryabhattaiJn-102产生的NHase的最适反应温度为50 ℃,并在35~50 ℃范围内均具有较高的酶活力,当温度低于35 ℃时,酶活力随温度升高明显上升,超过50 ℃酶活力迅速降低。该酶的热稳定性研究表明,温度低于40 ℃时该酶稳定性良好,保温1 h仍保留95%以上的活性,温度超过40 ℃时,酶活性变得不稳定,极易失活(图4B)。
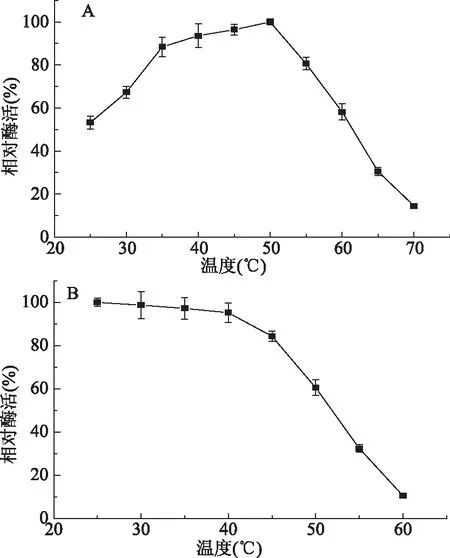
图4 温度对酶活力及酶稳定性的影响Fig.4 Effect of temperature on the activity and stability of nitrile hydratase
2.4.2 最适pH及稳定性测定 测得NHase在不同pH下的酶活力,结果见图5A,图中显示该酶催化反应的pH在6.5~7.5之间活力均较高,其最适反应pH为7.0,当pH在6.5以下或7.5以上时,酶活力下降较快。酶的稳定性验证如图5B所示,该酶在pH6.0~8.0的条件下保存1 h后仍保留85%以上的酶活力,可见在此pH范围内酶稳定性较高,而pH低于或高于此pH范围时,酶活力均出现较为明显的降低。
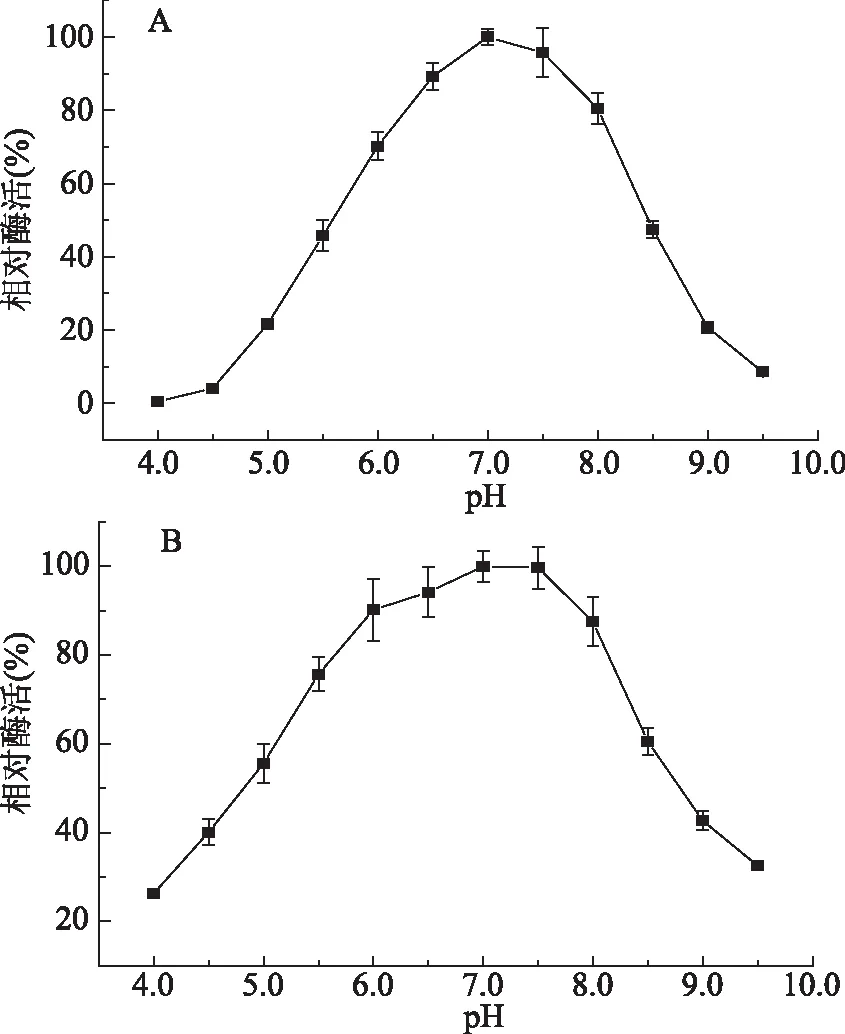
图5 pH对酶活力及酶稳定性的影响Fig.5 Effect of pH on the activity and stability of nitrile hydratase
2.4.3 金属离子对酶活力影响 NHase一般为金属酶,金属离子和酶活性密切相关。金属离子对NHase酶活力影响结果如表2所示,Co2+和Mg2+对NHase酶活力有轻微激活作用,但作用不明显,和对照组相当。而其他金属离子对酶活均有着不同程度的抑制作用,其中Zn2+的抑制作用最强烈,酶活力剩余68.3%。
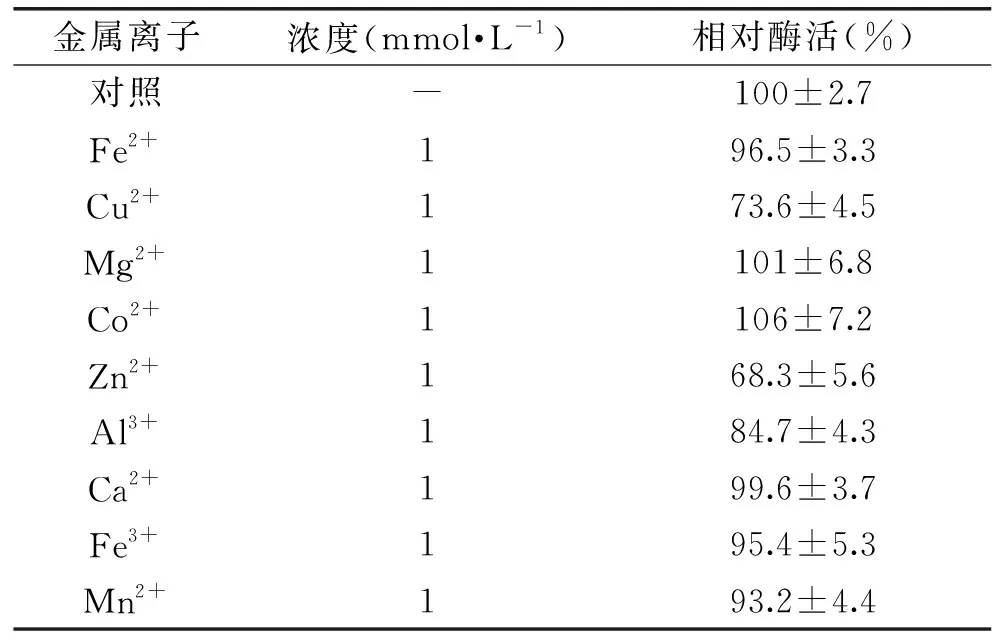
表2 金属离子对卡拉胶酶活性的影响Table 2 Metal ions on nitrile hydratase activity
2.4.4 酶促反应动力学参数的测定 由图6可知,BacillusaryabhattaiJn-102的NHase水解对羟基苯乙腈符合米氏动力学方程,经计算酶促反应动力学常数Km=21.3 mmol/L,最大反应速率Vmax=60.2 μmol/(min·mg)。Jn-102的NHase对对羟基苯乙腈显示出较高的亲和力,Km低于已有文献的报道[7-12]。
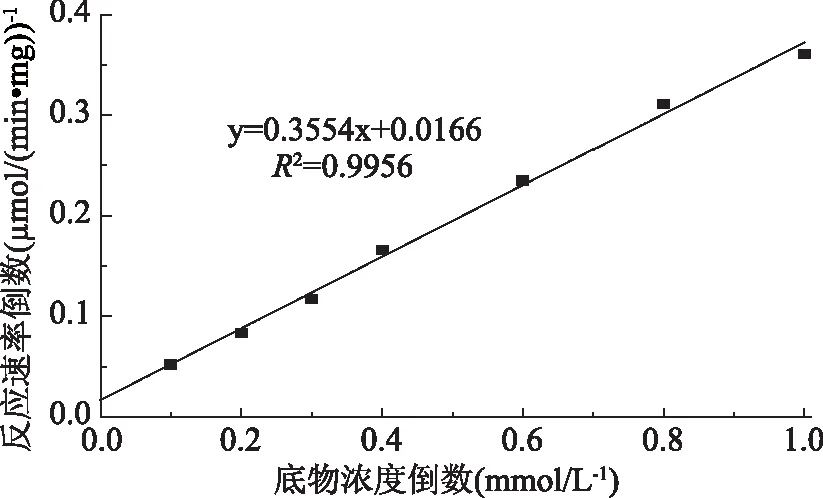
图6 双倒数法测定Bacillus aryabhattai Jn-102的动力学参数Fig.6 Kinetic parameters determination of nitrile hydratase from Bacillus aryabhattai Jn-102 by Lineweaver-Burk plot
2.4.5 底物特异性测定 底物特异性试验结果如表3所示,NHase对于受试的7种腈类底物均能发生水合作用,形成相应的酰胺化合物,没有严格的底物特异性,尤其对3-氰基吡啶和4-氰基吡啶催化活性较高,相对酶活达到对羟基苯乙腈的200%以上,但对苯甲腈、2-氨基丁腈的活性较低。
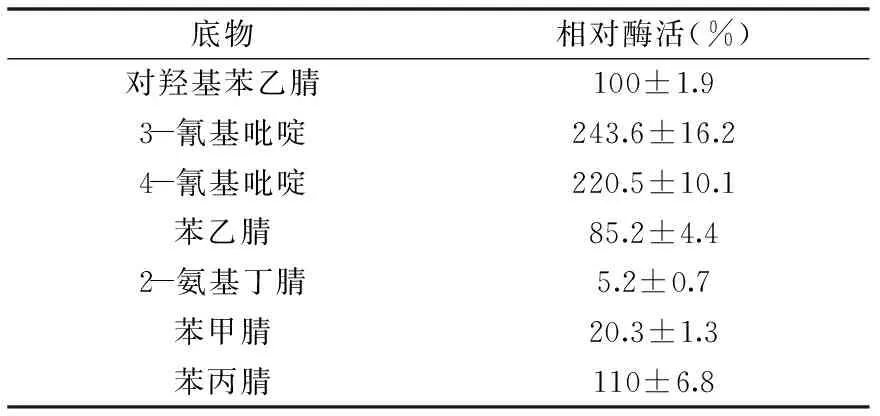
表3 菌株Jn-102产腈水合酶的底物特异性Table 3 Substrate specificity of nitrile hydratase from Jn-102
3 结论
本研究自济宁农田土壤中分离到产NHase活力较高的菌株Jn-102,经分子生物学、生理生化及形态学特征鉴定为阿氏芽孢杆菌(Bacillusaryabhattai)。对其酶学性质进行研究,结果表明酶的最适反应温度和pH分别为50 ℃和7.0,在40 ℃以下和pH6.0~8.0范围内酶活力较稳定,具有较宽的底物谱,对芳香腈有较好的水合作用,以对羟基苯乙腈为底物时,Km值和Vmax值分别为21.3 mmol/L和60.2 μmol/(min·mg),Co2+和Mg2+等对酶活力有轻微的促进作用,而Zn2+对酶活力有强烈的抑制作用。这些性质不同于以往报道的NHase,具有良好的开发应用前景,为今后进一步研究NHase在制备酰胺化合物中的应用提供技术支撑和研究基础。

