表达猪白细胞介素2(pIL-2)重组乳酸杆菌的构建
沙万里,闫 满,刘仲藜,韦舒婉,李国江,2
(1.吉林农业科技学院动物科技学院,吉林 吉林 132101;2.预防兽医学吉林省重点实验室,吉林 吉林 132101)
随着国家规模化养殖技术的推广以及饲养环境恶化程度的加剧,禽流感、猪流感等各种传染类疾病对养殖业甚至人类的危害越来越严重,防治难度越来越大,传统防治方法已凸显其不足[1]。对新型免疫治疗剂、免疫增强剂以及基因工程疫苗的需求尤为迫切。
目前,白细胞介素2(IL-2)已是一种在预防和治疗疾病方面备受关注的重要细胞因子。IL-2具有广泛生物活性,可促进T、B淋巴细胞、NK细胞增殖与分化,促进干扰素(Interferon,IFN)、肿瘤坏死因子(Tumor necrosis factor,TNF)等细胞因子分泌[2],提高动物机体细胞免疫和体液免疫能力,解除机体免疫抑制,增强疫苗免疫效果[3],降低疫苗副反应,治疗寄生虫感染。IL-2在抗病毒、抗感染、抗毒素、抗肿瘤及免疫调节中发挥重要作用,在动物疾病防治中倍受关注,可作为免疫佐剂增强疫苗免疫效果[4]。
乳酸菌可通过口服途径影响人类和动物胃肠道从而影响机体的健康,作为一种工程菌,它受到广泛的关注并得以应用。乳酸菌作为口服给药系统及其用途已经被不断地开发,大部分乳酸菌在消化道可以存活并且一些可持续定植于肠内,有些菌系是人类共生菌群的成员[5]。乳酸菌能够递呈生物分子通过M细胞或树突状细胞穿过上皮细胞。乳酸菌作为载体递呈生物分子到肠胃道中治疗疾病的研究日益成熟,包括肽疗法,低聚糖和核酸的大分子口服药物载体(或大分子的口服给药方式)是现代生物技术制药的一项主要挑战[6]。其优点是避免免疫原性的附加风险、伴随非肠道投药的带来的疼痛和不适以及低廉的加工成本。将乳酸菌作为表达载体能够递呈生物分子至肠道中,通过与特异的细胞相互作用而发挥调节机体免疫能力[7-9]。而口服给药系统又是替代非肠道给药的有效途径,可以减少因长期用给药病人带来的不便和痛苦,具有广阔的市场前景。本研究通过PCR的方法在pMD18-T-pIL-2质粒上扩增pIL-2基因,并于乳酸杆菌表达载体pSIP409链接,应用重组乳酸杆菌表达猪白细胞介素2(pIL-2)。为制备新型微生态制剂防治动物重大疫病以及降低抗生素残留促进动物性食品安全具有重要意义。
1 材料与方法
1.1 载体和细胞 大肠杆菌-乳酸菌穿梭表达载体pSIP409由Senior Research Scientist Norwegian Food Research Institute赠送;LactobacillusplantarumNC8、重组质粒pMD18-T-pIL-2和E.coliBL21由吉林农业大学动物科学技术学院动物微生态学研究室保存;E.coliDH5α,购自TIANGEN公司;猪肠道上皮细胞(IPEC-J2)由吉林农业大学动物科技学院王春凤教授惠赠;产肠毒素大肠杆菌(ETEC)菌株,购自中国兽医药品监察所。
1.2 主要试剂 TRIZol、ExTaqDNA聚合酶、KpnI、HINDⅢ限制性内切酶、dNTPs、反转录酶和T4 DNA连接酶,购自TaKaRa公司;猪IL-2单克隆抗体,购自美国BIO-RAD公司;质粒、DNA凝胶回收试剂盒,购自OMEGA公司;T4 DNA连接酶,反转录试剂盒,购自上海捷瑞生物工程有限公司;EB购自爱普华美生物技术(北京)有限责任公司;PVDF转移膜,购自Gleman公司;其他常用的主要试剂均为进口产品或国产分析纯产品。
1.3 主要仪器设备 PCR仪(TC-25/H,杭州博日科技有限公司);数显恒温测速双功能气浴缸(ZD-88,江苏金坛市华城开元实验仪器厂);电热恒温水槽(DK-8D,上海精宏实验仪器设备有限公司);凝胶成像系统(美国UVP公司,76-0312-02);水平电泳仪(DYY-6B,北京六一仪器厂);041BR 02682垂直电泳仪(美国BIO-RAD公司);高压蒸汽灭菌锅(西班牙Selecta公司,presoclave75);低温超速离心机(3K30,德国Sigma公司);电穿孔仪(411BR4513,美国BIO-RAD公司);超声波细胞粉碎机(宁波新芝生物有限公司,JY88-Ⅱ);Uvmini-1240分光光度计(岛津SHIMADZU);RPMI1640细胞培养基,购自上海江莱生物科技有限公司;CO2培养箱,购自日本三洋公司。
1.4 重组乳酸杆菌(pSIP-409-pIL-2)载体的构建 将重组质粒pMD18-T-pIL-2和表达载体pSIP409用KpnI、HindⅢ限制性内切酶进行双酶切。琼脂糖凝胶电泳后,回收目的片段,用T4 DNA连接酶将回收的外源目的基因片段pIL-2与表达载体pSIP-409连接。并将重组后的pSIP-409-pIL-2载体转化至DH5α感受肽细胞中。
1.5 重组乳酸杆菌(pSIP-409-pIL-2)载体的鉴定 选取培养基中生长较好单菌落(疑似阳性重组菌)加入5 mL LB液体培养基中,再加入50 μL Em(使培养基Em浓度为200 μg/mL)37 ℃摇床180 r/min震荡培养过夜。提取重组质粒pSIP-409-pIL-2 进行PCR与双酶切鉴定。并将PCR和双酶切初步鉴定的pSIP-409-pIL-2质粒送往吉林省库美生物科技有限公司进行测序分析。
1.6 重组乳酸杆菌的构建 利用电转化仪将重组质粒pSIP409-pIL-2转化至制备好的乳酸菌感受态细胞。均匀涂布于红霉素抗性的MRS平板上。将生长较好的重组阳性菌单菌落接种于含有红霉素抗性的MRS液体培养基中,30 ℃厌氧培养24 h,取800 μL菌液与200 μL 80%甘油加入1.5 mL离心管中,封口置于-20 ℃保菌。然后将剩余菌液12 000 r/min离心1 min,弃上清后向菌体加入50 μL溶菌酶混匀,并置于37 ℃的水浴中裂解30 min,提取质粒,进行PCR与双酶切鉴定。
1.7 重组乳酸杆菌中IL-2的表达 将重组乳酸杆菌接种于红霉素抗性的MRS液体培养基中,30 ℃厌氧培养24 h。将培养物以1∶100扩大培养一代至OD600值为0.3,加入SppIP诱导表达5 h和7 h。调菌液至相同浓度,离心收集菌体。以上述方法诱导含空载体的乳酸杆菌5 h样品作对照。制备蛋白样品进行12%凝胶SDS-PAGE电泳分析。
1.8 Western Blot检测重组乳酸杆菌中IL-2的表达 SDS-PAGE电泳结束后,将蛋白转印至PVDF膜上,膜用5%脱脂奶粉室温封闭1.5 h后,PBST洗膜4次,用PBST按照1∶1 000稀释猪IL-2单克隆抗体,加到膜上,4 ℃过夜,次日PBST洗膜4次,再加入用PBST稀释的HRP标记的二抗(1∶5 000),室温孵育1.5 h,PBST洗膜4次,用ECL显色,扫描记录。
1.9 免疫荧光法检测重组乳酸菌对猪肠道上皮细胞的粘附性 取高压灭菌后的盖玻片,置于24孔板中,取IPEC-J2细胞每孔500 μL接种过夜,次日细胞长至80%密度,吸取培养液,PBS清洗3次,每孔加入0.5 mL菌悬液与1640培养液0.5 mL,37 ℃培养2 h吸取培养液,PBS清洗3次。加入0.5 mL ETEC菌悬液与0.5 mL 1640培养液,37 ℃培养2 h,PBS清洗5次,4%预冷甲醛室温固定20~30 min,PBS洗5次。0.2%Triton X-100作用2~5min,PBS洗5次。100 mL/L的小牛血清白蛋白室温封闭30 min,弃上清。加入相应抗体,放在湿盒里,4 ℃过夜,PBS漂洗3次,每次10 min,加入相应二抗,室温2 h,PBS漂洗3次,95%甘油封片。
2 结果
2.1 重组质粒pSIP-409-pIL-2的PCR鉴定和双酶切鉴定 将提取的重组质粒pSIP-409-pIL-2适当稀释后作为模版,通过PCR扩增进行鉴定。扩增产物在465 bp处出现pIL-2目基因条带,与预期结果相符(图1)。用KpnI和HindⅢ 限制性内切酶对重组质粒pSIP-409-pIL-2进行酶切鉴定,结果位于5 627 bp和465 bp处出现载体带和目的条带,说明IL-2基因与表达载体正确连接(图2)。
2.2 目的基因的测序鉴定 吉林省库美生物科技有限公司进行测序分析结果,同GenBank上登陆的猪白细胞介素-2基因进行同源性比较。结果表明,本试验克隆得到的pIL-2基因序列与公布的pIL-2基因序列同源性达到100%(图3)。

图1 PCR扩增产物琼脂糖电泳
M: DL-2 000 Marker; 1: pSIP-409-pIL-2; 2: pSIP-409

图2 双酶切琼脂糖电泳
M1:λDNA/HindⅢ Marker; M2: DL-2 000 Marker; 1-6: pSIP-409-pIL-2酶切产物

图3 猪白细胞介素2 PCR产物测序结果
2.3 重组乳酸杆菌的表达 将含有重组质粒pSIP-409-pIL-2的乳酸杆菌诱导表达后,用12%SDS-PAGE凝胶电泳分析,与含有空载体的乳酸杆菌相比,重组的乳酸杆菌又到后5 h、7 h有pIL-2蛋白表达,约在17.4 kDa处有明显的条带(图4)。

图4 重组乳酸杆菌诱导表达产物SDS-PAGE电泳
M:低分子量蛋白质Marker; 1:L. pSIP-409; 2:L. pSIP-409-pIL-2诱导5 h后表达产物; 3:L. pSIP-409-pIL-2诱导7 h后表达产物
2.4 Western Blotting鉴定pIL-2蛋白的表达 如图5所示,17.4 kDa处有一条明显的蛋白印迹条带,而含有空载体的对照组却无印迹条带。证实重组乳酸杆菌表达的pIL-2蛋白具有反应原性。

图5 Western Blotting检测pIL-2蛋白
M:低分子量蛋白质Marker; 1:L. pSIP-409-pIL-2; 3:L. pSIP-4092.5 pSIP409-IL-2重组乳酸菌对IPEC-J2猪肠道上皮细胞粘附性
通过与IPEC-J2猪肠道上皮细胞共培养,猪白细胞介素-2重组乳酸菌与IPEC-J2猪肠道上皮细胞具有较好的粘附性(图6);空载体乳酸菌组IPEC-J2猪肠道上皮细胞结构松散,细胞间粘连蛋白表达量少,而猪白细胞介素-2重组乳酸菌组IPEC-J2猪肠道上皮细胞结构紧密,细胞间粘连蛋白表达量较多。
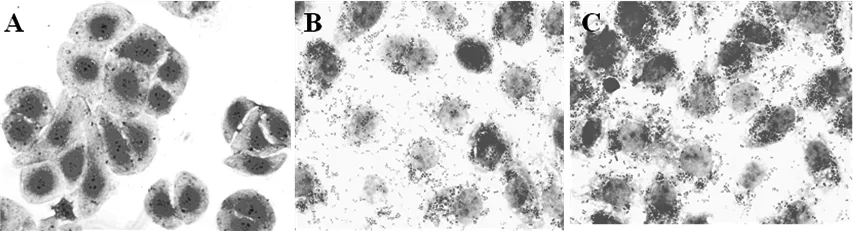
图6 pSIP409-IL-2重组乳酸菌对IPEC-J2猪肠道上皮细胞粘附性 (×400)
A:PBS; B:pSIP-409; C:pSIP-409-pIL-2
3 讨论
IL-2能够诱导IL-2Rα和IL-2Rβ的表达,而经由IL-2Rβ 的异二聚体和γc胞质区的IL-2信号可以导致至少3条信号通路(磷酸肌醇3-激酶、Ras-MAP 激酶和JAK-STAT 通路)的激活[10-11],同时也能够激活STAT3 和STAT1。这3种不同方式的信号通路能够调节细胞生长、存活、诱导细胞凋亡和分化。IL-2促进CD8+分化为效应/记忆细胞毒性T淋巴细胞[12]。因此,IL-2的关键作用在于调节TH细胞的分化,发挥其生物学效应。
在体外,Th 17的分化是通过IL-6和TGF-β共同介导的。抗IFNγ和抗IL-4被特有的添加阻止了Th 1和Th 2的分化,更有意义的是,IL-2信号能消除Th 17细胞的产生。因为IL-6信号通过STAT3激活,而IL-2信号通过STAT5激活[13]。通过STAT5激活的IL-2在IL17a基因位点和STAT3结合位点相互竞争,抑制IL17a的转录。IL-2抑制IL-6Rα 和 gp130的表达,然而,相反的是这些受体和IL17a的表达增加在IL2-/-T细胞中[14]。IL-2在Th17的调节中起着复杂作用。在添加CD4+细胞后,IL-2能促进CD8+T细胞分化成效应/记忆细胞毒性T淋巴细胞,这一过程依赖于IL-2/IL-2R信号的增强, 说明IL-2在记忆性CD8+T细胞扩增过程中起着关键作用。增加IL-2/IL-2R信号能促进效应细胞毒性T淋巴细胞的分化[15]。
但同时也存在许多问题如表达载体的选用:真核表达载体在真核细胞内能稳定地表达外源目的基因,但蛋白表达量较低、纯化工艺复杂,从而提高规模化生产成本,而原核表达载体表达外源蛋白量高、成本低、可应用性强,但同时容易形成难溶的包涵体蛋白,纯化后所表达蛋白构象是否具有较高生物活性[16];外源性与内源性差异:外源IL-2毕竟不是自身所产生,在调节机体免疫系统的同时存在潜在的副作用;给药途径:采用注射方法和口服建立黏膜免疫是两种不同的途径,针对不同的疾病究竟哪种方法的免疫和治疗效果最佳还有待摸索;添加剂量与时相:大量试验表明,低剂量使用IL-2效果不佳,而高剂量使用又会产生自身免疫抑制,导致自身免疫系统失衡,IL-2半衰期短,有时还可在体内诱导产生一定抗体,这也是研制长效剂型IL-2产品制约因素之一;以及抗原表位的优化和动物安全性等方面还有待于进一步研究。

