奶牛隐性乳房炎致病性大肠杆菌AI-2信号分子检测
曹素芳,吴 迪,孔兰芳,皇甫和平,陈文定
(1.河南牧业经济学院动物医学院,河南 郑州 450046;2.河南农业大学,河南 郑州 450002)
奶牛乳房炎是指奶牛乳腺组织受到微生物感染、机械损伤、热损伤和化学物品刺激而引起的一种炎症。在乳房炎中隐性乳引起产奶量急剧下降,奶品质下降。致病性大肠杆菌是导致奶牛隐性乳房炎最主要的乳房炎最为多见,发病率达到60%以上,是主要致病菌之一。
研究发现,为了适应复杂的生活环境,细菌通过产生的信号分子(Autoinducer,AI)进行细胞间或细胞自身内部的信息交流,统一协调细菌间的群体行动[1],共同完成个体无法完成的生物学功能。细菌群体间信号交流现象称为细菌密度感应现象。研究显示,革兰阴性菌中的LuxS/AI-2密度感应系统,可通过合成AI-2分子调节细菌多种生物学功能[2-3]。为了探索牛源大肠杆菌AI-2信号分子产生情况,本试验以分离于河南省某奶牛场隐性乳房炎中致病性大肠杆菌为研究对象,利用哈维弧菌BB170检测致病性大肠杆菌AI-2产生情况,探索不同培养条件及不同生长时期大肠杆菌分泌AI-2分子活性,应用实时荧光定量PCR研究其催化基因luxS和pfs的转录水平,为进一步探讨牛源致病性大肠杆菌的致病机理奠定基础。
1 材料与方法
1.1 菌种 大肠杆菌E80814、W41、EA701205、E30707和E285株分离于河南新乡某奶牛场;哈维弧菌BB170和BB152均由韩先干博士惠赠;DH5α本室保存。
1.2 主要试剂 L-Arg、Marine Broth、Vitamin-free Casa -mino Acids,均购自Difco公司;TRIZol,购自Promega公司。
1.3 方法
1.3.1 奶牛隐性乳房炎中大肠杆菌信号分子AI-2的制备 参照文献[4]方法,稍加改进。具体如下:挑取阳性对照菌BB152单个菌落加入5 mL的MB液体培养基中,28 ℃振荡16~18 h,将过夜菌液稀释100倍后接入5 mL MB中,28 ℃振荡培养过夜,13 000 r/min(4 ℃)离心10 min,取上清,过滤除菌,-80 ℃保存备用。
挑取奶牛隐性乳房炎致病性大肠杆菌E80814、W41、EA701205、E30707、E285株及阴性对照菌DH5α单个菌落,分别接种5 mL LB液体培养基中,37 ℃振荡培养16~18 h,培养的菌液再稀释100倍后分别加入5 mL LB液体培养基中,37 ℃培养过夜,13 000 r/min(4 ℃)离心10 min,取上清,过滤除菌,-80 ℃保存备用[5]。
1.3.2 哈维弧菌BB170的培养 挑取哈维弧菌BB170单个菌落加入5 mL MB液体中,28 ℃振荡培养过夜,过夜菌液稀释100倍后加入5 mL MB液体中,28 ℃振荡培养过夜,使其OD620值达到0.4~0.5。
1.3.3 检测AI-2的活性 参照文献[5]方法,稍加改进。具体如下:将上述BB170菌液用新鲜配制的AB培养基进行5 000倍稀释,分别加入10%E80814、W41、EA701205、E30707和E285培养上清,阳性菌BB152培养上清,阴性菌DH5α培养上清,28 ℃ 振荡培养5 h后用全自动多功能酶标仪检测BB170的发光情况,每组培养物做3个重复孔。
1.3.4 检测奶牛隐性乳房炎的大肠杆菌不同生长时期AI-2的表达 取E285单个菌落接种于5 mL的LB液体培养基中,37 ℃振荡培养过夜,过夜菌液进行100倍稀释后加入LB液体培养基中,37 ℃培养至迟缓期(OD600值=0.1),对数前期(OD600值=0.7),对数中期(OD600值=1.6),对数后期(OD600值=2.3),稳定期(OD600值=2.6),按照1.2.1的方法制备培养上清,-80 ℃冷冻备用。AI-2检测同1.2.3,沉淀用于提取细菌总RNA。
1.3.5 不同培养条件奶牛隐性乳房炎大肠杆菌的AI-2的活性检测 取E285单个菌落接种于5 mL的LB液体培养基中,37 ℃培养过夜,按1∶100稀释后分别加入含0.5%葡萄糖、0.5%甘露醇、0.5%乳糖、0.5%蔗糖、0.5%麦芽糖及0.5%NaCl的LB液体培养基中,37 ℃培养至对数期(OD600值=1.2),按照1.2.1的方法收集AI-2,-80 ℃ 冷冻备用,AI-2的活性检测同1.2.3。沉淀用于提取细菌总RNA。
1.3.6pfs和LuxSmRNA的水平检测
1.3.6.1 引物设计 根据GenBank 中大肠杆菌pfs和luxS基因序列分别设计特异性引物,pfs-F(5′-ACGCCATTACCGTTAAGATG-3′)和pfs-R(5′-AGTGATGCCAGAAAGAGGGA-3′),扩增长度为169 bp;LuxS-F(5′-CGGCAACAGCCAGGAACTCA-3′)和LuxS-R(5′-GCGAAAATCCGCCACAACTT-3′),扩增长度为81 bp,同时设计内参引物dnaE-F(5′-CTGGCA TTGTCATGGACTCT-3′)和dnaE-R(5′-GCGATGATCTT GATCT TCAT-3′),扩增长度约为80 bp。
1.3.6.2 细菌总RNA的提取 取适量的1.2.4和1.2.5中的细菌沉淀,加入1 mL TRIZol,混合均匀,再加入200 μL氯仿,振荡混匀,20 ℃~25 ℃静置3 min;13 000 r/min(4 ℃)离心15 min,吸取上清,加入500 μL 异丙醇,振荡均匀,13 000 r/min(4 ℃)离心10 min,去上清,用75%乙醇洗涤,真空干燥,加入30 μL无RNase的ddH2O溶解,-80 ℃保存备用。
1.3.6.3 反转录合成cDNA 取16 μL提取的细菌总RNA,加入1 μL的随机引物,70 ℃温育5 min,冰浴2 min,再依次加5 μL 5×M-MLV Buffer, 2 μL 4dNTP,1 μL M-MLV酶,1 μL RNase抑制剂,混匀,42 ℃温育1 h,-80 ℃保存备用。
1.3.6.4 Real-time PCR法检测mRNA转录水平 以dnaE为内参,应用real-time PCR检测luxS和pfs基因mRNA转录情况。将获得的cDNA 进行5倍稀释,制定标准曲线,每个稀释度重复两孔,待测样品做重复3次。
在20 μL体系中加入10 μL 的Real- time PCR Master Mix,1 μL的cDNA,0.5 μL的上游引物,0.5 μL的下游引物,8 μL 的ddH2O,混匀后50 ℃ 温育2 min后进行扩增,95 ℃ 变性10 min后进行循环,95 ℃ 15 s,60 ℃ 1 min,40cycle。应用2-△△Ct(Livak)法计算luxS基因和pfs基因的mRNA。
2 结果
2.1 不同的奶牛隐性乳房炎大肠杆菌AI-2的检测 以BB152为阳性对照,DH5α为阴性对照,利用哈维弧菌BB170检测分离于奶牛隐性乳房炎的致病性大肠杆菌AI-2的产生情况,结果表明,分离于奶牛隐性乳房炎致病性大肠杆菌E285、E80814、W41、E30707和EA701205株均有AI-2信号分子产生,但产生的AI-2的量均低于阳性对照(图1-1)。
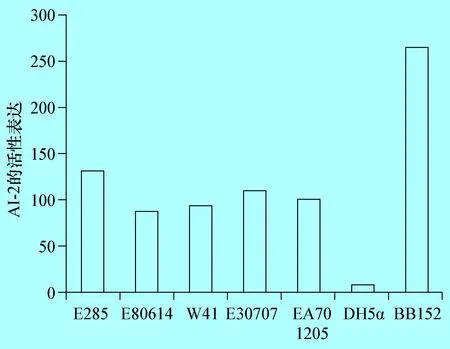
图1不同的牛致病性大肠杆菌AI-2的检测
2.2 不同生长时期E285株AI-2检测 对不同生长时期的牛致病性大肠杆菌E285株AI-2活性检测结果表明,在迟缓期、对数前期E285的基本没有AI-2的表达,从对数中期开始E285细菌开始大量表达AI-2,到对数后期达到高峰,为阴性对照的12倍,随后下降,到稳定期已下降为阴性对照的3.6倍(图2)。
2.3 检测不同培养条件下奶牛隐性乳房炎大肠杆菌AI-2产生 将致病性大肠杆菌E285株分别接种于含0.5%蔗糖、0.5%麦芽糖、0.5%葡萄糖、0.5%甘露醇、0.5%NaCl及0.5%乳糖液体LB培养基中,检测其AI-2活性,结果表明,LB液体中加入0.5%蔗糖、0.5%麦芽糖、0.5%葡萄糖、0.5%甘露醇、0.5%NaCl及0.5%乳糖时,AI-2的活性明显提高(P<0.01),均高于阴、阳性对照。分别为阴性对照的3.8倍、3.4倍、4.6倍、3.7倍、3.5倍、5.3倍(图3),其中加入乳糖后E285株的AI-2上调倍数最大。

图2E285株在不同生长时期AI-2活性检测

图3E285不同培养条件下AI-2活性检测(P<0.01)
2.4 奶牛隐性乳房炎大肠杆菌E285株不同生长时期luxS与pfsmRNA的检测 根据real-time PCR扩增曲线显示dnaE基因、LuxS基因和pfs基因扩增效率均到达96%-104%(图略),应用2-△△Ct(Livak)法分析luxS基因和pfs基因的mRNA水平,结果显示,从迟缓期开始E285株luxS的mRNA水平显著增加(P<0.01),到对数前期达到最高,为迟缓期的8.7倍,随后就慢慢降低,到稳定期时mRNA水平降至阴性对照的3.6倍(图4),这与E285株在不同生长期AI-2的表达变化结果一致。pfs基因的mRNA的转录结果分析表明,其转录水平在前期并未有大的变化,只有在稳定期达到最高,是迟缓期的5.3倍。
2.5 E285株不同培养条件下luxS基因和pfs基因mRNA的分析 当LB液体中分别加入0.5%蔗糖、麦芽糖、葡萄糖、甘露醇、NaCl和乳糖时,E285株luxS基因的mRNA均明显上调(P<0.01),分别为未加的2.39倍、2.12倍、2.89倍,2.33、2.21倍和3.31倍,加入乳糖luxS基因的mRNA量最高,与AI-2活性表达一致。对pfs基因的mRNA分析结果表明,加入蔗糖、葡萄糖后明显下降(P<0.01),分别为未加时的0.82倍和0.9倍,而加入麦芽糖、甘露醇、NaCl和乳糖时上调明显,分别为未加时的2.1倍、1.96倍、2.03倍、3.21倍(图5),与AI-2活性表达变化无相关性。
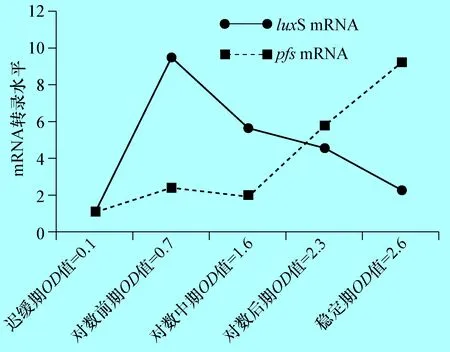
图4 E285株在不同生长时期luxS基因和pfs基因的mRNA转录 (P<0.01)

图5 E285株在不同培养条件下luxS基因和pfs基因的mRNA转录
3 讨论
研究证明,革兰阴性菌存在luxS/AI-2密度感应系统,该系统调控着细菌群体活动,与细菌的致病性、毒力基因的表达和生物发光等有关。徐苹[6]等研究弗氏志贺菌的信号分子AI-2时发现,弗氏志贺菌在生长过程中分泌的AI-2具有生物学活性,通过获得基因重组AI-2菌株构建发现,密度感应系统,重组菌株具有更好的生长优势。罗哲[7]等通过构建luxS基因缺失株的伤寒沙门菌,与野生型菌相比,缺失株不能使报告菌株发光,证明luxS基因可以介导AI-2的合成,并引起细菌的发光。本试验以DH5α为阴性对照,BB152为阳性对照,检测了分离于奶牛隐性乳房炎致病性大肠杆菌中AI-2产生情况,结果表明,所获得的5株均可以产生AI-2,其中E285株AI-2活性最高,但均低于阳性对照,不同的菌株间产生AI-2的水平差异很大,究其原因可能是由于菌株之间的差异导致而成的。
本试验中对E285株不同生长时期中AI-2信号分子检测结果表明,在对数后期AI-2表达量最高,与Jones M B等[8]、罗哲等[8]报道的伤寒沙门菌的AI-2信号分子的表达量最高是在对数中期的结果不一致,其原因可能是菌种不同。本试验结果显示,E285株的AI-2信号分子的变化规律与luxS表达量呈正相关,而与pfs的表达量没有明显的相关性。Moslehi-Jenabian S[9]等报道了嗜酸乳杆菌中AI-2信号分子的活性与luxS的表达量之间的关系,结果与本研究相一致。Han等[10]研究证明,细菌中的S-核糖同型半胱氨酸对细菌中的luxS表达量有一定的影响。对数生长期前,S-核糖同型半胱氨酸浓度较低,luxS表达量是AI-2分子数量的直接决定因素。细菌对数生长期后,S-核糖同型半胱氨酸浓度大幅提高,导致pfs的表达量也显著上升,而pfs的表达有助于S-核糖同型半胱氨酸的生物降解。
在培养E285株时加入麦芽糖、葡萄糖、甘露醇、乳糖及NaCl后,AI-2 信号分子的活性显著提升,其中加入乳糖诱导产生的AI-2最多,活性最强,与猪链球菌、炭疽杆菌、鼠伤寒沙门菌等结果相符,推测其原因可能是麦芽糖、葡萄糖、乳糖等浓度提高导致糖酵解途径的活跃,甘油-3-磷酸脱氢酶得到了累积,从而抑制了基因的表达量,lsr 转运蛋白可以将AI-2信号分子从胞外运输到胞内,其表达量的降低使得AI-2信号分子在胞外大量累积。但也有报道称,麦芽糖和葡萄糖提供了充足的碳源,AI-2信号分子被大量的运输到胞外所致[11]。本试验中加乳糖时没有导致AI-2下降,与白灏[6]报道的禽致病性大肠杆菌结果不同,推测可能是牛源致病性大肠杆菌对蔗糖的代谢途径的不同。

