非洲猪瘟K205R蛋白的原核表达及多抗的制备
杜方原,冯春燕,仇松寅,王彩霞,张永宁,林祥梅,吴绍强
(中国检验检疫科学研究院动物检疫研究所,北京 大兴 100176)
非洲猪瘟病毒(Africanswinefevervirus,ASFV)是具有二十面体结构的DNA病毒,是非洲猪瘟病毒科的唯一成员,能引起猪的急性、热性、高度接触性传染疾病[1]。疣猪等野生哺乳动物在感染ASFV后并不一定会发病,为发现及预防ASFV增加了更大的难度[2]。目前ASFV并没有有效的疫苗进行防控,因此,建立快速准确的诊断方法是防控该病的重要手段。
ASFV基因组全长约170 kb,含有150多个开放阅读框。K205R蛋白由未分配的开放阅读框编码[3],Reis等人的研究表明,K205R蛋白诱导猪只能产生较强的免疫反应,是ASFV主要的抗原之一[4]。K205R主要在动物的感染初期表达,这对ASFV的早期诊断具有重大意义[5]。为此,本研究利用大肠杆菌原核表达系统表达ASFV K205R蛋白,在其基础上制备多抗,以期为建立该病的血清学检测方法提供生物材料。
1 材料与方法
1.1 材料 大肠杆菌BL21细胞,pET-21a载体,pMD18-T载体、限制性内切酶BamHI、XhoI,T4 DNA连接酶,购自宝生物工程(大连)有限公司; 普通TaqDNA聚合酶,购自北京全式金生物技术有限公司。
IPTG、蛋白质Marker和 Western Blot 发光液等,购自北京全式金生物技术有限公司;镍离子金属螯合(Ni-NTA)预装柱,购自QIAGEN公司;辣根酶标记猪IgG二抗,购自Abcam公司;辣根酶标记兔IgG 二抗,购自北京中杉金桥生物技术有限公司;引物合成及测序由英潍捷基(上海)贸易有限公司完成。
1.2 方法
1.2.1 K205R基因的扩增和质粒构建 参考ASFV的BA71V毒株(GeneID:22220430)的K205R基因序列,合成K205R基因,该基因编码框全长615 bp,其编码蛋白全长205个氨基酸,分子量约为23.7 kDa。合成的K205R基因插入pMD-18-T 质粒,即为pMD18T-K205R质粒。
根据K205R的基因序列,用Primer 5.0设计引物,并在上、下游引物分别引入酶切位点BamHI和XhoI,上游引物ASFV-205-R:5′-CCGCTCGAGCTTCTTCATCATCTCTTTG-3′(Xho I),下游引物ASFV-205-F:5′-CGCGGATCCATGGTTGAGCCACGCGAA-3′(BamH I)。利用上述引物,以pMD18T-K205R质粒为模板,进行PCR扩增。25 μL 的PCR反应体系为,2× PCR Mix 12.5 μL,ddH2O 10 μL,ASFV-205-21a-F 1 μL,ASFV-205-21a-R 1 μL,模板 0.5 μL。反应条件为96 ℃预变性60 s,94 ℃ 40 s,56 ℃ 60 s,72 ℃ 140 s,共30个循环;72 ℃延伸10 min。扩增的片段经过BamHI和XhoI酶切纯化后,和经酶切纯化的pET-21a载体DNA,在T4 DNA 连接酶作用下,于16 ℃过夜,连接产物转化大肠杆菌DH5α感受态细菌,筛选抗卡那霉素菌落,对pET21a-K205R 的K205R 蛋白基因进行测序,鉴定重组表达质粒。
将pET-21a-K205R 重组质粒转化感受态大肠杆菌BL21(DE3)细菌,所获得的转化细菌即为pET-21a-205R-BL21 菌株,该菌株用于表达非洲猪瘟的K205R蛋白。
1.2.2 蛋白的诱导表达与可溶性分析 将pET21a-K205R载体转化至大肠杆菌BL21(DE3)感受态细胞。挑取单菌落至LB液体培养基中,37 ℃ 振荡培养至OD600nm值为0.8~1.0,以1∶100(体积比)的比例将培养菌液加至LB液体培养基中,37 ℃振荡培养至OD600nm值为0.4~0.6,加入IPTG,16 ℃、37 ℃分别诱导培养,收集菌体进行SDS-PAGE凝胶电泳,用考马斯亮蓝染色,观察表达结果。
1.2.3 蛋白的纯化 将3 L阳性菌液诱导6 h后,离心收集菌体。加入50 mL的PBS重悬菌体洗涤,离心去上清,重复3次,冰上放置进行超声破碎,将裂解液离心收集上清液,用0.22 μm的滤器去除杂质,将上清加入到预处理好的QIAGEN Ni-NTA beads的操作进行纯化。用20 mmol/L的咪唑洗去杂蛋白,用200 mmol/L的咪唑洗脱目的蛋白。跑胶。
对不纯的蛋白进行阴离子交换柱的纯化,取蛋白的峰,进行蛋白质电泳,保证蛋白的纯度在80%以上。
1.2.4 K205R蛋白的抗原性分析 将纯化后的K205R蛋白进行SDA-PAGE,半干转法将蛋白转印至PVDF膜上,5%脱脂乳封闭1 h;将PVDF膜放入1∶50稀释的非洲猪瘟阳性血清中,4 ℃孵育过夜;TBST洗3次,每次5 min;将膜放入稀释好的HRP-山羊抗猪IgG(1∶5 000);TBST洗5次,每次5 min;DAB显色10 min。
1.2.5 多抗的制备 免疫程序为初次免疫剂量为每只兔子1 mg K205R蛋白,将蛋白与等体积的弗氏完全佐剂充分乳化后,在兔背部皮下分多点注射;2周后加强免疫4次,每次间隔1周,前3次剂量为每只兔子0.5 mg,K205R蛋白改用不完全弗氏佐剂乳化,背部皮下多点注射;末次免疫剂量为每只兔子2 mg,耳缘静脉注射,3 d后采血。于免疫前采集5 mL兔血液分离血清,作为阴性血清对照。
1.2.6 多抗的纯化与保存 采用Protein A亲和层析法纯化多抗,参照试剂说明书进行纯化。将兔抗血清过柱2遍,用TBS彻底洗涤纯化柱,再用甘氨酸洗脱液(pH值2.7)进行洗脱,并用Tris-HCl 缓冲液(pH值8.0)将洗脱液pH值调至7.4 。最后,用TBS过夜透析纯化后的多抗,并用超滤管浓缩后,加入50%甘油和1‰叠氮钠,置-20 ℃保存。
1.2.7 多抗效价的测定 以K205R蛋白作为检测抗原,通过间接ELISA法测定多抗效价。将抗原稀释为浓度为1 μg/mL包被ELISA板,每孔加入100 μL,4 ℃包被过夜;PBST清洗3次;每孔加入100 μL 封闭液(5% BSA,PBST稀释),37 ℃封闭1 h;PBST清洗3次;每孔加入100 μL 不同稀释度的多抗(1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000),37 ℃孵育1 h,同时设同等稀释度的非免疫兔血清为阴性对照;PBST清洗3次;每孔加入100 μL稀释的HRP-山羊抗兔IgG(1∶10 000),37 ℃孵育1 h;PBST清洗4次;每孔加入100 μL TMB底物溶液,室温反应10 min,每孔加入50 μL 2 mol/L的H2SO4终止液终止反应。用酶标仪在450 nm处测定OD值。
2 试验结果
2.1K205R基因的扩增和质粒构建 将K205R基因克隆至原核表达载体pET-21a-c(+)中,成功构建了pET-21a-K205R。对重组质粒进行PCR及测序鉴定,结果显示,重组质粒pET-21a-K205R构建成功。
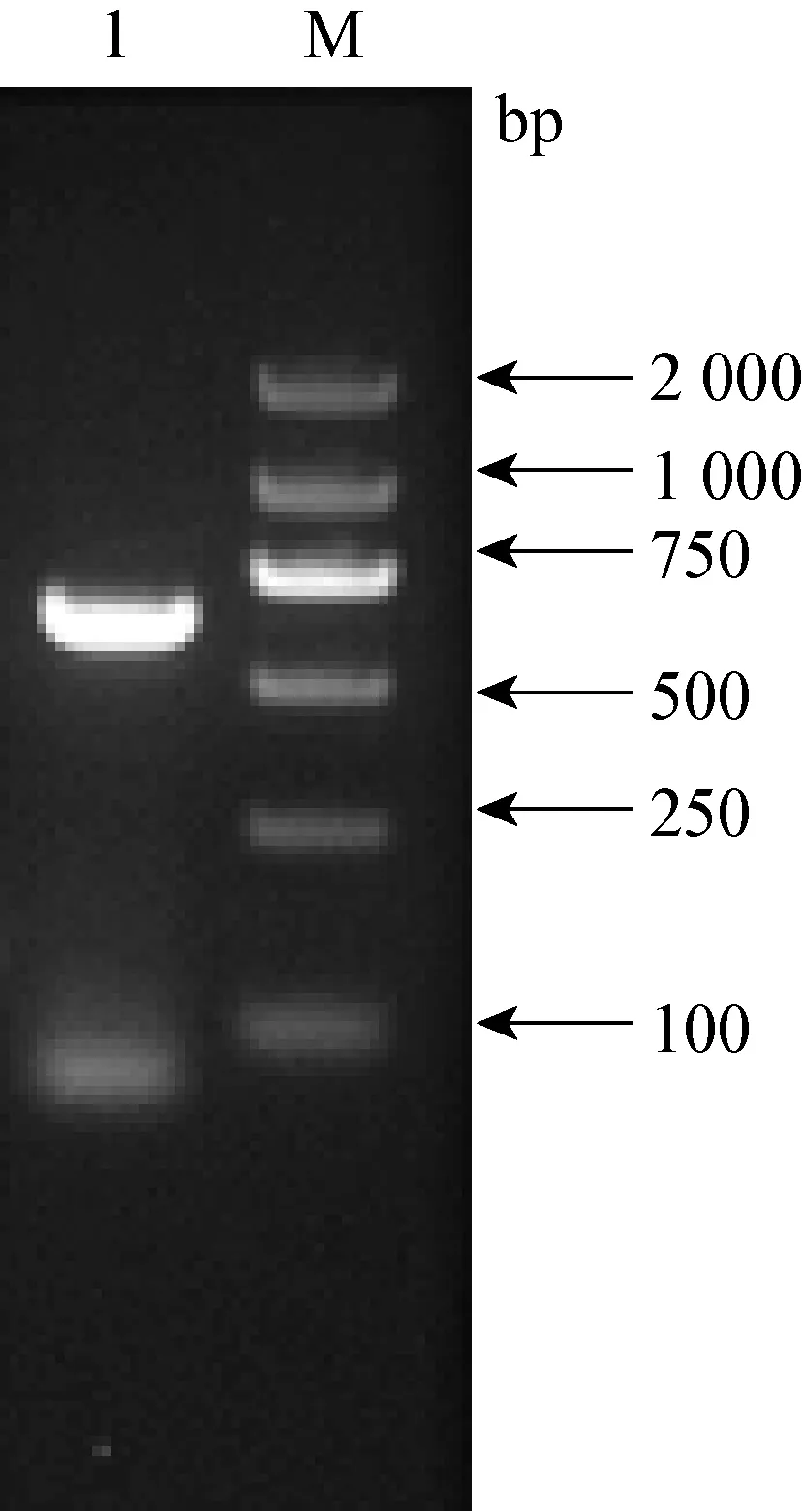
图1 pcr扩增图
2.2 蛋白的诱导表达与可溶性分析 将pET-21a-K205R 重组质粒转化感受态大肠杆菌BL21(DE3)细菌,获得pET-21a-205R-BL21 菌株,pET-21a-K205R-BL21 菌株经诱导表达后,在分子量为31 kDa的附近出现了一条明显的表达蛋白。K205R 蛋白报道分子量约为23.7 kDa,其融合蛋白两端均有6×组氨酸,根据DNA序列推算该融合蛋白分子量为30.3 kDa。结果表明,在37 ℃诱导后培养6 h后,蛋白表达量最高,说明重组质粒pET-21a-K205R在BL21细胞中成功表达。通过对菌体裂解液的上清和沉淀分析发现,K205R蛋白在上清和包涵体中均有表达。图2中表达蛋白泳道偏后,可能与蛋白亲水性有关。
2.3 蛋白的纯化 在非变性条件下,利用Ni-NTA预装柱对菌体裂解产物上清中的重组K205R蛋白进行纯化。收集beads上的洗脱蛋白,经阴离子交换柱纯化,收集蛋白,浓缩至1.5 mg/mL。
2.4 K205R蛋白的抗原性分析 取纯化后的重组K205R蛋白做SDA-PAGE,以ASFV阳性血清作为一抗、猪阴性血清作为对照进行Western Blot检测。结果表明,重组K205R蛋白可以与ASFV阳性血清发生特异性反应,具有良好的抗原性(图5)。

图2 重组K205R蛋白在E.coli BL21(DE3)中诱导表达情况的SDS-PAGE分析
1:未诱导的BL21空菌菌体蛋白全菌; 2:37 ℃诱导6 h的pET-21a-K205R-BL21菌体裂解产物的上清; 3:37 ℃诱导6 h的pET-21a-K205R-BL21菌体裂解产物的沉淀; 4:16 ℃诱导6 h的pET-21a-K205R-BL21菌体裂解产物的上清; 5:16 ℃诱导6 h的pET-21a-K205R-BL21菌体裂解产物的沉淀;M:蛋白质相对分子质量标准

图3 纯化后的K205R蛋白的SDS-PAGE分析及AKTA 阴离子柱纯化图1:纯化后的K205R蛋白; M:蛋白质相对分子质量标准

图4 Western Blot检测K205R蛋白抗原性
2.5 多抗效价测定 以纯化的重组K205R蛋白为包被抗原,利用间接ELISA法测定纯化后的多抗效价,以多抗孔的OD值与阴性对照孔的OD值的(P/N)大于2.1时为多抗的最高稀释度,即为多抗效价。结果表明,纯化后的多抗效价为1∶128 000。

图5 ELISA检测多抗效价
3 讨论
非洲猪瘟(African swine fever,ASF)是一种极为复杂的传染性疾病,病死率高达100%,被OIE列为通报疫病[6]。ASF最早于1909年在非洲发现,目前,大约有49个国家曾流行或正在流行该病,包括亚洲、非洲、欧洲等国家[7-8]。2007年俄罗斯报道发生ASFV疫情,截止到2016年,俄罗斯境内暴发ASF疫情共831起[9]。迄今为止,我国并没有发生ASF,但随着进出口贸易的发展及人员的频繁流动,我国形势严峻,毫无疑问,该病一旦传入,必将对我国的养殖业以及国家经济构成严重威胁。目前并没有有效的疫苗,因此建立准确有效的检测方法势在必行。
目前OIE确诊ASF的方法是以活病毒为抗原对疑似病例进行ELISA检测其是否含有ASFV特异性抗体,并利用免疫印迹法对疑似阳性样品进行确诊。由于该方法对实验室级别要求很高,且对于活病毒的处理也有一定的风险,所以研究一种方便、简洁、安全的检测方法显得尤为重要[10]。有研究表明,在检测欧洲血清中,重组病毒蛋白可以提高检测的灵敏度与特异性[11]。K205R基因是ASFV的保守特异性基因,Gallardo等人利用ASFV的Ba71v毒株感染Vero细胞,发现在病毒感染早期K205R蛋白在整个细胞中呈弥散性表达,但在纯化的病毒中并未发现K205R蛋白,这提示我们K205R蛋白可能有助于区分持续感染的动物和免疫过的动物[5]。重组的K205R蛋白具有很强的免疫原性,能诱导机体产生强烈的免疫应答。
K205R蛋白是可溶性蛋白,方便制备与纯化,且原核表达操作简单,成本低。本研究利用原核表达载体pET-21a构建重组质粒pET-21a-K205R,IPTG 37 ℃诱导6 h获得大量表达重组K205R 蛋白的菌体,通过镍柱及阴离子交换柱纯化蛋白,经ASFV阳性血清检测,重组K205R蛋白抗原性较好。利用重组K205R蛋白为抗原免疫兔子,制备兔多克隆抗体,间接ELISA法结果显示,该抗体效价较高。ASFV重组K205R蛋白及其多克隆抗体的成功制备,为非洲猪瘟ELISA检测方法的建立提供了良好的生物材料。

