甜菊自交胚挽救及其自交S1代的主要性状分析
杨永恒, 侯孟兰, 张永侠, 徐晓洋, 孙玉明, 张 婷, 原海燕
〔江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
甜菊(SteviarebaudianaBertoni)又称甜叶菊,隶属于菊科(Asteraceae)甜菊属(SteviaCav.),为多年生宿根性草本植物,原产于南美洲,因其叶片含有高甜度、低热量的甜菊糖苷而闻名[1]。甜菊为异花授粉植物,具有自交不亲和性,自交结实率低于0.5%[2-3],因此,通过多代自交获得纯合种质的难度较大,阻碍了自交系和纯合体在甜菊遗传育种中的研究和应用。在长期育种实验过程中,作者发现部分甜菊品种自交授粉后可以形成幼胚,但可能因受精后障碍导致幼胚败育无法形成成熟的种子。胚挽救技术为克服受精后障碍的有效方法[4],在新种质创制和新品种培育中得到迅速发展,加快了植物育种进程。该技术已在小麦属(TriticumLinn.)[4-5]、葡萄属(VitisLinn.)[6-7]、柑橘属(CitrusLinn.)[8]、百合属(LiliumLinn.)[9-10]、苜蓿属(MedicagoLinn.)[11]和菊属(ChrysanthemumLinn.)[12-15]等植物的远缘杂交、多倍体育种和自交系育种等研究中有成功报道。
本研究首次尝试利用胚挽救技术进行甜菊自交种质创制,通过对甜菊不同品种自交授粉后早期有胚率进行统计,筛选适合胚挽救的甜菊品种,并对胚挽救的取材时期和培养基等进行研究,以期建立甜菊胚挽救的技术体系,并为甜菊纯合种质创制、新品种培育及育种进程加快奠定理论基础。
1 材料和方法
1.1 材料
供试6个甜菊品种中,‘中山5号’(‘Zhongshan No. 5’)、‘中山6号’(‘Zhongshan No. 6’)和‘中山8号’(‘Zhongshan No. 8’)为作者所在课题组自主选育,‘江甜2号’(‘Jiangtian No. 2’) 引种自中国江苏东台,‘谱星1号’(‘PC Star No. 1’)引种自中国江西赣州,‘守田3号’(‘Morita No. 3’) 引种自日本。所有品种活植物保存于江苏省中国科学院植物研究所甜菊种质资源圃,于2017年4月扦插繁殖,生根后移栽到花盆(上口径20.0 cm、底径14.5 cm、高20.0 cm)中,每盆1株,每品种10盆,置于日光温室并进行常规养护。
1.2 方法
1.2.1 自交亲本选择 于2017年8月至10月(甜菊花期)在日光温室进行6个甜菊品种的自交实验,选取健壮且花蕾多的枝条,用硫酸纸袋套袋隔离,开花后取同株花粉授于成熟柱头上,授粉后立即套袋并挂牌标记授粉日期,每隔1 d授粉1次。每个品种授粉约500个头状花序。分别随机取各品种自交授粉后5、10、15和20 d的头状花序各20个,用镊子取出全部子房,并用解剖针剥出幼胚,统计幼胚数。实验重复3次。根据公式“有胚率=(幼胚数/调查子房总数)×100%”计算有胚率。筛选有胚率高的品种作为自交亲本,以获得足量幼胚进行后续胚挽救体系建立和S1代性状分析实验。
1.2.2 胚挽救方法 分别采集甜菊品种‘中山8号’自交授粉后1、3、5、7和9 d的花,保湿并暂时保存于4 ℃冰箱。接种前将花用流水冲洗30 min,用体积分数75%乙醇浸润30 s后转移到超净工作台中,用质量体积分数0.1%HgCl2溶液浸泡4~5 min,无菌水漂洗3次,置于无菌滤纸上吸干表面水分,用解剖针从子房中剥出胚珠或幼胚,分别接种于MS培养基、愈伤诱导培养基(添加2.0 mg·mL-16-BA和2.0 mg·mL-1NAA的MS培养基)和分化诱导培养基(添加2.0 mg·mL-16-BA和0.2 mg·mL-1NAA的MS培养基)上,3种培养基均含40 g·L-1蔗糖和6 g·L-1琼脂,pH 5.8。将授粉后不同天数的胚珠或幼胚分别接种于3种培养基上,各3皿,每皿60枚。接种后置于温度25 ℃、光照时间16 h·d-1、光照度1 500~2 000 lx的人工气候箱内培养,观察并统计其萌发情况。
1.2.3 自交S1代幼苗管理和主要性状分析方法
1.2.3.1 幼苗管理 胚挽救培养2周后,待幼苗长至2对真叶时从培养基中取出,用无菌水洗净根部,移栽到育苗钵(上口径10.0 cm、底径6.5 cm、高8.0 cm)中,栽培基质为混合均匀的营养土和泥炭(体积比1∶1),株间距1.0~1.5 cm,覆盖保鲜膜保湿,置于温度25 ℃、光照时间16 h·d-1、光照度1 500~2 000 lx的人工气候箱内,培养1周后揭去保鲜膜,继续培养2周后移栽到小花盆(上口径7.0 cm、底径3.5 cm、高8.0 cm)中,栽培基质同上,每盆1株,培养2个月后,待植株长至8~10对真叶时进行短日照(光照时间10 h·d-1)处理,其他培养条件不变。
1.2.3.2 现蕾期统计 短日照处理后每天观察植株,统计植株的现蕾期,即从短日照处理开始至现蕾的天数。
1.2.3.3 甜菊糖苷含量测定 分别收集各现蕾植株地上部分的全部叶片,105 ℃杀青15 min后,70 ℃烘干至恒质量。用研钵将干叶研成细粉,准确称取0.200 0 g粉末,置于离心管中,加入10 mL蒸馏水,于沸水浴中提取2 h,然后于室温、4 000 r·min-1离心10 min,吸取上清液,使用孔径0.22 μm滤膜过滤后,按照GB 8270—2014中HPLC法测定和计算各样品的甜菊糖苷含量,采用LC-100高效液相色谱仪(上海伍丰科学仪器有限公司)和Sapphire C18反相色谱柱(苏州赛分科技有限公司,250 mm×4.6 mm,5 μm),流动相为V(乙腈)∶V(磷酸钠缓冲液)=32∶68;流速1.0 mL·min-1,检测波长210 nm,进样量20 μL,柱温40 ℃。实验重复3次。
1.3 数据统计分析
采用EXCEL 2010 和SPSS 19.0统计分析软件对实验数据进行处理和分析,采用Duncan’s新复极差法进行相关数据的差异显著性检验。
2 结果和分析
2.1 自交授粉后甜菊不同品种的有胚率分析
自交授粉后不同天数甜菊各品种的有胚率见表1。结果显示:自交授粉后5 d,甜菊不同品种间有胚率的差异明显,其中,‘中山8号’的有胚率最高,为16.0%;其次为‘中山5号’,有胚率为12.1%;‘江甜2号’、‘谱星1号’和‘守田3号’的有胚率较低,分别为8.0%、6.0%和2.8%。自交授粉后10 d,‘中山8号’和‘中山5号’的有胚率均较授粉后5 d明显降低,分别为2.0%和1.0%;其他品种的有胚率均为0.0%;自交授粉后15和20 d,甜菊6个品种的有胚率均为0.0%。
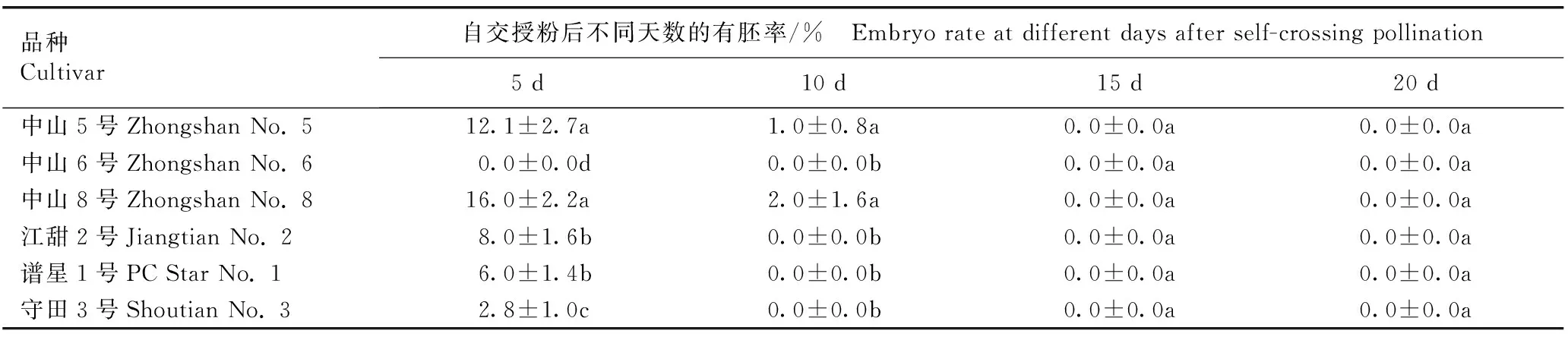
品种Cultivar自交授粉后不同天数的有胚率/% Embryo rate at different days after self-crossing pollination5 d10 d15 d20 d中山5号Zhongshan No. 512.1±2.7a1.0±0.8a0.0±0.0a0.0±0.0a中山6号Zhongshan No. 60.0±0.0d0.0±0.0b0.0±0.0a0.0±0.0a中山8号Zhongshan No. 816.0±2.2a2.0±1.6a0.0±0.0a0.0±0.0a江甜2号Jiangtian No. 28.0±1.6b0.0±0.0b0.0±0.0a0.0±0.0a谱星1号PC Star No. 16.0±1.4b0.0±0.0b0.0±0.0a0.0±0.0a守田3号Shoutian No. 32.8±1.0c0.0±0.0b0.0±0.0a0.0±0.0a
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference.
2.2 自交授粉后甜菊品种‘中山8号’胚珠和幼胚在不同培养基上的萌发率分析
自交授粉后不同天数甜菊品种‘中山8号’胚珠和幼胚在3种培养基上的萌发时间见表2。结果显示:随自交授粉后天数的增加,‘中山8号’胚珠和幼胚在3种培养基上的萌发时间越来越短。自交授粉后1 d的胚珠在MS培养基、愈伤诱导培养基和分化诱导培养基上均不萌发;自交授粉后3 d的胚珠在MS培养基、愈伤诱导培养基和分化诱导培养基上的萌发时间分别为9.4、8.9和9.2 d,三者间差异不显著;自交授粉后5 d的幼胚在上述3种培养基上的萌发时间分别为4.8、4.8和5.4 d,三者间差异不显著;自交授粉后7 d的幼胚在上述3种培养基上的萌发时间分别为3.5、4.0和3.9 d,三者间差异不显著;自交授粉后9 d的幼胚在上述3种培养基上的萌发时间分别为3.7、2.9和3.5 d,幼胚在愈伤诱导培养基上的萌发时间较短,与其他2种培养基间差异显著。
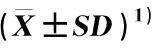

培养基Medium自交授粉后不同天数胚珠的萌发时间/dGermination time of ovule at different days after self-crossing pollination自交授粉后不同天数幼胚的萌发时间/dGermination time of embryo at different days after self-crossing pollination1 d3 d5 d7 d9 dMS培养基MS medium—9.4±1.0a4.8±0.2ab3.5±0.5ab3.7±0.4a愈伤诱导培养基Callus induction medium—8.9±0.9a4.8±0.5ab4.0±0.1a2.9±0.1b分化诱导培养基Differentiation induction medium—9.2±1.0a5.4±0.4a3.9±0.1a3.5±0.5a
1)—: 未萌发No germination. 同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference.
自交授粉后不同天数甜菊品种‘中山8号’胚珠和幼胚在3种培养基上的萌发率见表3。结果显示:随自交授粉后天数的增加,‘中山8号’胚珠和幼胚在MS培养基、愈伤诱导培养基和分化诱导培养基上的萌发率均呈逐渐升高的变化趋势。自交授粉后1 d的胚珠在MS培养基、愈伤诱导培养基和分化诱导培养基上的萌发率均为0.0%;自交授粉后3 d的胚珠在MS培养基、愈伤诱导培养基和分化诱导培养基上的萌发率分别为32.8%、38.4%和20.5%,三者间存在显著差异;自交授粉后5 d的幼胚在MS培养基、愈伤诱导培养基和分化诱导培养基上的萌发率分别为55.6%、50.3%和45.1%,三者间存在显著差异;自交授粉后7 d的幼胚在MS培养基、愈伤诱导培养基和分化诱导培养基上的萌发率较自交授粉后5 d明显升高,分别为83.3%、79.6%和66.3%,且在MS培养基和愈伤诱导培养基上的萌发率均显著高于在分化诱导培养基上的萌发率;自交授粉后9 d的幼胚在MS培养基和愈伤诱导培养基上的萌发率均大于80%,显著高于在分化诱导培养基上的萌发率(76.8%)。
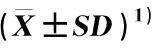
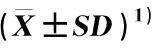

培养基Medium自交授粉后不同天数胚珠的萌发率/%Germination rate of ovule at different days after self-crossing pollination自交授粉后不同天数幼胚的萌发率/%Germination rate of embryo at different days after self-crossing pollination1 d3 d5 d7 d9 dMS培养基MS medium0.0±0.0a32.8±3.1b55.6±1.7a83.3±2.2a80.4±4.5a愈伤诱导培养基Callus induction medium0.0±0.0a38.4±4.2a50.3±2.6b79.6±3.0a81.2±3.2a分化诱导培养基Differentiation induction medium0.0±0.0a20.5±2.3c45.1±1.2c66.3±2.7b76.8±2.5b
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference.
2.3 甜菊自交S1代植株主要性状比较
2.3.1 现蕾期分析 短日照处理胚挽救获得的甜菊品种‘中山8号’103株自交S1代植株现蕾期的统计结果(图1)表明:‘中山8号’自交S1代植株间现蕾期的差异较大。其中,3.9%的植株现蕾较早,短日照处理10 d即现蕾;最晚的1株在短日照处理46 d现蕾。短日照处理15 d现蕾的植株最多,占植株总数的16.5%。
2.3.2 甜菊糖苷含量分析 甜菊品种‘中山8号’及其103个自交S1代植株现蕾期叶片中甜菊糖苷含量的比较结果见表4。结果表明:在现蕾期,103个自交S1代植株叶片中莱鲍迪苷A(RA)、甜菊苷(ST)、莱鲍迪苷C(RC)、杜尔可苷A(DA)和总甜菊糖苷(TSG)含量分别为0.26%~11.43%、0.36%~6.45%、1.52%~9.18%、0.05%~1.40%和5.80%~16.90%,变化范围较大;各甜菊糖苷含量占TSG含量的比例变化范围也较大,其中,RA、ST、RC和DA含量占TSG含量的比例分别为3.19%~72.06%、3.20%~46.98%、12.59%~74.27%和0.53%~12.33%。在‘中山8号’及其103个自交S1代植株中,‘中山8号’和9个植株均为高RA型(RA含量占TSG含量的比例大于60.00%),编号分别为ZS8-8、ZS8-40、ZS8-53、ZS8-59、ZS8-64、ZS8-66、ZS8-84、ZS8-99和ZS8-102;7个植株为高RA-RC型(RA和RC含量占TSG含量的比例均大于40.00%),编号分别为ZS8-9、ZS8-12、ZS8-13、ZS8-38、ZS8-65、ZS8-78和ZS8-89;11个植株为高RC型(RC含量占TSG含量的比例大于60.00%),编号分别为ZS8-4、ZS8-15、ZS8-24、ZS8-25、ZS8-44、ZS8-46、ZS8-57、ZS8-63、ZS8-69、ZS8-74和ZS8-82;编号为ZS8-30的自交S1代植株为高RA-RC-DA型,其RA、RC和DA的含量占TSG含量的比例分别为35.68%、38.26%和12.33%。
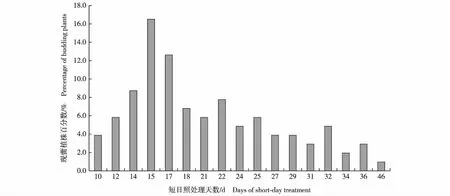
图1 短日照处理下甜菊品种‘中山8号’自交S1代植株现蕾期的比较Fig. 1 Comparison on budding stage of self-crossing S1 progeny plant of cultivar ‘Zhongshan No. 8’ of Stevia rebaudiana Bertoni under short-day treatment
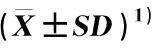
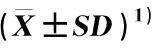

品种(编号)Cultivar(No.)各甜菊糖苷的含量/%Content of each steviol glycoside各甜菊糖苷含量占总甜菊糖苷含量的比例/%Percentage of each steviol glycoside content to total steviol glycoside contentRASTRCDATSGRASTRCDAZS810.57±0.381.59±0.093.90±0.210.24±0.0116.30±0.6964.85±0.429.75±0.1523.91±0.291.49±0.02ZS8-17.36±0.271.76±0.055.43±0.190.23±0.0114.77±0.4249.82±0.2311.89±0.1036.76±0.201.52±0.02ZS8-25.30±0.091.47±0.046.08±0.120.42±0.0213.27±0.3139.92±0.1811.05±0.0945.83±0.103.19±0.10ZS8-36.56±0.231.58±0.053.03±0.030.42±0.0111.58±0.2756.66±0.1713.61±0.1226.12±0.113.60±0.03ZS8-41.62±0.020.78±0.037.38±0.120.97±0.0110.76±0.2115.09±0.127.29±0.1068.60±0.219.01±0.03ZS8-50.74±0.011.61±0.053.70±0.070.65±0.026.70±0.1011.06±0.0824.05±0.2355.26±0.309.64±0.16ZS8-61.60±0.026.35±0.126.34±0.051.40±0.0315.69±0.2510.20±0.2240.48±0.3140.41±0.278.91±0.06ZS8-73.88±0.011.04±0.014.92±0.030.48±0.0110.31±0.1037.60±0.1810.06±0.0947.67±0.254.67±0.07ZS8-89.38±0.031.27±0.023.30±0.120.60±0.0114.55±0.0864.45±1.028.75±0.1222.66±0.124.15±0.02ZS8-95.82±0.022.14±0.025.91±0.070.08±0.0113.95±0.1241.74±0.0515.35±0.0742.33±0.140.57±0.09ZS8-105.61±0.013.01±0.054.47±0.020.60±0.0213.70±0.1040.95±0.1321.99±0.2232.65±0.074.41±0.08ZS8-117.68±0.101.96±0.035.14±0.050.23±0.0115.00±0.2351.18±0.1613.06±0.0534.25±0.091.50±0.10ZS8-125.84±0.031.61±0.015.25±0.020.21±0.0112.90±0.1445.24±0.0912.47±0.1240.68±0.201.62±0.05ZS8-136.20±0.051.53±0.026.12±0.110.21±0.0314.07±0.3244.07±0.1210.90±0.0643.50±0.341.53±0.06ZS8-142.57±0.021.76±0.034.66±0.050.05±0.019.03±0.0928.45±0.0919.45±0.1251.53±0.210.58±0.05ZS8-151.81±0.011.27±0.026.70±0.010.22±0.0210.01±0.0818.11±0.0612.72±0.0566.98±0.112.18±0.07ZS8-164.64±0.031.32±0.023.76±0.090.05±0.029.77±0.1247.45±0.2313.54±0.1538.48±0.110.53±0.05ZS8-178.33±0.051.72±0.015.77±0.060.27±0.0216.09±0.1451.78±0.3710.71±0.1035.84±0.211.67±0.12ZS8-187.46±0.122.66±0.044.50±0.100.23±0.0314.85±0.0950.24±0.4517.90±0.1230.30±0.231.55±0.07ZS8-192.86±0.151.58±0.013.81±0.070.76±0.059.00±0.1331.77±0.2517.51±0.1742.26±0.328.46±0.15ZS8-208.62±0.252.23±0.133.94±0.120.20±0.0914.99±0.2657.49±0.3414.90±0.1526.26±0.101.36±0.07ZS8-218.61±0.162.33±0.024.34±0.200.68±0.0315.97±0.2553.95±0.3314.60±0.1727.19±0.124.26±0.10ZS8-227.80±0.102.23±0.035.14±0.170.49±0.0515.67±0.1249.79±0.2314.25±0.1532.82±0.203.14±0.09ZS8-235.26±0.081.42±0.023.97±0.070.73±0.0511.38±0.1046.27±0.1812.45±0.0734.87±0.136.41±0.20ZS8-241.98±0.050.36±0.045.21±0.120.20±0.087.75±0.1225.59±0.054.60±0.1067.25±0.272.56±0.15ZS8-251.41±0.030.54±0.025.28±0.080.63±0.027.85±0.1017.91±0.056.86±0.0367.27±0.127.97±0.08ZS8-264.57±0.071.82±0.012.85±0.010.93±0.0110.16±0.5044.96±0.0517.89±0.1228.03±0.129.12±0.10ZS8-273.71±0.054.15±0.077.38±0.130.84±0.0216.08±0.1623.08±0.1625.79±0.2045.91±0.335.22±0.10ZS8-283.96±0.033.48±0.122.18±0.080.82±0.0510.45±0.1337.94±0.2333.31±0.3420.87±0.147.88±0.10ZS8-295.51±0.122.14±0.145.08±0.230.39±0.0713.13±0.4541.96±0.2416.32±0.3038.72±0.453.00±0.09ZS8-303.61±0.041.39±0.023.88±0.031.25±0.0110.13±0.0535.68±0.1213.73±0.1038.26±0.1312.33±0.08ZS8-318.34±0.080.45±0.015.17±0.040.12±0.0214.08±0.0659.21±0.113.20±0.0836.71±0.100.87±0.06ZS8-322.14±0.050.49±0.033.21±0.030.49±0.036.34±0.1033.83±0.017.69±0.0150.69±0.017.79±0.01ZS8-337.82±0.122.75±0.053.70±0.030.20±0.0214.47±0.1254.05±0.3719.00±0.1525.54±0.031.41±0.02ZS8-343.57±0.042.87±0.023.89±0.040.16±0.0110.48±0.0934.03±0.2227.40±0.1137.08±0.031.49±0.02ZS8-352.86±0.022.80±0.012.44±0.020.52±0.028.62±0.0433.15±0.0332.44±0.0128.33±0.046.08±0.05ZS8-365.16±0.123.15±0.036.60±0.080.40±0.0615.30±0.1433.69±0.2320.57±0.0743.12±0.122.61±0.07ZS8-373.13±0.071.98±0.012.32±0.030.06±0.017.49±0.0541.81±0.1426.49±0.0430.93±0.070.77±0.01ZS8-386.75±0.050.99±0.015.34±0.040.20±0.0213.28±0.1250.86±0.127.43±0.0540.18±0.111.52±0.03ZS8-395.18±0.084.27±0.022.72±0.020.17±0.0312.35±0.2141.97±0.2534.59±0.0622.05±0.051.39±0.10ZS8-409.62±0.100.89±0.044.09±0.100.24±0.0114.84±0.2364.82±0.355.97±0.1327.57±0.271.64±0.08ZS8-410.65±0.016.45±0.086.37±0.070.63±0.0214.10±0.184.58±0.0945.71±0.1445.21±0.174.49±0.10ZS8-429.59±0.041.54±0.064.41±0.020.65±0.0216.20±0.2059.21±0.129.53±0.0827.25±0.104.01±0.08ZS8-435.75±0.042.02±0.018.05±0.050.73±0.0316.56±0.1034.74±0.1012.23±0.0648.61±0.094.41±0.05ZS8-441.29±0.021.27±0.014.62±0.010.22±0.017.40±0.0817.42±0.0317.21±0.0162.39±0.122.99±0.03ZS8-453.72±0.011.27±0.017.53±0.080.78±0.0513.30±0.1427.99±0.039.57±0.0156.59±0.125.84±0.10ZS8-464.16±0.051.27±0.029.18±0.120.36±0.0314.97±0.2027.80±0.108.51±0.0661.32±0.232.38±0.01ZS8-474.04±0.032.69±0.037.50±0.050.50±0.0114.74±0.1527.44±0.0918.28±0.1050.91±0.213.37±0.01ZS8-488.86±0.121.43±0.013.59±0.071.00±0.0114.88±0.1659.59±0.369.58±0.0424.13±0.136.70±0.03ZS8-496.72±0.092.34±0.025.30±0.020.55±0.0114.90±0.1145.08±0.2715.71±0.0835.55±0.063.66±0.02
1)ZS8: ‘中山8号’‘Zhongshan No. 8’; ZS8-1-ZS8-103: ‘中山8号’自交S1代植株 Self-crossing S1progeny plants of ‘Zhongshan No. 8’. RA: 莱鲍迪苷A Rebaudioside A; ST: 甜菊苷 Stevioside; RC: 莱鲍迪苷C Rebaudioside C; DA: 杜尔可苷A Dulcoside A; TSG: 总甜菊糖苷 Total steviol glycosides.
3 讨论和结论
3.1 甜菊的自交不亲和特性
作者在长期的甜菊育种研究中观察发现:部分自交结实率为0.0%的甜菊品种在自花授粉后可以形成幼胚,但在随后的发育过程中不同程度地败育。本研究甜菊6个品种自交授粉后不同天数的有胚率差异显著,其中,自交授粉后5 d甜菊品种‘中山8号’的有胚率高达16.0%,自交授粉后10 d降至2.0%,由此可见,甜菊的自交不亲和性除了受精前障碍外还存在受精后障碍。
3.2 甜菊的胚挽救方法
植物育种中通过离体培养进行胚挽救,使可能败育或退化的胚经过适宜的离体培养获得再生植株[16]。由于不同植物胚的自身条件各不相同,而且影响胚生长发育的因子十分复杂,不同植物胚挽救体系存在较大差别。影响胚挽救的主要因子包括基因型、胚的发育时期、培养基、激素以及培养条件[16-17]。本研究中,自交授粉后5 d,‘中山8号’和‘中山5号’的有胚率较高,分别为16.0%和12.1%,自交授粉后10 d,二者的有胚率分别仅2.0%和1.0%;自交授粉后5 d,‘江甜2号’、‘谱星1号’和‘守田3号’的有胚率分别为8.0%、6.0%和2.8%,自交授粉后10 d,三者的有胚率均降为0.0%;而‘中山6号’自交有胚率始终为0.0%。说明基因型是胚挽救技术在甜菊自交育种应用中的主要限制因子。
一般认为胚的发育时期是影响胚培养成功的关键因子之一,因此,确定最佳的胚离体培养时期对胚挽救至关重要。朱际君等[18]认为,胚龄越小,越难培养成功,原因为取材过早,合子胚完全为异养,离体培养所需的营养及条件要求复杂,很难培养成功;但取材过晚,又由于母体内不协调性的激化而导致胚生活力降低。胚由异养转为自养是胚发育的关键时期,通常心形胚发育中期之前是异养,心形胚晚期转为自养。甜菊传粉后约6 h雌性和雄性核融合,传粉后约8 h初生胚乳核分裂,传粉后约10 h合子第1次分裂;心形胚阶段,胚乳细胞呈现被消化吸收的迹象,胚发育早期其营养物质主要来自珠被绒毡层,心形胚以后,其营养物质主要依赖于胚乳细胞的解体[19]。本研究对‘中山8号’自交授粉后1和3 d的胚珠以及自交授粉后5、7和9 d的幼胚进行了培养,结果随自交授粉后天数的增加,胚珠和幼胚的萌发时间逐渐缩短,萌发率逐渐升高,其中授粉后1~3 d的胚珠培养难度较大可能是因为此时甜菊胚异养程度较高,离体培养难以满足所需营养和条件;而授粉后10 d,幼胚发生不同程度的败育,因此,自交授粉后7~9 d取材较为适宜。
适宜的培养基和激素是离体培养中促成胚发育成熟的关键环节之一。本研究中,自交授粉后7~9 d‘中山8号’幼胚在MS培养基和愈伤诱导培养基(添加2.0 mg·mL-16-BA和2.0 mg·mL-1NAA的MS培养基)中幼胚的萌发率均较高,可能是因为所取幼胚处于发育后期,自养程度较高,在营养需求上较独立,对外源营养要求简单。由于MS培养基上的幼胚萌发类似种子萌发,幼苗健壮移栽易成活;而在愈伤诱导培养基和分化诱导培养基(添加2.0 mg·mL-16-BA和0.2 mg·mL-1NAA的MS培养基)上幼胚容易被诱导形成愈伤组织,需要进一步诱导再生,增加了胚挽救的工作量和难度,因此,MS培养基适宜于授粉后7~9 d甜菊幼胚的培养,而对于自交授粉后1~3 d的胚珠和自交授粉后5 d的幼胚可能还需调整培养基和激素以满足其发育所需营养和条件。
3.3 甜菊胚挽救自交S1代植株的性状分离
甜菊干叶为甜菊糖苷的提取原料,甜菊糖苷含量是其主要考察性状。甜菊叶片中甜菊糖苷含量随甜菊的生长发育波动,现蕾期其甜菊糖苷含量最高[20-22],因此,现蕾期是甜菊的最佳收获期,也是重要的农艺性状之一。本研究中,短日照处理下‘中山8号’自交S1代植株间现蕾期的差异较大,最早和最晚的现蕾期相差36 d;‘中山8号’103个自交S1代植株现蕾期叶片中莱鲍迪苷A、甜菊苷、莱鲍迪苷C、杜尔可苷A和总甜菊糖苷的含量及各甜菊糖苷含量占总甜菊糖苷含量比例的变化范围均较大,说明‘中山8号’自交S1代发生了明显的性状分离。
3.4 甜菊自交胚挽救的重要意义
由于甜菊具有自交不亲和性,异花授粉会导致其有性繁殖个体遗传基础差异大,杂合度高,不利于遗传分析,因此,亟需建立甜菊自交群体。胚挽救技术可克服甜菊自交不亲和受精后障碍,提高了获得甜菊自交后代的效率。本研究通过胚挽救成功获得‘中山8号’103个S1代植株,克服了自交不亲和受精后障碍,提高了获得自交后代的效率,因此,建议采取本方法进行多代自交,最终建立自交系,以期为探索甜菊的基因分离、连锁以及遗传多样性等提供实验材料。

