芦荟大黄素抑制人胃癌BGC- 823细胞增殖及对Wnt通路的影响
王 毅,饶尚锐,孙 伟,王中林,黄 节,潘忠良
(温州市中心医院,浙江 温州 325000)
芦荟大黄素(Aloe- emodin)是羟基蒽醌衍生物,具有一定的抗肿瘤活性,对于胃癌的研究显示芦荟大黄素通过阻滞胃癌细胞周期而影响其增殖[1]。β- catenin、TCF因子均为Wnt途径的主要因子在细胞增殖中具有重要作用[2- 3]。芦荟大黄素具有胃癌的抗肿瘤活性但其分子机制尚未完全清晰,本研究通过芦荟大黄素作用于人胃癌BGC- 823细胞,探讨其可能的分子机制。
一、材料与方法
1.实验材料。人胃癌BGC- 823细胞系(上海中国科学院细胞库),芦荟大黄素、MTT试剂盒、二抗:羊抗兔IgG,Trizol,BSA牛血清白蛋白,一抗:β- Catenin、TCF7L2,PVDF膜,ECL增强化学发光检测试剂盒。
2.方法。(1)MTT法检测芦荟大黄素对BGC- 823细胞增殖的影响。选用处于对数期的BGC- 823细胞接种到96孔板中,7×103/孔,培养24h后,加入不同浓度的芦荟大黄素(15μM、30μM、45μM、60μM、90μM)的RPMI- 1640培养液,每组设3个复孔。对照组加入无药RPMI- 1640培养液,分别培养12h、24h、48h后,加入100μL RPMI- 1640培养液+25μL MTT溶液,继续培养4h后每孔加入DMSO 150μL,摇床震荡10min,酶标仪490nm检测吸光度值。抑制率=(1- 实验组值/对照组值)×100%,重复3次。(2)平板细胞克隆形成实验。取对数生长期的各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,把细胞悬浮在10%胎牛血清的DMEM培养液中备用。将细胞稀释接种于含10mL 37℃预温培养液中继续培养2- 3周,当培养皿中出现肉眼可见的克隆时,终止培养。细胞经PBS浸洗后,4%多聚甲醛固定,GIMSA染色液染后清洗干燥,在低倍镜计数大于10个细胞的克隆数。克隆形成率=(克隆数/接种细胞数)×100%。(3)RT- PCR及western blot检测β- catenin、TCF因子表达。取各组对数期细胞,培养24h后,提取细胞总RNA,经逆转录试剂盒合成cDNA后进行聚合酶链反应,扩增条件为:94℃4分钟;94℃ 20秒,60℃30秒,72℃30秒,循环35次;采用2- △△α法进行结果比较,以β- actin作为内参,应用Primer 3.0 设计PCR引物;提取总蛋白,Bradford法测定蛋白浓度,进行Western Blot实验。
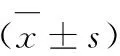
二、结 果
1.芦荟大黄素对人胃癌BGC- 823细胞增殖的影响。随着芦荟大黄素浓度的提高以及作用时间的延长,人胃癌BGC- 823细胞增殖抑制率显著增加(P<0.05)(见表1)。
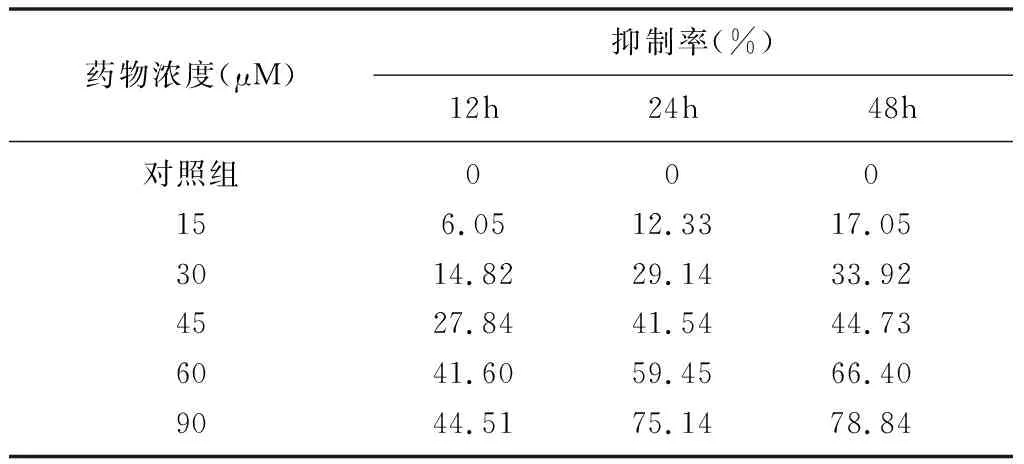
表1 芦荟大黄素对人胃癌BGC- 823细胞 增殖的抑制比较
2.芦荟大黄素对人胃癌BGC- 823细胞生长的影响。随着芦荟大黄素浓度越高,在平板上形成的克隆数量越少(见表2),呈剂量依赖性。
3.芦荟大黄素对人胃癌BGC- 823细胞中β- catenin和TCF7L2 基因表达的影响。随着芦荟大黄素浓度越高,β- catenin和TCF7L2 基因及蛋白表达下调,呈现浓度依赖性(P<0.05)(见附图)。

表2 芦荟大黄素对人胃癌BGC- 823细胞增殖影响

附图 芦荟大黄素对人胃癌BGC- 823细胞基因表达的影响
三、讨 论
芦荟大黄素抑制胃癌细胞株生长的机制已有文献报道,芦荟大黄素可在G0/G1期阻滞人胃癌细胞HGC- 27的增殖[4],使S期细胞比率降低;在一定范围内,芦荟大黄素的浓度越高、作用时间越长,对肿瘤细胞生长的抑制作用越强,凋亡率也越高[5]。芦荟大黄素以剂量依赖方法抑制胃癌细胞的生长;芦荟大黄素引起细胞阻滞在G2 /M 期;其分子机制为引起CDK2和cyclin A的表达水平下降、CDK1和cy clin B1的表达水平上升。
本研究结果显示芦荟大黄素能够抑制人胃癌BGC- 823细胞增殖,平板克隆形成实验证明芦荟大黄素抑制人胃癌BGC- 823细胞增殖。且呈剂量依赖性。此外芦荟大黄素可降低人胃癌BGC- 823细胞中β- catenin和TCF7L2的基因表达,可能抑制Wnt通路,提示芦荟大黄素可能通过抑制Wnt通路来抑制人胃癌细胞的生长。这为进一步阐明芦荟大黄素抑制胃癌细胞株生长的机制提供了新的线索。

