复合酶酶解蜈蚣粉工艺优化
王彦多,桑 晓,方 园,刘 颖,曹广超,毛会秀,刘金虎,王集会
(1. 山东中医药大学药学院,山东 济南 250355;2. 山东中医药大学实验中心,山东 济南 250355)
蜈蚣入药首载于《神农本草经》,味辛,性温,有毒,归肝经[1]。蜈蚣于《本草纲目》中记载具有祛风止痉,通络止痛,攻毒散结的功效[2]。现阶段研究发现蜈蚣的毒性主要集中于其牙部[3]。蜈蚣虽具有一定毒性,但其具有较强的通络散结攻毒之效。因此,近现代以来,许多国医大师都善用蜈蚣治疗恶性肿瘤[4],认为其独特的“以毒攻毒”疗效具有不可替代的作用。
现阶段蜈蚣抗肿瘤效果成为其药理作用的研究热点,研究发现,蜈蚣具有抑制肿瘤细胞增殖、增强机体免疫力等作用[5]。其主要通过破坏癌细胞细胞膜使其破裂的方式杀死癌细胞[6]。现阶段对蜈蚣的研究主要集中于蜈蚣全虫,而对蜈蚣生物转化后的产物活性研究则鲜有文献报道。刘春雨等[7]探讨了不同酶解产物对乳腺癌MCF-7细胞的增殖抑制效果,结果显示半仿生酶解方法可提高蜈蚣抗肿瘤效果。因此,本实验在已筛选出有效用酶的基础上进行复合酶酶解工艺的优化,探究各因素对蜈蚣粉酶解的影响,并期望通过工艺优化达到提高蜈蚣粉酶解产物对乳腺癌MCF-7细胞抑制率的效果。
1 仪器与材料
1.1 仪器
FA1004N型电子分析天平(上海精密仪器公司);HWLC型电热恒温水温箱(北京医疗设备厂);PHS-25型pH计(上海仪电科学仪器公司);KDN-2C定氮仪配四孔消化炉(上海纤检仪器公司);UV9100B可见分光光度计(北京莱伯泰科仪器公司);EL340i型全自动酶标仪(Molecular Davices);TS100型倒置显微镜(日本尼康)。
1.2 材料
蜈蚣冻干粉自制(批号:20160703);胰蛋白酶(5×104U/g,国药集团);胰凝乳蛋白酶(上海源叶,批号:G2207Y23138);弹性蛋白酶(3×104U/g,上海源叶,批号:Y30M8T32945);RPMI-1640培养基,胎牛血清(赛默飞世尔);胰凝乳蛋白酶(106U/g,上海碧云天);注射用顺铂(齐鲁制药,纯度:20 mg/支);MTT(武汉盖云天)。
1.3 细胞株
乳腺癌MCF-7细胞株由山东省立医院提供。
2 方法
2.1 正交试验水平设计
根据刘春雨等[7]前期单因素筛选试验并参考焦方文等[8]方法,确定以酶解温度、酶解时间、pH值及单个酶酶活力为考察因素,按L16(44)正交表进行正交试验。取蜈蚣粉1.0000 g,以对蜈蚣粉复合酶酶解液对乳腺癌MCF-7细胞的增殖抑制率为指标,进行4因素4水平的正交试验。因素水平设计见表1。

表1 蜈蚣粉酶解工艺正交试验设计
2.2 蜈蚣粉酶解方法
精密称取蜈蚣粉3份,每份1.0000 g,分别置入100 ml具塞锥形瓶,按料液比1:40加入蒸馏水。超声提取30 min,然后按各正交试验条件进行酶解,复合酶比例为胰蛋白酶:弹性蛋白酶:胰凝乳蛋白酶=1:1:1。酶解结束后,以3000 r/min 转速离心,取复合酶酶酶解上清,冷冻干燥。
2.3 乳腺癌MCF-7细胞的培养
2.3.1 细胞复苏 从液氮罐中取出冻存的MCF-7细胞,置于37 ℃ 水浴锅中使其融化。取出细胞,1000 r/min离心。离心后向离心管中加入1640 培养基,吹打使其混匀,转移至培养瓶中,加入适量1640培养基,24 h后换液[9]。
2.3.2 细胞传代 待细胞增殖至80 %~90 % 时,进行细胞传代。首先用0.01 mol/L pH 7.4的PBS缓冲溶液清洗3次,然后加入500 μl 0.25 %胰蛋白酶溶液进行消化。将培养瓶于超净台中放置一段时间,至细胞蜷缩不贴壁时加入1640培养基,轻轻吹打使其成单细胞悬液,分装至培养瓶中。放置于37 ℃,含5 % CO2和适宜湿度的培养箱中继续培养。
2.4 MTT法测定蜈蚣粉酶解液冻干粉对乳腺癌MCF-7细胞的抑制率
2.4.1 提取物溶液配制 精密称取10.00 mg酶解液冻干粉,溶于5 ml 1640培养基,0.22 μm滤膜过滤,用l640培养基依次稀释,配成2,1,0.5,0.25,0.125 mg/ml溶液。
2.4.2 抑瘤实验 将处于对数生长期的乳腺癌MCF-7细胞消化后稀释成1×106个/ml的肿瘤细胞悬液,将其接种于96孔培养板,每孔100 μl,于37 ℃、5 %CO2培养箱中培养。培养24 h后弃掉培养基,空白对照组加不含血清的1640培养基100 μl,阳性对照组加100 μg/ml顺铂100 μl,其他给药组每孔分别加入不同浓度的药物100 μl,每个浓度的药物重复5个孔。然后将细胞放入37 ℃、5 % CO2培养箱中继续培养。24 h后,每孔加入5 mg/ml MTT溶液20 μl,置于培养箱中避光反应4 h。去除上清,加入DMSO 100 μl,使用酶标仪在492 nm波长处测定OD值,按下式计算药物对细胞的抑制率,以酶解产物对乳腺癌MCF-7细胞的抑制率为指标进行正交试验[10]。
3 正交试验结果及分析
3.1 正交试验结果
酶解工艺正交试验结果见表2。

表2 蜈蚣粉复合酶酶解工艺条件正交试验结果
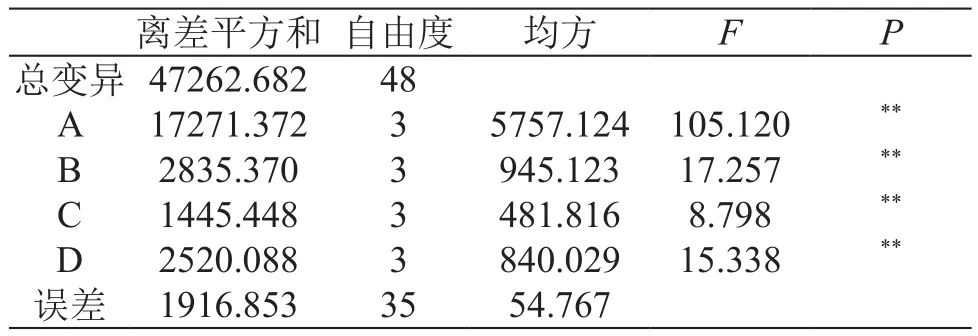
表3 方差分析表
由极差和方差分析结果可知,4因素对蜈蚣复合酶酶解液对乳腺癌MCF-7细胞的抑制效果均有极显著性影响,其中酶解温度影响最大[11]。4因素影响顺序为A>B>D>C,即酶解温度>酶解时间>加酶量>pH值。通过正交试验结果得到蜈蚣复合酶酶解最佳条件为A2B2C3D3,即酶解温度35 ℃,酶解时间3 h,pH 8.0,加酶量为2000 U/g[12]。
3.2 最佳工艺条件的验证
根据所筛选的最佳工艺条件酶解蜈蚣粉3批,按2.3项方法测定复合酶酶解蜈蚣粉产物对乳腺癌MCF-7细胞的增殖抑制率[13],3次平均增殖抑制率为61.67 %,RSD为2.93 %,表明工艺稳定可行。
4 讨论
现阶段对蜈蚣中药的应用主要集中于蜈蚣全虫,而想要扩大其药用范围及价值,采用生物转化的方式对原有中药蜈蚣进行加工修饰,是具有创新性的方法。近年对蜈蚣多肽类物质的研究成为热点,前期试验证明通过通过不同蛋白酶的专属酶切位点对原有蜈蚣蛋白进行加工修饰及剪切,可得到具有不同分子量及不同抗肿瘤效果的多肽及寡肽肽段。本文在此实验基础上采用正交试验法,选用筛选出的可提高抗肿瘤效果的3种蛋白酶进行复合酶酶解,以酶解产物对乳腺癌MCF-7细胞的增殖抑制率为指标,探究最佳复合酶酶解工艺。最佳工艺为:酶解温度35 ℃,酶解时间3 h,pH 8.0,加酶量为2000 U/g。
结果显示,酶解温度较低时酶解产物对乳腺癌MCF-7细胞的增殖抑制效果较高,随温度提升,对MCF-7细胞的增殖抑制率则降低,甚至出现负值现象。分析认为,酶解温度升高过程中,复合酶酶活性受温度影响,现分子热运动加剧趋势,酶活性会逐渐提高,温度过高则致使部分活性降低甚至丧失,从而使其抑制肿瘤细胞增殖活性减弱。因此,在使用蜈蚣药物治疗肿瘤疾病时应注意不可高温蒸煮,以免破坏有效蛋白成分影响治疗效果,这为蜈蚣药物的使用提供了实验基础。

