生姜酵素发酵过程中生物活性成分含量及其抗氧化活性的变化
周 颖,韦仕静,葛亚中,任 杰,余庆涛,杨继国,,*,宁正祥
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.无限极(中国)有限公司,广东广州 510640;3.华南协同创新研究院,广东东莞 523808)
“酵素”一词起初源于日本,是当地人对于“酶”的称呼[1]。不过如今的酵素却不单单指酶,更是指以各种水果、蔬菜、大豆、菇类、糙米、药食同源的中药如葛根等为原料,用乳酸菌或酵母发酵所制成的发酵食品[2]。酶营养学创始人E.Howell在其酶营养学一书中写到:人体一生中所产生的酶量是有限的,会愈用愈少,体酶不足是导致慢性病的根源,体酶耗尽机体也就死亡[3]。尤其随着如今社会竞争压力的增大,体内酶的损失速度更是大大加快。因此,人们要预防疾病的发生,从日常食物中摄取酶是一种简单安全的途径。但是,日常的食物在经过加工之后,其中的营养成分和酶都会遭到严重的破坏,而酵素除含有的各种各样的保健类功能性成分之外,还富含大量的脂肪酶、淀粉酶、蛋白酶、超氧化物歧化酶、乳酸、醋酸及少量乙醇等代谢产物,具有促进人体新陈代谢、调节人体肠道、抗氧化等功效[4-5],为了满足人们对营养多样性的需求,含有多种活性酶的酵素食品应运而生。
生姜是姜科姜属植物姜的新鲜根状茎,为多年生草本植物,是世界范围内一种重要的香辛调味料,也是亚洲传统药食两用植物,其性辛、微温[6]。我国生姜栽培历史悠久,资源丰富,地方品种繁多,产量很大。但目前生姜仅限于鲜食、腌制蔬菜或做调味料等,其附加价值还没有被很好的开发利用。此外,生姜储存困难,极易发生腐烂,造成一定的资源浪费。研究表明,生姜具有抗氧化[7-8]、抗炎[9]、抗肿瘤[10]、防腐抑菌[11]、止呕[12]等多种生物活性,姜辣素是生姜的主要功能性成分,也是其辣味成分,为多种物质所构成的混合物[13]。研究表明,姜酚是姜辣素的主要活性成分,主要组成有6-姜酚、8-姜酚、10-姜酚、12-姜酚等,其中以6-姜酚的含量最高,生物活性最强[14]。现今的文献中尚未有以生姜作为酵素的报道。
本研究以生姜为原料,以蔗糖作为糖源,加入酵母菌、副干酪乳杆菌、醋酸乳杆菌进行发酵,发酵周期为15 d,测定生姜酵素发酵过程中以6-姜酚、姜辣素、黄酮含量、总酚含量、以及DPPH自由基清除率,探索生姜酵素在发酵过程中的生物活性物质及抗氧化活性的变化情况,进一步探究生姜酵素的营养价值。
1 材料与方法
1.1 材料与仪器
生姜 华润万家(五山花园店);蔗糖 广州市华侨糖厂;酵母 卡迈舒(上海)生物科技有限公司;芦丁标准品 上海佳和生物科技有限公司;副干酪乳酸菌菌种、醋酸菌种(沪酿1.01) 广东省微生物菌种保藏中心;乙腈 广州化学试剂有限公司;6-姜酚标准品、1,1-二苯基-2-三硝基苯肼(DPPH·)、福林-酚 分析纯,上海源叶生物科技有限公司;芦丁、香草醛、碳酸钠、无水乙醇 均为分析纯;乙腈、6-姜酚 均为色谱纯。
ZXDP-B2270型电热恒温培养箱 上海博迅实业有限公司医疗设备厂;色谱柱(Symmetry C18Column 5 μm,4.6×150 mm) 济南赛畅科学仪器有限公司;Thermo U3000型高效液相色谱仪 Thermo Scientific;SW-CJ-10型单人净化工作台 苏州净化设备有限公司;紫外-可见分光光度计 上海菁华科技仪器有限公司;PHS-3CT型数字显示精密台式酸度计 上海精密仪器仪表有限公司。
1.2 实验方法
1.2.1 菌液制备
1.2.1.1 培养基的配制 乳酸杆菌培养基:使用常规MRS培养基配方配制。醋酸杆菌培养基:葡萄糖(1 g)、酵母浸粉(1 g)、无水碳酸钙(1.5 g)、无水乙醇(2 mL,于灭菌后在无菌操作台中加入)溶于100 mL蒸馏水中,固体培养基中另加20%琼脂粉,121 ℃高压灭菌20 min,灭菌后放至室温,备用。
1.2.1.2 菌种的活化与扩培活化 取适量的副干酪乳酸菌冻干菌粉,用无菌水溶解至一定浓度后,在无菌工作台接种至MRS固体培养基中(沪酿1.01醋酸杆菌加入醋酸杆菌固体培养基中),于37 ℃的恒温培养箱里(醋酸杆菌为30 ℃摇床培养)培养48 h,定时观察菌种的生长情况。扩培:活化后的乳酸菌接种至MRS液体培养基中(醋酸杆菌加入醋酸杆菌液体培养基中),于37 ℃的恒温培养箱中扩培12~24 h,至液体培养基有肉眼可见的浑浊度。
1.2.2 生姜酵素制备 将生姜洗净沥干,切碎(<0.5cm3),按照生姜∶蔗糖∶无菌水以5∶2∶3的比例加入灭菌的玻璃坛中(蔗糖用无菌水溶解后加入),搅拌均匀后,加入总量0.1%的酵母及1%的副干酪乳杆菌进行密封发酵,每天搅拌1次,1 min/次,48 h之后,在无菌操作台里加入总质量5%的醋酸菌,发酵周期为15 d。分别在发酵的第0、2、4、6、8、12、15 d搅拌均匀并取样(其中第0 d所取的样液,为酵母及干酪乳杆菌加入之后,立即搅拌均匀取样的未发酵样液),-20 ℃储存,以备后期检测。
1.2.3 pH的测定 由酸度计直接进行测定。
1.2.4 6-姜酚含量的测定
1.2.4.1 高效液相色谱法色谱条件 流动相:A(超纯水)、B(乙腈);色谱柱:C18(5 μm,4.6×150 mm);流速:1.0 mL/min;波长:280 nm;柱温:30 ℃;进样量:20 μL;洗脱梯度:0~10 min:40% B;0~25 min:73% B;25~35 min:40% B。
1.2.4.2 6-姜酚标准曲线的制作及样品的处理 精密配制0.2、0.1、0.08、0.04、0.01、0.005 mg/mL的系列6-姜酚标准溶液,按1.2.4.1的色谱条件进行高效液相色谱分析,以6-姜酚标准品浓度为横坐标,峰面积为纵坐标,绘制出6-姜酚标准曲线,并计算出回归方程为y=4x×106+650.86,R2=0.9979。
样品的处理:取适量样品用超纯水稀释5倍后,过0.22 μm膜后进行液相测定。
根据上述的回归方程以及样品的稀释倍数,得出发酵液中6-姜酚的含量计算公式:
6-姜酚含量(μg/mL)=(S-650.86)×W/(4×103)
式中:S-液相测定峰面积;W-样液稀释倍数。
1.2.5 姜辣素总含量的测定
1.2.5.1 香草醛标准曲线的制作 参考文献[15]中的方法,以香草醛作为对照品,测定姜辣素含量。精密配制20 μg/mL的香草醛标准液,准确吸取香草醛标准液1.0、2.0、3.0、4.0、5.0 mL,分别置于10 mL容量瓶中,无水乙醇定容至刻度,得到2、4、6、8、10 μg/mL的系列标准溶液,以无水乙醇作空白,在280 nm波长处测定吸光值并记录结果,绘制出标准曲线,以吸光值为横坐标,香草醛标准液浓度为纵坐标,得出回归方程y=12.096x+0.0635,R2=0.9991。
1.2.5.2 生姜发酵液中姜辣素总量的测定 准确吸取样品2 mL,用蒸馏水稀释3倍后,准确吸取4 mL稀释液于25 mL容量瓶中,无水乙醇定容至刻度,在280 nm波长下测定相应的吸光度,每组测定重复3次。
根据上述的回归方程以及样品的稀释倍数,得出发酵液中姜辣素的含量计算公式:
姜辣素含量(%)=W×2.003×(12.096×A+0.0635)×ρ-1×100
式中:W-发酵液稀释倍数;2.003-香草醛换算成姜辣素的系数[16];A-样品的吸光值;ρ-生姜发酵液的密度(1.003 g/mL)。
1.2.6 DPPH自由基清除能力的测定 样品的处理:取一定量样品,经高速离心机(10000 r/min),离心10 min,取1 mL上清液,蒸馏水稀释30倍,待用[17]。
取生姜发酵稀释液4 mL、0.02 mg/mL DPPH溶液4 mL混匀;25 ℃的恒温水浴锅中放置30 min后,紫外分光光度计在517 nm处测定其吸光值。空白组以4 mL无水乙醇代替样品。每组测定重复3次。
DPPH自由基清除率(%)=[1-(A1-A2)/A0]×100
式中:A0-空白组的吸光度;A1-样品溶液的吸光度;A2-用无水乙醇代替DPPH溶液时测得对应浓度的本底吸光度。
1.2.7 总酚的测定
1.2.7.1 没食子酸标准曲线的制作 参考文献[18]中的方法,以没食子酸(GAE)为对照品,测定总酚含量。精密配制0.1 mg/mL的没食子酸标准溶液,避光保存。准确吸取没食子酸标准溶液0.0、0.2、0.4、0.6、0.8、1.0 mL于10 mL的容量瓶中,分别加入2.5 mL的0.1 mol/L福林-酚试剂,摇匀后,在1~8 min内加入2 mL的15%碳酸钠溶液,蒸馏水定容至刻度,室温下避光反应2 h后,760 nm波长下测定相应的吸光度。以没食子酸浓度为横坐标,以吸光值为纵坐标,绘制出标准曲线,并计算出相应的回归方程y=11.092x-0.5812,R2=0.9972。
1.2.7.2 生姜发酵液中总酚的测定 分别取生姜发酵液100μL于10 mL容量瓶内,按照1.2.7.1方法测定样品吸光值,每组重复3次。
根据上述的回归方程以及样品的稀释倍数,得出发酵液中总酚的含量公式:
每克发酵液含没食子酸当量(mg/g)=(A+0.5812)×W×10-3/11.092ρ
式中:A-样品的吸光值;W-发酵液稀释倍数;ρ-发酵液密度(1.003 g/mL)。
1.2.8 黄酮类化合物的测定
1.2.8.1 标准曲线的制备 参考文献[19]中的方法,以芦丁作为对照品,测定黄酮总量。精确配制0.2 g/L的芦丁标准液,准确吸取芦丁标准液0、0.10、0.20、0.30、0.40、0.50 mL,分别置于5 mL容量瓶中,分别加2.5 mL 70%乙醇溶液,150μL 5% NaNO2溶液,振荡混匀,静置6 min后,分别加入300 μL 10% AlCl3·6H2O溶液,振荡混匀,静置5 min,再分别加入1.00 mL的1 mol/L NaOH溶液,摇匀后,用去离子水定容。在波长510 nm处,测定各管吸光值(A),以不加芦丁标准液管调节零点。以吸光度为横坐标,芦丁标准液浓度(μg/mL)为纵坐标绘制标准曲线,并得出回归方程:y=5.262x-0.0007,R2=0.9994。
1.2.8.2 生姜发酵液中黄酮类化合物的测定 样品处理:将发酵液用蒸馏水稀释10倍后备用。
分别准确吸取上述稀释液1 mL,按照1.2.8.1的步骤进行操作。同时做样品空白组,以不加氯化铝显色液为空白组,其他操作相同。在波长510 nm处,以样品空白调节零点,紫外分光光度计测定各管吸光值,每组重复3次。
根据上述的回归方程以及样品的稀释倍数,得出发酵液中黄酮的含量公式:
每克发酵液含芦丁当量(mg/g)=(5.262×A-0.0007)×W×10-3/ρ
式中:A-样品的吸光值;W-样品稀释倍数;ρ-发酵液密度(1.003 g/mL)。
1.3 数据处理
采用OriginPro 8.5软件绘图,并使用OriginPro 8.5 中One-way ANOVA 的Tukey分析方法进行差异显著性分析。
2 结果与分析
2.1 发酵过程pH的变化
测定发酵过程中pH,以表征发酵是否正常进行。其结果如图1所示。

图1 生姜酵素发酵过程中pH的变化Fig.1 Changes of pH during fermentation of ginger jiaosu注:分别与第0 d的进行对照比较,“*”表示具有显著性差异(p<0.05);图3~图7同。
根据图1中pH的变化趋势得知,加入复合菌种进行发酵的生姜酵素其pH一直呈下降趋势,由最初的5.85降低到3.51。以第0 d还未发酵样液的pH作为对照,其他发酵时间测定的pH都与其存在显著性差异(p<0.05)。之所以发酵过程中pH不断降低,原因有三:一是,酵母在无氧条件下,利用糖原产生乙醇及和二氧化碳,一部分二氧化碳溶于发酵液中,使pH降低[20];二是,乳酸菌产生的乳酸,也会降低发酵液中的pH[21];三是,加入的醋酸杆菌会利用乙醇生成乙酸及其他有机酸,也会使发酵过程中pH不断降低[22-23]。第3 d时,pH下降程度增大,是因为在发酵第2 d加入了醋酸杆菌,其生成的乙酸及其他有机酸,加大了产酸速度[23]。由于pH降低会影响微生物的生长,以致之后pH下降速度缓慢,最终pH降至3.55。
2.2 生姜酵素发酵过程中生物活性成分含量的变化
2.2.1 6-姜酚含量的变化 姜酚是由不同系列的化合物组成,如6-姜酚、8-姜酚、10-姜酚、12-姜酚等。其中,6-姜酚为含量最多的一种,约占75%,是生姜中主要的活性成分。具有显著的抗氧化、抗诱变、抗炎、改善人体代谢、预防有关疾病的功能[14],所以,6-姜酚是发酵过程中希望得到保留的物质。
图2是6-姜酚标准品及生姜发酵液第0 d的样品色谱图。
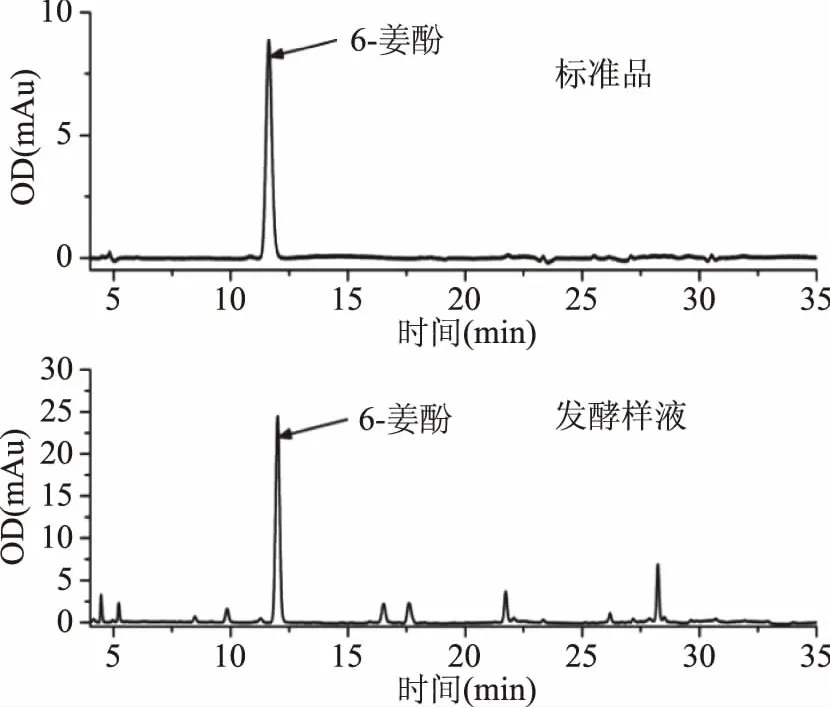
图2 6-姜酚标准品和样品色谱图Fig.2 Chromatograms of standard and sample of 6-gingerol
由图2可知,该高效液相色谱法对发酵液中的活性物质有较好的分离效果;6-姜酚在波长为280 nm的条件下出峰情况良好,峰形较好,出峰时间为12.413 min。
通过高效液相色谱法测出的峰面积及回归方程,计算生姜酵素发酵过程中6-姜酚含量的变化,其结果如图3所示。

图3 发酵过程中6-姜酚含量的变化Fig.3 Changes of 6-gingerol content during fermentation
由图3可知,复合菌发酵生姜的第2 d时,6-姜酚含量达到最高,为130.02 μg/mL,之后其含量有小幅度下降,发酵最终含量降为81.09 μg/mL。与第0 d相比,除第4 d外,其他发酵时间测定的结果都存在显著性差异(p<0.05)。这可能是发酵过程中的6-姜酚发生了转化。姜酚类物质有十多种,但这些成分的性质、结构类似,其分子结构中都有C3-羰基和C5-羟基,该结构使姜酚的化学性质极不稳定,例如在酸性条件下,C4的活泼氢易与C5的羟基一起脱水形成姜烯酚[24]。姜酚的这个性质进一步说明了生姜活性物质之间转化现象的发生。
2.2.2 姜辣素的变化 姜辣素是姜酚、姜脑等与生姜有关的辣味物质的总称,是生姜重要的活性物质,探讨姜辣素总含量的变化,有利于研究生姜酵素在发酵过程中功能性成分的转变和转化。
通过对生姜酵素发酵过程中姜辣素的含量的计算,其变化过程如图4所示。
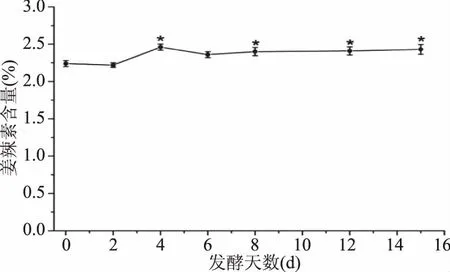
图4 生姜酵素发酵过程中姜辣素含量的变化Fig.4 Changes of gingerol content during fermentation of ginger jiaosu
如图4所示,生姜酵素呈现先升高再降低后平稳的趋势。与第0 d相比,除第2、6 d外,其他发酵时间测定的结果都与其存在显著性差异(p<0.05)。在15 d的发酵过程中,姜辣素的百分比在第4 d时升至最高(2.46%),但总体含量变化不大,维持在2.2%~2.5%之间。由此推测,在复合菌发酵的生姜酵素中,姜辣素这类物质并没有发生改变,或者此类物质在发酵过程中,因存在相互转化而致使总含量不变。由于姜辣素是生姜的主要活性物质,其总含量基本保持不变,也说明了生姜在发酵过程中生物活性基本不变,功能性成分基本没有损失,或损失很少,此方法对制作生姜酵素有一定的参考价值。
2.3 生姜酵素发酵过程中抗氧化性变化
2.3.1 生姜酵素发酵过程中DPPH自由基清除能力的变化 DPPH自由基是一种人工合成的、稳定的有机自由基,通过检测样液对DPPH自由基的清除能力可以表示其抗氧化性的强弱。
生姜酵素发酵过程中DPPH自由基清除率结果如图5所示。
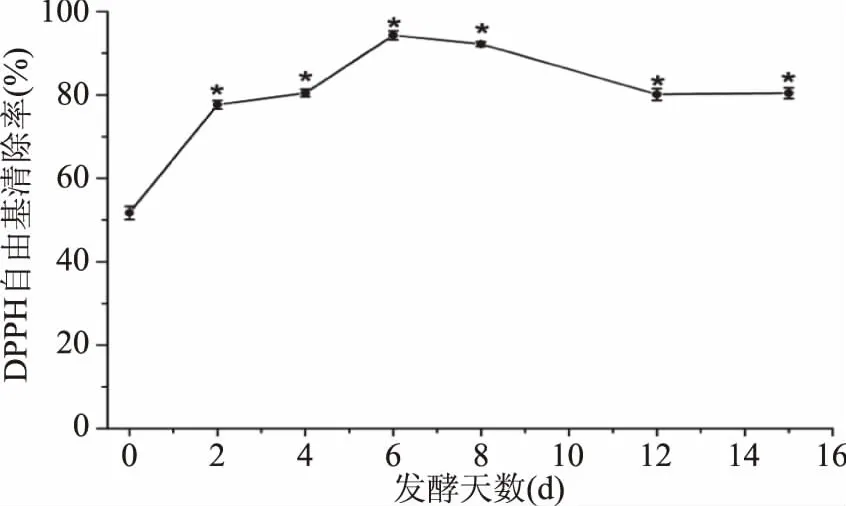
图5 生姜酵素发酵过程中DPPH自由基清除能力的变化Fig.5 Changes of scavenging rate of DPPH free radical during fermentation of ginger jiaosu
如图5所示,生姜发酵样液经稀释30倍后进行测定,DPPH自由基清除率在发酵初期(0~6 d)逐渐升高,之后出现不同程度的降低。与第0 d相比,其他发酵时间测定的结果均与其存在显著性差异(p<0.05)。DPPH自由基清除率在第6 d达到最高,稀释30倍后仍高达94.33%,虽然其之后又缓慢下降,到发酵终期15 d时降为80.45%,但较发酵初期,自由基清除率51.7%提高了将近30%。这表明对生姜进行发酵,能够提高其抗氧化活性,这进一步说明生姜酵素制作的可行性。
2.3.2 生姜在发酵过程中总酚含量的变化 总酚指样液中所有的酚类物质,是绝大多数具有抗氧化活性物质的总称,通过测定总酚含量,可判断出抗氧化性的变化趋势。研究表明,生姜中分类物质除6-姜酚外,还含有4-姜酚、甲基-6-异姜酚、6-姜二酮等等多种酚类成分[25]。生姜中的姜酚类物质具有良好的抗氧化性能,也具有抗肿瘤、抗神经损伤、抗呕吐等药理活性[26]。因此测定发酵过程中酚类物质总酚含量,是研究生姜酵素质量高低的一个重要标准。
生姜酵素发酵过程中总酚含量的变化如图6所示。
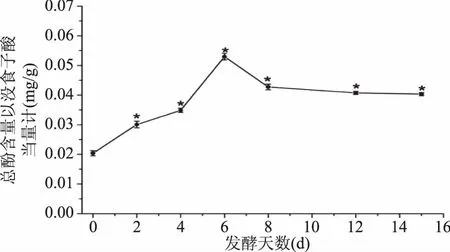
图6 生姜酵素发酵过程总酚含量的变化Fig.6 Changes of total phenols content during fermentation of ginger jiaosu
如图6所示,生姜酵素总酚含量在前6 d逐渐升高,之后又渐渐降低。与第0 d相比,其他发酵时间测定的结果均与其存在显著性差异(p<0.05)。总酚含量在发酵第6 d达到最高,以没食子酸当量计为0.052 mgGAE/g,之后又缓慢降低,最终其含量降为0.041 mg GAE/g,较第0 d发酵液的总酚含量升高了0.0192 mgGAE/g。发酵前期(0~6 d)多酚含量增加是因为,随着生姜酵素发酵的进行,发酵液中有多酚类物质不断溶出,而之后其含量降低,原因分析有二:一是,在酸性条件下,酚类易物质转化成其他物质[24];二是,发酵过程中需每天搅拌,酵母会进行有氧呼吸,产生水及二氧化碳,使发酵液总体浓度降低,同时也使总酚浓度降低[20]。
2.3.3 生姜酵素发酵过程中黄酮类化合物含量的变化 黄酮类化合物是表征生姜抗氧化活性的一个重要指标,黄酮是总酚中主要的抗氧化物质,有研究表明,生姜中的黄酮类物质具有很强的抗氧化性能[27-28]。生姜酵素发酵过程中黄酮类化合物含量的变化如图7所示。
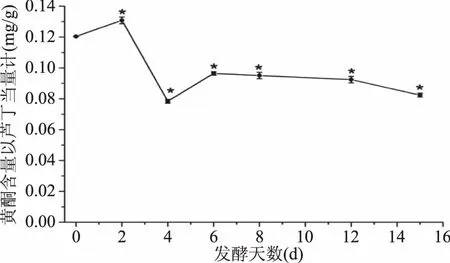
图7 生姜酵素发酵过程中黄酮含量的变化Fig.7 Changes of flavonoids content during fermentation of ginger jiaosu
如图7所示,生姜酵素在发酵的过程中,到第2 d时黄酮含量升高,发酵到最终其含量降低。与第0 d相比,其他发酵时间测定的结果均与其存在显著性差异(p<0.05)。生姜发酵到第2 d黄酮含量达到最高,以芦丁当量计为0.131 mg/g,发酵终期(第15 d)发酵液的黄酮含量以芦丁当量计降低到0.082 mg/g,较初期(第0 d)下降了31.87%。这可能是由于在发酵的过程中,生姜中的一部分游离黄酮类化合物与葡萄糖结合生成黄酮苷,而黄酮苷在水中的溶解度小于游离的黄酮类化合物,使一部分黄酮类化合物析出,以致发酵终期黄酮类化合物的含量出现降低[29-30]。
3 结论
通过对生姜酵素发酵过程中pH、6-姜酚、姜辣素含量、抗氧化活性物质黄酮及总酚含量、抗氧活化指标DPPH自由基清除率的测定,结果表明:发酵过程pH一直呈下降趋势,表明发酵过程进行正常;发酵过程中的6-姜酚含量在第2 d时其含量最达到高,姜辣素总含量变化幅度不大;黄酮的含量在第2 d时达到最高,含量以芦丁当量计为0.131 mg/g,但整体呈现下降趋势;总酚含量在发酵初期含量不断增加,至第6 d含量达到最高,之后呈现下降趋势,其最终浓度较第0 d即升高了0.0192 g GAE/g;抗氧化指标DPPH自由基清除率也保持在较理想的范围内,与总酚含量的变化趋势大体相同。
本研究所采用的生姜酵素制作方法基本保持了生姜原有的主要生物活性物质,且其抗氧化活性得到显著提高(p<0.05)。因此,通过此方法达到增加生姜附加价值的目的是可行的,这为生姜酵素的研究与制作提供了参考,但关于发酵过程中所发生的生物活性物质的相互转化、产生有机酸的种类及变化还有待进一步的研究。

