阿魏酸对小麦淀粉理化特性的影响
王 晨,谢岩黎,南永远
(河南工业大学粮油食品学院,河南省粮油食品安全检测与控制重点实验室,河南郑州 450001)
阿魏酸是(4-羟基-3-甲氧基苯基)-丙-2-烯酸,是一种羟基肉桂酸,广泛存在于水果、蔬菜和多种谷物的皮层中。阿魏酸对人类健康具有多种有益效果,例如抗炎和自由基清除作用等[1]。据报道,阿魏酸可以治疗氧化应激有关的疾病,如阿兹海默病、糖尿病、癌症、高血压、动脉粥样硬化[2-3]等。因此,阿魏酸可用于开发功能性食品和营养品。食品原料在加工和配制过程中,经破碎,混合和烹饪等处理时,多种内源和外源成分接触,从而发生相互作用,这些相互作用可能影响食品的物理化学和营养特性。阿魏酸会以结合和游离形式结合到各种类型的食物中,在加工过程中会与蛋白质和淀粉等其他组分相互作用,从而影响食品质量[4]。
淀粉是人类最重要的碳水化合物和能量物质来源,是植物体中存储量最大的多糖,它由两种主要类型的大分子组成:线性直链淀粉和支链淀粉。淀粉的糊化、老化及相互作用对于富含淀粉的食品(如谷物食品)是至关重要的,最近几年发现淀粉和酚类化合物之间的相互作用,对食品性质和营养具有一定的影响[5]。其中从分子水平上来说,淀粉和酚类的相互作用可分为v-型直链淀粉包合物的形成和非包合物的形成,在客体分子的存在下,直链淀粉经历结构变化,形成V型络合物,V型直链淀粉的螺旋疏水腔可以截留客体分子[6]。非包合物的形成包括氢键的形成,静电相互作用,疏水作用等[7]。从宏观角度讲,添加酚类对淀粉的物理化学性质会产生一定的影响,国内外有关酚类物质对淀粉特性影响的研究主要集中在茶多酚、植物化学提取物等[8-9],主要包括淀粉的糊化、回生、流变及消化性等,但关于阿魏酸对小麦淀粉特性的研究鲜有报道。
本文以小麦淀粉为研究对象,采用扫描电子显微镜、X-射线衍射仪、红外光谱扫描仪、差示扫描量热仪和快速粘度仪对添加不同比例阿魏酸的小麦淀粉的微观结构、晶体类型、官能团变化以及糊化特性等进行了研究,确定阿魏酸对小麦淀粉理化性质的影响,为开发阿魏酸的功能性食品提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
小麦矮抗58 河南省豫大农业科技开发有限公司;小麦淀粉(蛋白质含量0.62%±0.06%,粗脂肪含量0.51%±0.03%,灰分含量 1.8%±0.05%,直链淀粉含量 24.3%±0.01%,水分含量 13.28%±0.15%) 实验室自制;阿魏酸 纯度95%,上海源叶生物科技有限公司。
Quanta FEG环境扫描电镜 美国FEI公司;E-1010离子溅射仪 日立有限公司;DK-S26型电热恒温水浴锅 上海精宏实验设备有限公司;TD5-4B离心机 北京时代北利离心机有限公司;X’Pert PRO X射线衍射仪 荷兰帕纳科公司;Q20差示扫描量热仪 美国TA公司;101型电热鼓风干燥箱 北京市永光明医疗仪器厂;AL204型电子天平 梅特勒托利多仪器有限公司;PHS-3C型PH计 上海精密科学仪器有限公司;UV-Vis紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 小麦淀粉提取与制备 小麦淀粉的提取工艺:称取500 g左右的小麦面粉,加入300 mL左右的蒸馏水(水温为20 ℃左右)混合,和成均匀柔软光滑的面团,静置38.2 min,加入1650 mL左右浓度为2.5%(m/v)的氯化钠进行揉洗,将面浆过100目标准筛,后重新收集面块,蒸馏水反复揉洗。最后淀粉溶液过筛后放于大烧杯中,室温下放置4 h,弃去烧杯中的上层黄色液,将下层淀粉乳,转移至250 mL离心管中进行离心(3500×g,15 min)处理,弃去上层溶液,将下层白色湿淀粉块均匀放置瓷板托盘上45 ℃烘干,过100目筛,得到试验小麦淀粉。
1.2.2 小麦淀粉基本成分分析 水分含量:直接干燥法,参考(GB 5009.3-2016)[10];灰分含量:灼烧恒重法,参考(GB 5009.4-2016)[11];粗脂肪含量:近红外法,参考(GB/T 24870-2010)[12];直链淀粉含量,参考(GB/T 15683-2008)[13];蛋白质含量:凯氏定氮法,参考(GB 5009.5-2010)[14]。
1.2.3 扫描电镜分析 称取3.0 g小麦淀粉,分别加入阿魏酸0,5%,10%,15%,20%(w/w淀粉干基),加26.54 mL水,80 ℃糊化30 min,冷却至室温并静置24 h,后冻干、粉碎,过100目筛,得到添加阿魏酸的小麦淀粉样品,用扫描电镜观察样品,将其粘在样品座上,用洗耳球吹去未黏附的样品,真空喷金处理后观察,加速电压3 kV,放大倍数2000倍。
1.2.4 傅里叶红外光谱分析 取1.2.3中得到的阿魏酸-小麦泊粉样品,将样品和溴化钾尽可能干燥除去其中的水分。并用无水乙醇擦拭研钵、勺子、压片柱子表面等,称取充分干燥后的溴化钾约400 mg,放入玛瑙研钵中,操作过程用红外灯进行照射,保持周围环境的干燥,研磨5~10 min,再加入2 mg左右的样品,使其与溴化钾混合均匀后,再研磨3~5 min。然后用压模器压片,取出样品薄片,放在样品测试架上,在扫描次数16,分辨率4400~4000 cm-1波数范围进行红外扫描。
1.2.5 X-射线衍射分析 取适量1.2.3中得到的阿魏酸-小麦淀粉样品,放到样品盘上,利用玻片将样品压实铺平,使其形成一个平面,进行测试。测试条件为:仪器的电压为40 kV,电流为40 mA,衍射角(2θ)扫描范围为3~40°,扫描速度为8 °/min,步幅0.02°。
1.2.6 差示扫描量热仪分析 称取3.0 mg(干基)左右淀粉于铝钳锅中,分别加入0、5%、10%、15%、20%(w/w淀粉干基)阿魏酸,用微量进样器加入10 μL的蒸馏水,压盖密封室温下静置24 h,测试条件:DSC测试前在25 ℃下平衡5 min,测试温度的范围为30~130 ℃,升温速率为10 ℃/min,随后用液态氮冷却,用空铝盒作参比。
1.2.7 糊化性质的测定 取样品3.0 g(干基)淀粉置于测试用的铝筒内,分别添加5%、10%、15%、20%(w/w淀粉干基)阿魏酸至铝筒内,并加入26.54 g蒸馏水(以14%水分基),将搅拌器的桨叶在待测样品中上下搅动10次左右,使样品混合均匀,将样品置于RVA中测定黏度性质。搅拌器起始10 s以960 r/min的转动速度进行转动,目的是使待测样品形成相对均匀的悬浊液,接着以160 r/min的转动速度旋转直至测定完成。其加热程序如下:初始温度为50 ℃保持l min,之后12 ℃/min提升至95 ℃,保持2.5 min后以相同速度降温到50 ℃并保持1 min,完成测定,测定一个样品所需耗时13 min。
1.3 数据分析
在每次试验中均进行了3次平行试验,每个数据均为3次平行试验的平均值,试验数据经过SPSS 16.0分析,试验分析中采用最小显著差异(p≤0.05)的方法。
2 结果与分析
2.1 微观结构分析
从图1a可以看出,小麦原淀粉颗粒结构较完整,呈扁圆形或椭圆形,淀粉表面颗粒比较光滑。图1b为小麦淀粉糊化后的微观状态,可以看出小麦淀粉糊化后,形状发生改变,由原来的椭圆形或球形变为不规则多边形结构且表面粗糙,图1c~f为添加不同比例阿魏酸小麦淀粉糊化的微观结构,大部分颗粒发生聚集,呈不规则多边形结构,大小在70~200 μm范围内,随着阿魏酸含量的增加,淀粉表面不规程度增加,致密性降低。这可能是糊化后的淀粉在冷却过程中,线性直链淀粉形成双螺旋结构,交联过程会形成结晶域,溶解的阿魏酸会与淀粉通过氢键相互作用,而未溶解部分会稀释淀粉基质,使得淀粉彼此相互作用减少,降低了直链淀粉双螺旋的形成和交联,从而阻止了淀粉的重结晶[15]。

图1 不同比例阿魏酸(FA)对小麦淀粉(WS)微观结构的影响Fig.1 Effects of different proportions of ferulic acid on microstructure of wheat starch注:a为WS的微观结构;b、c、d、e分别为WS、(WS+5% FA)、(WS+10% FA)、(WS+15% FA)和(WS+20% FA)糊化后的微观结构。
2.2 傅里叶红外光谱分析
傅里叶红外光谱法可用于研究淀粉和淀粉基混合物光谱之间的差异性,用于指示混合时化学结构的变化[16]。从图2中可以看出,阿魏酸具有的峰1271 cm-1(C-O-C不对称伸缩振动)1517 cm-1(C=C),2951~3016 cm-1(C-H振动),3436 cm-1(OH)[17]。阿魏酸在1619,1593,1513,1434 cm-1处的尖峭峰是由于C-C骨架振动引起的,并且是芳族环的特征,在804和805 cm-1的尖峰是阿魏酸苯环上两个相邻的氢原子[18]。从图3中a曲线看出,在3400 cm-1处的极宽的谱带,是淀粉中羟基的主要特征,在2836 cm-1处的吸收峰,属于CH反对称伸缩振动,1500~1200 cm-1是蛋白质与多糖的混合振动吸收区;1400 cm-1左右属于C-H剪式振动和芳香环振动;1022 cm-1左右的吸收峰归属为淀粉中C-O伸缩振动及C-OH键的弯曲振动;其中图谱中在570 cm-1处的谱峰属于淀粉的基本骨架模式振动[19]。
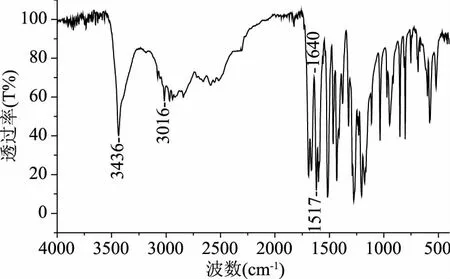
图2 阿魏酸(FA)的红外图谱Fig.2 The infrared spectrum of ferulic acid(FA)
从图3中b曲线可以看出,阿魏酸-淀粉复合物与原淀粉相比,在3400 cm-1处峰形变窄,说明羟基数目减少,这可能是阿魏酸苯环上羟基与淀粉链形成了氢键。1640 cm-1峰强度减弱,有可能是阿魏酸的芳香环和乙烯侧链嵌入了直链淀粉的疏水腔内,使更多的极性基团暴露在疏水腔外[20]。在1045和995 cm-1处的吸收峰与淀粉有序结构和水合结晶度有关,1022 cm-1c处的峰与淀粉的无定型结构有关,(1045/1022) cm-1和(995/1022) cm-1峰强度比值被看作是淀粉有序结构的指标[19],其中(1045/1022) cm-1峰强度比值表示淀粉分子结构中的有序结构和无定形结构的比例关系,比值越大,颗粒内有序度越高;测定结果表明,阿魏酸-淀粉复合物中有序结构比原淀粉减小。
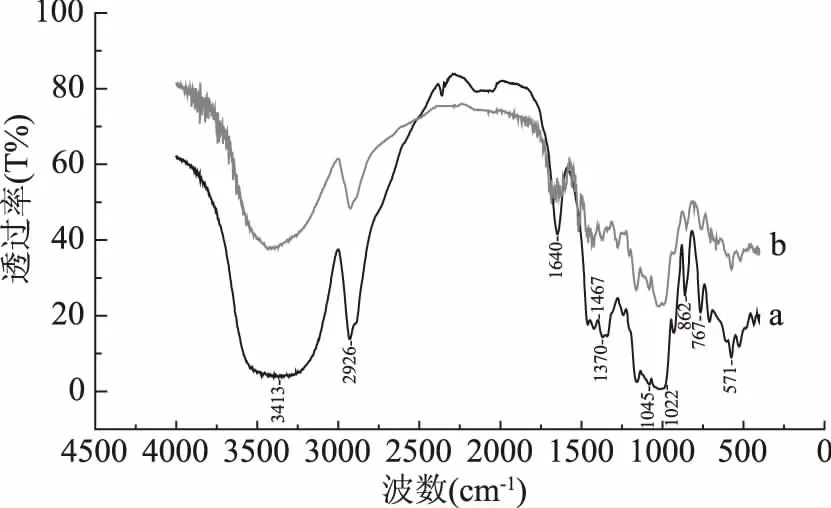
图3 小麦淀粉和阿魏酸-小麦淀粉复合物糊化后的红外图Fig.3 Infrared spectra of wheat starch and ferulicacid-wheat starch complexes after gelatinization注:a、b曲线分别为小麦淀粉(WS)和阿魏酸-小麦淀粉复合物(WS-FA)的红外图谱。
2.3 X-衍射图谱分析
淀粉是一种多晶聚合物,通过X-射线衍射可以了解淀粉的结晶性,呈现出一定的X-射线衍射图谱。淀粉分为A型、B型、C型。
大多数谷类淀粉为A型,在衍射角15、17、18、23 °处有较强衍射峰;块茎类淀粉颗粒呈B型,在衍射角5.6、17、22和24 °处出现较强衍射峰,而根茎和豆类淀粉大多呈现出C型。此外还有V型,在衍射角度为7.4、13和20 °有较强衍射峰,此形式的晶型在天然的淀粉中并不存在,只在糊化后的淀粉与类脂物及相关化合物形成复合物以后才产生[21]。
从图4阿魏酸的衍射图中看出,阿魏酸在衍射角为9、12.7、15.6、26.3、29.4 °具有较强的衍射峰。图5中a曲线可以看出,天然小麦淀粉在衍射角2θ=15.3、17.3、18.1、23.3 °处有较强吸收峰,属于典型的A型结晶结构[22]。b曲线中小麦淀粉经糊化后在衍射角2θ=17、20 °出有强吸收峰,说明小麦淀粉糊化后,结晶型由原来的A型变为B+V型。由曲线b、c曲线可知,阿魏酸添加量为5%、10%时,小麦淀粉衍射图与原糊化后淀粉相似,保留了其主要特征峰。而从d、e、f曲线中可以看出,当阿魏酸添加量为10%、15%、20%时,小麦淀粉分别在9、12.7、26.3、29.4 °出现了阿魏酸的衍射峰,其衍射峰发生变化,说明此时阿魏酸与淀粉并未形成包合物,这可能是因为直链淀粉形成的双螺旋腔体是有限的[23],而阿魏酸较低的溶解度也降低了它与淀粉间的相互作用,添加阿魏酸后的淀粉衍射强度降低,且与阿魏酸的添加量呈反比,可能是添加阿魏酸后降低了淀粉的结晶强度。
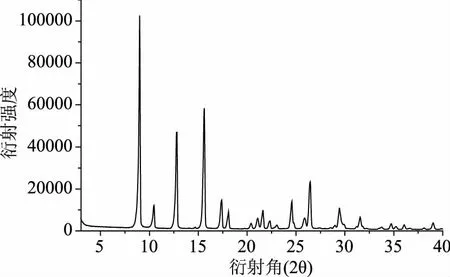
图4 阿魏酸(FA)的衍射图谱Fig.4 The diffraction pattern of ferulic acid(FA)
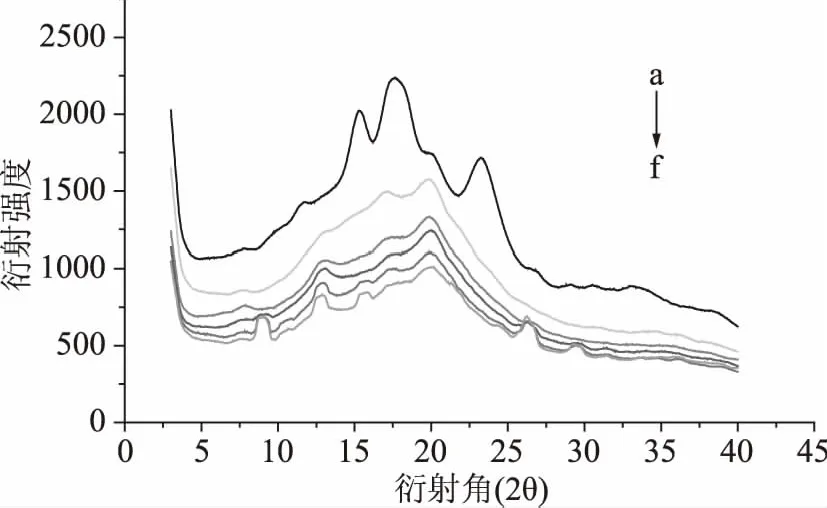
图5 添加不同比例阿魏酸(FA)的小麦淀粉的衍射图Fig.5 Diffraction of wheat starchwith different proportions of ferulic acid(FA)注:图5中a曲线是WS的衍射图谱;b~f分别为WS、(WS+5% FA)、(WS+10% FA)、(WS+15% FA)和(WS+20% FA)糊化后的衍射强度。
2.4 差示扫描量热仪分析
从表1中可以看出,淀粉的T0、Tp、Tc都有显著下降的趋势,且与阿魏酸的添加量有关,这表明阿魏酸降低了淀粉的热稳定性[24]。而最不稳定的微晶和最稳定的微晶熔融温度分别由T0和Tc表示[25],这说明阿魏酸对不稳定和稳定微晶有一定的影响。当阿魏酸添加量为10%时,淀粉的吸热焓显著减小,继续增大添加比例,吸热焓不再变化。这可能是由于在水存在的条件下,纯阿魏酸在110 ℃具有熔融峰(数据未显示),该实验条件下加入阿魏酸呈现部分溶解的状态,溶解的阿魏酸(例如,羟基和羧基组)可以与淀粉组分和水相互作用,降低系统的pH并使淀粉颗粒不稳定,该阿魏酸的不溶性结晶形式可能很少,对糊化行为的影响很小[26]。而糊化焓还可能与其具有大量的羟基结构有关,这些亲水性的羟基通过与支链淀粉的侧链结合到淀粉颗粒的非结晶区,改变了微晶区和无定型区之间的耦合力,使得淀粉颗粒发生变化,从而T0,Tp,Tc和ΔH发生变化[27-28]。

表1 小麦淀粉和添加不同比例阿魏酸小麦淀粉的热特性分析数据Table 1 DSC thermogram of native starch and starch with different proportions of ferulic acid(FA)
2.5 糊化特性分析
从图6中可以看出,随着阿魏酸添加量从0%至20%,小麦淀粉的峰值粘度由2699 cP降至2259 cP,保持粘度由2176 cP降至766 cP,最终粘度由3163 cP降至1553 cP,而崩解值由523 cP增加至1418 cP。本实验中冷却过程中降低了淀粉的最终粘度和回升值,说明阿魏酸降低了淀粉的老化程度[29]。这可能是由于阿魏酸与淀粉发生相互作用,从而结合在直链淀粉分子之间,阻碍了直链淀粉分子之间的相互作用,溶解的阿魏酸可以与淀粉聚合物发生相互作用,而没有溶解的固体阿魏酸晶体进一步稀释淀粉基质,使得淀粉彼此之间的相互作用频率降低,减少了直链淀粉双螺旋区域的缠绕和形成,从而降低了淀粉糊在冷却期间的粘度[30]。另外一个主要原因是阿魏酸的添加降低了系统中淀粉的含量,而且降低了系统的pH。Zhu等[26]研究发现,在酚类化合物存在下,在淀粉糊化之前,小麦淀粉的峰值粘度和最终粘度与系统初始pH之间存在一定的关系,当在糊化过程中,由于不断升高的温度使阿魏酸的溶解度增加,系统的pH进一步减小。当pH从7降低到4时,大米淀粉(4种基因型)的粘度略有改变,不同的pH对不同基因型的淀粉具有不同程度的影响[31]。Mota等[32]研究发现添加不同浓度的阿魏酸时,系统中部分溶解的阿魏酸(例如,羟基和羧基)可以与淀粉组分和水发生相互作用,降低系统的pH和淀粉颗粒的稳定性。随着阿魏酸添加量的增大,系统中的固体含量也逐渐增大(由于阿魏酸较低的溶解度),这可以解释添加量至10%时,其崩解值从523 cP增至1418 cP的原因。
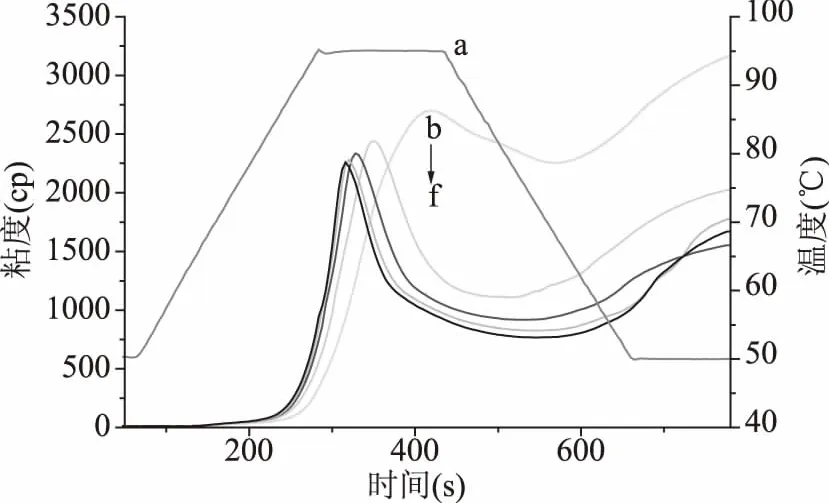
图6 添加不同比例阿魏酸的小麦淀粉的糊化曲线图Fig.6 Pasting profiles of wheat starchwith different proportions of ferulic acid注:曲线a代表温度梯度曲线,b~f分别:WS、(WS+5% FA)、(WS+10% FA)、(WS+15% FA)和(WS+20% FA)的淀粉。
3 结论
加入阿魏酸后,当添加量达到10%时,T0、TP、TC和的ΔH发生显著性降低,说明阿魏酸的添加降低了小麦淀粉的稳定性。红外光谱表明添加阿魏酸后小麦淀粉(1045/1022) cm-1峰强度比值较小麦淀粉减小,说明添加阿魏酸后小麦淀粉有序性降低;X-衍射图谱表明,阿魏酸与小麦淀粉未形成V型包合物,可能通过氢键、静电相互作用。RVA表明添加阿魏酸降低了小麦淀粉的峰值粘度、保持粘度、最终粘度降低,而崩解值增大,说明阿魏酸抑制了小麦淀粉的老化进程,扫描电镜分析也证明了阿魏酸抑制了淀粉的老化过程。因此,阿魏酸的加入对小麦淀粉的品质产生了一定的影响,阿魏酸与淀粉的相互作用还有待深入研究。

