草鱼肌原纤维蛋白-葡萄糖糖基化产物的理化特性及乳化特性研究
杨宇鸿,董士远,靳卫亚,毛振杰,苏明月,岳 敏
(中国海洋大学食品科学与工程学院,山东青岛 266003)
鱼肉蛋白具有较高的营养价值,其主要成分为肌原纤维蛋白,具有较强的凝胶性和保水性,但热稳定性和溶解性较差[1]。为了提高蛋白质的某些功能性质,可以对鱼肉蛋白进行改性。改性的方法通常有物理法、化学法、酶法。物理改性的设备投入相对大且改性范围相对窄;传统的化学改性通常会引入一些化学试剂,其安全性受到质疑;酶法的缺点是选择合适的酶、控制反应条件比较困难,而且酶的价格相对比较昂贵[2]。近年来研究发现,糖基化修饰在一定程度上可克服蛋白质遇热不稳定问题,可极大地改善蛋白质功能特性,如溶解性、热稳定性、乳化性及抗氧化性等,而且反应过程中不需要化学催化,反应条件简单,安全性大大提髙。因此,糖基化修饰被认为是改善蛋白质理化性质和功能特性的有效手段之一。糖基化反应分为干法和湿法两种,湿法糖基化反应由于水分含量高、蛋白质溶解分散性差、所需的反应温度相对较高等原因,反应较难控制;而干法糖基化虽工艺过程相对复杂,但反应条件温和,反应过程比较容易控制,是目前对蛋白质进行美拉德反应改性普遍采用的方法[1,3-4]。
目前,国内外对于鱼肉蛋白的糖基化改性研究主要集中在对鲤鱼、鲢鱼、罗非鱼等肌原纤维蛋白的溶解性、热稳定性、乳化性、抗氧化性以及钙结合能力等方面的研究,如Saeki[5]、Sato等[6]和Fujiwara等[7]分别利用核糖、褐藻寡糖和葡聚糖对鲤鱼肌原纤维蛋白进行糖基化改性,发现糖基化后的肌原纤维蛋白的溶解度、乳化性和热稳定性分别得到了显著性地提高。陈欣等[8]以葡萄糖、壳聚糖和羧甲基纤维素钠作为糖基供体对罗非鱼肌原纤维蛋白进行干法糖基化反应,发现糖基化可以提高罗非鱼肌原纤维蛋白的溶解性和热稳定性。张爱荣等[9],尤娟等[10],You等[11],Liu等[12]分别以乳糖、低聚异麦芽糖、葡萄糖、魔芋甘露寡糖为糖基供体,与鲢鱼肌原纤维蛋白糖基化反应,发现鲢鱼肌原纤维蛋白溶解性、热稳定性、乳化性、抗氧化性、钙结合能力显著性提高。目前,国内外对草鱼蛋白的糖基化反应研究,主要集中在制备草鱼蛋白酶解液调味料[13-15],提高草鱼肽的抗氧化性[16]以及降低过敏性[17]等,而关于草鱼肌原纤维蛋白糖基化反应特性研究及功能改性研究鲜有报道。利用糖基化改性草鱼肌原纤维蛋白的乳化性能[1]对提高其在食品中的应用具有重要意义。
本研究以草鱼肌原纤维蛋白为原料,系统地分析了不同反应时间对制备的草鱼肌原纤维蛋白-葡萄糖糖基化产物理化特性(包括糠氨酸含量、荧光强度、游离氨基含量、色差值)以及蛋白质二级结构、乳化特性的影响。这将为糖基化在草鱼肌原纤维蛋白改性中的实际应用提供理论基础,也为草鱼肌原纤维蛋白在食品工业生产中的应用提供理论指导。
1 材料与方法
1.1 材料与仪器
新鲜草鱼(2~3 kg/尾) 青岛市台东水产批发市场;溴化钾(光谱纯) 国药集团化学试剂有限公司;糠氨酸标准品 Neosystem Laboratoire公司;链霉蛋白酶E(酶活7000 U/g) 北京索莱宝公司;其他试剂(分析纯) 国药集团化学试剂有限公司。
GL-21M型高速冷冻离心机 湖南湘仪离心机仪器公司;LC-20AT型高效液相色谱仪、UV-2250型紫外可见分光光度计 日本岛津公司;F-4600型荧光分光光度计 日本岛津公司;Nicolet IS10型傅里叶红外光谱仪 赛默飞世尔科技有限公司;HP-200型精密色差仪 上海澳程检测仪器有限公司;IKA T18 basic型高速分散均质机 德国IKA仪器设备有限公司;超滤离心管(3 kDa) Amicon®Ultra-15。
1.2 实验方法
1.2.1 草鱼肌原纤维蛋白的提取 草鱼肌原纤维蛋白的提取采用Liu等[18]的方法。新鲜草鱼去头、去尾、去内脏后,取其背脊肉冻藏于-20 ℃以待备用。取一定质量的草鱼肉,加入10倍体积预冷的50 mmol/L pH7.0的磷酸盐缓冲溶液,匀浆,浸提30 min后离心(4 ℃,8000 r/min,10 min)取其沉淀,重复上述步骤2次。将得到的沉淀加入10倍体积50 mmmol/L pH7.0的磷酸盐缓冲液(含0.6 mol/L的KCl),匀浆2 min,搅拌浸提12 h,浸提液于4 ℃、8000 r/min离心10 min,取上清液加入3倍体积(v/v)预冷的蒸馏水,搅拌30 min后离心(4 ℃,8000 r/min,10 min),然后将沉淀冷冻干燥(真空度:1.3~13 Pa,冷阱温度:-10~-50 ℃)即得草鱼肌原纤维蛋白。上述所有操作均在4 ℃以下进行。
1.2.2 草鱼肌原纤维蛋白-葡萄糖糖基化产物制备 参考Han等[19]的方法制备草鱼肌原纤维蛋白-葡萄糖糖基化产物。草鱼肌原纤维蛋白与葡萄糖按1∶2(w/v)的比例分散于0.1 mol/L pH7.0的磷酸缓冲溶液中,均质混匀后,冷冻干燥得到干粉。称取一定量的冻干粉进行干热糖基化反应,相对湿度保持在44%,温度为50 ℃,分别于0、6、12、24、48、72、96、168 h时取样,制备草鱼肌原纤维蛋白-葡萄糖糖基化产物。将得到的反应样品配制成浓度为5 mg/mL水溶液。加入超滤离心管中,6000 r/min条件下,于4 ℃离心20 min进行脱糖,重复3次上述步骤(苯酚硫酸法检测上清液中无葡萄糖检出)后,得到的沉淀分散于蒸馏水中冷冻干燥。
1.2.3 糠氨酸含量的测定 参照Amigobenavent等[20]的方法。称取反应样品于安瓿瓶中,加入一定体积的9 N HCl,使其终浓度为6.25 mg/mL,充氮1 min,用酒精喷灯进行高温封口。随后在110 ℃条件下,水解23 h。将水解液过0.22 μm的滤膜,取0.5 mL滤液冷冻干燥后,复溶于1 mL体积比为95∶5∶0.2的超纯水∶乙腈∶三氟乙酸溶液中。取20 μL用于高效液相色谱测定。
高效液相色谱测定条件:色谱柱:C8(250×4.6 mm,5 μm,Alltech furosine专用);流动相为A:0.4%乙酸的超纯水;B:含有0.3% KCl的A,流速:1 mL/min;洗脱条件:98% A+2% B,等梯度洗脱;柱温:30 ℃;检测波长:280 nm。
1.2.4 游离氨基的测定 参照Jvande等[21]的方法。称取一定量的反应样品分散于2.5%的SDS溶液中充分混匀,使其终浓度为5 mg/mL。将混合液在70 ℃的水溶液中水浴20 min,于20 ℃ 14000 r/min离心10 min,取上清液用OPA法测定游离氨基的含量。
1.2.5 褐变强度的测定 采用色差计对不同反应时间的反应样品褐变强度进行测定。实验测定了L*值、a*值和b*值。根据以下公式计算ΔE,将其作为褐变强度。
其中“s”为样品的值,“0”为反应时间0 h样品的值。
1.2.6 荧光强度的测定 参照Morale等[22]的方法。称取30 mg反应样品,加入3 mL 0.375 mg/mL 链霉蛋白酶E(溶于0.1 mol/L pH7.4四硼酸钠溶液中),40 ℃水浴条件下振荡36 h。冷却之后,于4 ℃,4500×g离心10 min,将上清液过0.45 μm滤膜。用于荧光测定。荧光光谱分析参数:激发波长347 nm,发射波长415 nm。狭缝宽度Ex/Em=5 nm/nm,响应时间0.5 s,扫描方式为时间扫描20 s。荧光值用AU表示。
1.2.7 蛋白二级结构红外分析
1.2.7.1 傅里叶变换红外光谱分析(FTIR) 取一定量的不同反应时间的反应样品与溴化钾共同研磨压片,用溴化钾做背景,进行全波段(4000~400 cm-1)扫描,每次信号累加扫描64次,分辨率为4 cm-1。
1.2.7.2 谱图分析 红外图谱分析采用OMNIC 8.0数据处理软件,采用Peakfit 4.12软件对酰胺Ⅰ带(1600~1700 cm-1)进行去卷积和曲线拟合,多次拟合使R2大于0.97。根据李向红等[23]的研究,确定各子峰和二级结构各成分的关系,计算积分面积,分析糖基化反应后对草鱼肌原纤维蛋白二级结构的影响。
1.2.8 乳化性的测定 参考Pearce等[24]的方法略作改动。将反应样品溶于50 mmol/L PBS(pH7.4),使其终浓度为3 mg/mL。将配制的样品溶液和纯花生油以3∶1的比例在离心管中混合,并以13500 r/min在冰水中均质1 min。然后立即从管底取出0.1 mL,并用0.1% SDS稀释至5 mL,在500 nm处测其吸光值。常温下静置10 min后,从管底吸取0.1 mL,用0.1% SDS稀释至5 mL,在500 nm处测其吸光值。乳化性(EAI)和乳化稳定性(ESI)根据以下公式计算。
其中,A0和A10分别为0 min和10 min时500 nm处测定的吸光值,D为稀释系数,C为蛋白浓度,φ为油相所占体积分数,L为光路径宽度。
1.3 数据处理
每个实验重复3次,结果表示为平均值±标准偏差。数据统计分析采用SPSS 19.0,组间差异显著性分析采用方差分析(Analysis of Variance,ANOVA),p<0.05为有显著差异。
2 结果与分析
2.1 糠氨酸含量的变化
糠氨酸是由糖基化反应初级阶段的特征产物Amadori产物水解产生,其含量可以用来检测糖基化反应程度。样品中糠氨酸含量随反应时间的变化如图1所示。在反应前12 h,样品中糠氨酸含量随着反应时间的延长迅速增加,在48 h达到最高((4.09±0.07) mg/100 mg样品);随后呈现出降低的趋势,到反应结束时,其糠氨酸含量下降到(3.63±0.32) mg/100 mg样品。因此,糖基化反应过程中,糠氨酸含量呈现先增加后降低的趋势,这可能是由于随着糖基化反应的进行,形成的初级阶段产物进一步向中间产物和末期产物转化,导致糠氨酸含量的降低[25]。Yamaguchi等[25]也发现在L-赖氨酸与D-葡萄糖体系中,糠氨酸的含量随反应时间延长呈现先增大后降低的趋势。
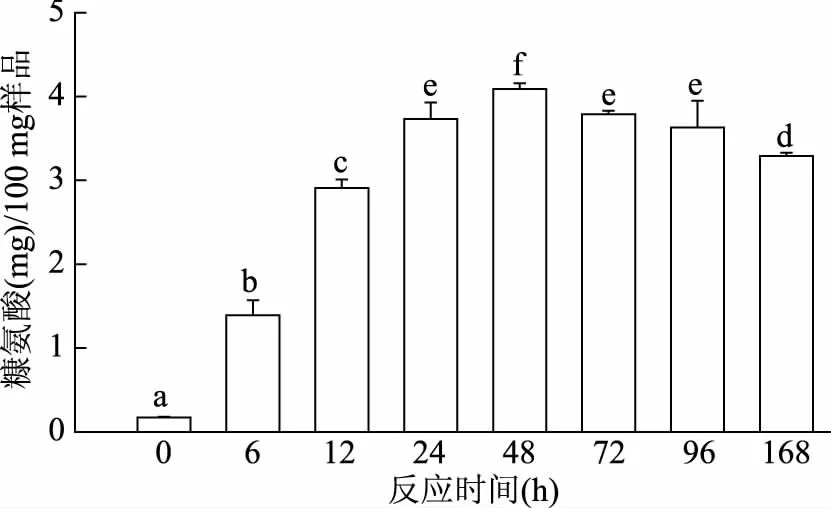
图1 加热时间对草鱼肌原纤维蛋白-葡萄糖糖基化产物中糠氨酸含量的影响Fig.1 Effect of the heating time on Furosine content in grass carp myofibrillar protein glycated with glucose注:图中不同小写字母之间存在显著性差异(p<0.05);图2~图3,图6~图7同。
2.2 游离氨基含量的变化
样品中游离氨基含量随反应时间的变化如图2所示。在反应最初48 h,肌原纤维蛋白的游离氨基含量随着反应时间延长呈逐渐下降趋势;反应24 h时,游离氨基含量较反应前下降70.4%(p<0.05);随后其含量趋于稳定;反应结束时,游离氨基含量较反应之前下降79.1%。糖基化反应过程中蛋白或氨基酸中的游离氨基,尤其是赖氨酸和精氨酸中的ε-氨基和α-氨基,与羰基化合物共价结合,体系中游离氨基被消耗,呈现出下降的趋势[27],随后游离氨基趋于稳定,这可能是因为随着反应时间的延长,初期产物发生一定程度的降解[28-29],且加热造成一些蛋白质中游离氨基的暴露[30],与糖基化反应造成的游离氨基的损耗相抵消。此前Pirestani等[26]研究也发现,在90 ℃水溶液反应条件下,油籽分离蛋白和阿拉伯胶在反应15 min内,游离氨基含量持续下降,15 min后游离氨基含量趋于稳定。
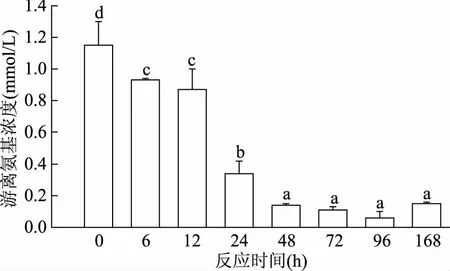
图2 加热时间对草鱼肌原纤维蛋白-葡萄糖糖基化产物中游离氨基含量的影响Fig.2 Effect of the heating time on Free amino groups content in grass carp myofibrillar protein glycated with glucose
2.3 褐变强度变化
褐变强度是评价糖基化反应最终阶段的指标之一。样品L*、a*、b*、褐变强度(ΔE)随反应时间的变化如表1所示。a*正值越大表示样品颜色越偏红,负值越小表示样品颜色越偏绿;b*正值越大表示样品颜色越偏黄,负值越小表示样品颜色越偏蓝。随着反应时间的延长,不同反应时间制备的糖基化产物的L*值逐渐减少,这表示亮度随反应时间的延长逐渐降低。除0 h样品外,a*值均为正值且依次增大,表示随着反应时间的延长,糖基化产物颜色都偏红;b*值都为正,表示颜色都偏黄,且各组之间有显著性差异(p<0.05),反应96 h后,b*值变为原来的13.8倍。这表明随着反应时间的延长,糖基化产物的ΔE值逐渐增大,反应结束时ΔE值为反应开始前的37.8倍(p<0.05)。程恒等[34]研究也发现:酪蛋白、β-酪蛋白和乳清蛋白与乳糖糖基化反应过程中,随着加热时间的增加,三种乳蛋白-乳糖糖基化产物L*值逐渐减小,a*值和b*值逐渐增大,这与本实验结果一致。这说明加热使体系发生了糖基化反应并生成了有色物质,并且随着反应时间的延长,产物颜色逐渐加深。
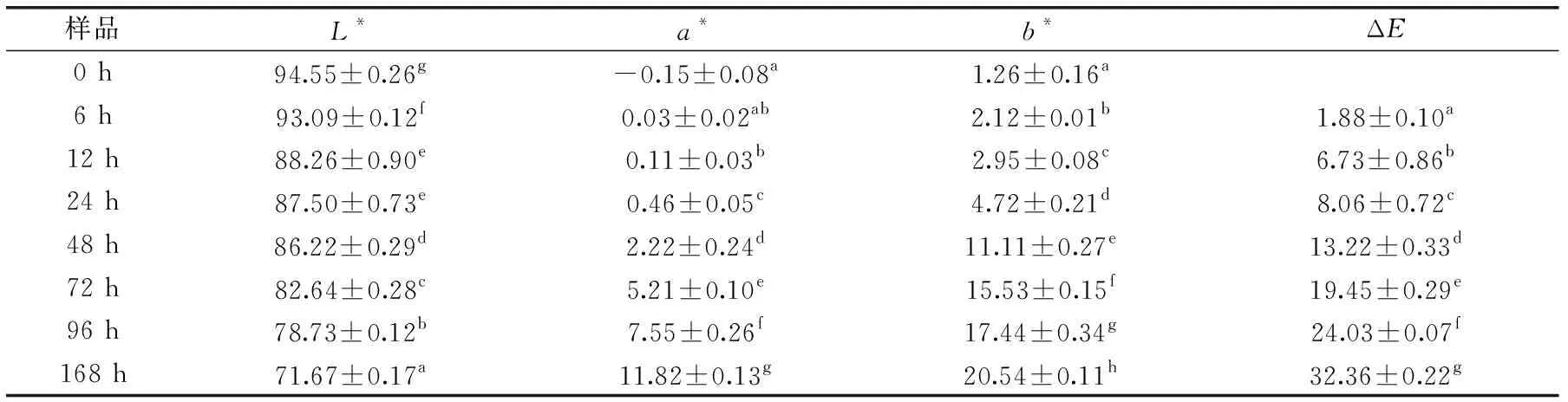
表1 加热时间对草鱼肌原纤维蛋白-葡萄糖糖基化产物L*、a*、b*、ΔE值(褐变强度)的影响Table 1 Effects of the heating time on values of L*、a*、b*、ΔE in grass carp myofibrillar protein glycated with glucose
2.4 荧光强度的变化
糖基化反应高级阶段产物通常具有荧光特性,通过对样品中荧光性的检测可以初步判断糖基化高级反应的程度[31]。样品的荧光强度随反应时间的变化如图3所示。糖基化产物的荧光强度随着反应时间的延长先增加后降低的趋势,且反应最初12 h其荧光强度的增加幅度较小;12 h之后,其荧光强度迅速增加,反应至96 h达到最大值,荧光强度为反应初期的4倍;反应168 h后,荧光强度大幅减少,这可能是因为具有荧光的物质发生一系列反应转化成了无荧光性的色素物质[32]。Pirestani等[26]在油菜分离蛋白和阿拉伯胶糖基化反应的研究中也发现,荧光强度随反应时间的延长逐渐增大,在15 min达到最大,而后持续降低直至反应结束;Jiang等[33]也发现α-乳白蛋白和β-乳球蛋白与核糖在95 ℃湿法反应条件下,荧光强度分别在1 h和2 h达到最大值,随后迅速降低直至反应结束。
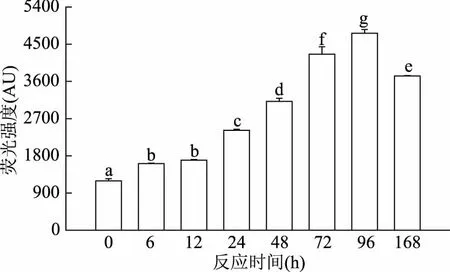
图3 加热时间对草鱼肌原纤维蛋白-葡萄糖糖基化产物荧光强度的影响Fig.3 Effect of the heating time on fluorescence intensity in grass carp myofibrillar protein glycated with glucose
2.5 红外光谱分析
糖基化反应过程中,葡萄糖分子与草鱼肌原纤维蛋白共价结合。从FTIR谱图(图4)发现,与未反应肌原纤维蛋白相比,反应之后的产物在1080 cm-1附近出现明显的吸收峰,根据Geng等[35]的研究,此波段为C-O的伸缩振动,糖基化反应过程中由于共价结合导致体系中羟基和碳氧键的增多,使得该波段吸收增强。此外,有文献报道[36],3300 cm-1附近的峰是N-H伸缩振动特征吸收峰。糖基化反应之后,3300 cm-1附近吸收峰逐渐消失,主要是因为糖基化反应过程中葡萄糖与肌原纤维蛋白的共价结合,导致N-H的减少,使得该波段吸收减少,也进一步表明草鱼肌原纤维蛋白与葡萄糖共价结合形成了共聚物。
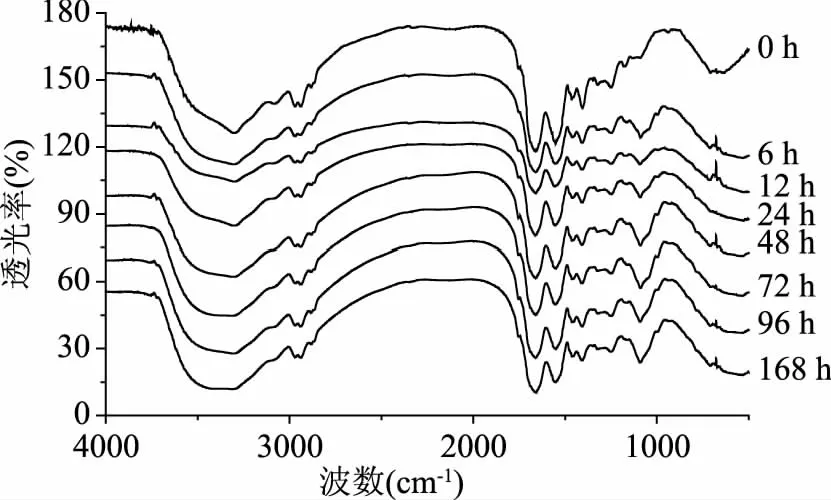
图4 加热时间对草鱼肌原纤维蛋白-葡萄糖糖基化产物FTIR的影响Fig.4 Effect of the heating time on the FTIR spectra in grass carp myofibrillar protein glycated with glucose
不同反应时间的样品的二级结构如图5所示。糖基化修饰对草鱼肌原纤维蛋白的二级结构影响很小,α-螺旋、β-转角基本无变化,无规则卷曲整体呈增大趋势,但变化不明显。反应0 h时,无规则卷曲百分含量为17.05%,而在反应48 h达到最大18.21%,之后又降低至17.82%;β-折叠百分含量0 h样品时为33.42%,反应96 h后达到最低,下降至30.89%。此结论也与前人研究结果相一致:Sun等[37]研究鸡卵清蛋白(OVA)与葡萄糖、乳糖和阿洛酮糖糖基化反应过程中发现,OVA经糖基化反应后,α-螺旋略微减少,β-折叠稍有增加,糖基化反应对OVA二级结构的影响较小;同样地,Enomoto等[38]也发现干法反应条件下,β-乳球蛋白与麦芽五糖糖基化反应后并未对β-乳球蛋白的二级结构造成显著性变化。
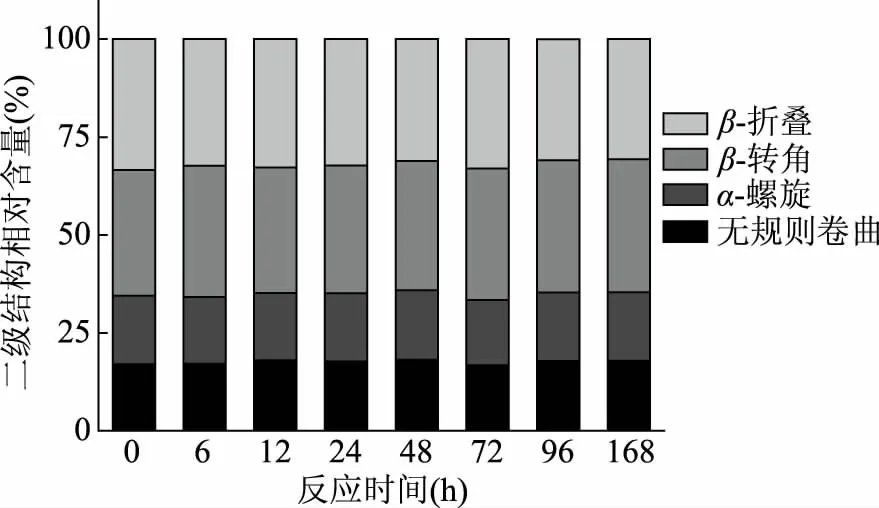
图5 加热时间对草鱼肌原纤维蛋白-葡萄糖糖基化产物二级结构的影响Fig.5 Effects of the heating time on the secondary structure in grass carp myofibrillar protein glycated with glucose
2.6 乳化性和乳化稳定性
乳化性是衡量蛋白质促进油-水型乳状液形成能力的指标,乳化稳定性是指维持乳状液稳定存在的能力。如图6所示,反应样品的乳化性随时间的延长呈先增加后降低的趋势。反应6 h时,其乳化性未呈现显著性变化(p>0.05);6 h之后迅速增加,在48 h达到最大(0.097 m2/g),为反应初期的1.32倍;48 h之后乳化性逐渐降低,反应168 h后,乳化性值为0.079 m2/g。如图7所示,随着反应时间的延长,反应样品的乳化稳定性在6 h之前没有显著性增加,6 h之后迅速增加,在48 h也达到最大,从反应初期的14.43 min增加到22.06 min(p<0.05),之后逐渐降低。闫冰等[39]研究葡聚糖与ε-聚赖氨酸共价复合物发现,乳化稳定性随着反应时间的延长呈现先增加后降低的趋势,在反应时间为18 h时,乳化稳定性达到最大值,这与本文的研究结果相一致。
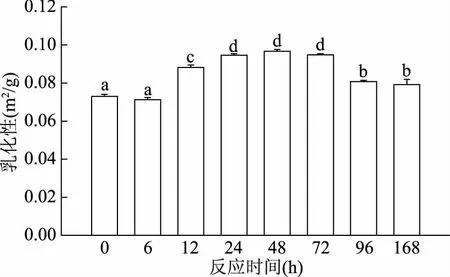
图6 加热时间对草鱼肌原纤维蛋白-葡萄糖糖基化产物乳化性的影响Fig.6 Effect of the heating time on the emulsifying activity in grass carp myofibrillar protein glycated with glucose
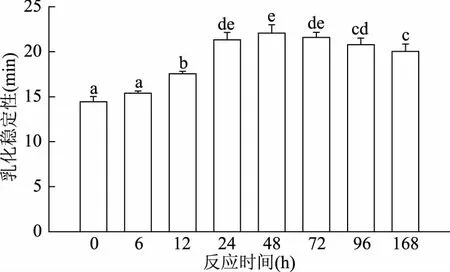
图7 加热时间对草鱼肌原纤维蛋白-葡萄糖糖基化产物乳化稳定性的影响Fig.7 Effect of the heating time on the emulsifying stability in grass carp myofibrillar proteinglycated with glucose
草鱼肌原纤维蛋白与葡萄糖糖基化反应过程中,在反应开始时,少量糖的接入使得糖基化反应产物具有两亲性,表面活性增大,从而使其乳化能力提高[40];然而,随着反应时间的延长,蛋白质发生变性以及溶解度的降低,导致其乳化能力的降低[12]。
研究发现,在50 ℃,44% RH条件下,反应48 h时(初级阶段产物Amadori产物含量最高),肌原纤维蛋白的乳化性和乳化稳定性显著提高,分别为反应初期的1.32倍(p<0.05)和1.53倍(p<0.05);反应48 h之后,乳化性和乳化稳定性显著降低(p<0.05)。由此,可以推断糖基化早期阶段可以改善鱼肉肌原纤维蛋白的乳化性能,随着糖基化反应程度的加深会造成乳化性能的降低。因此,通过控制一定的反应条件,可将反应控制在初级阶段,这对改善鱼肉肌原纤维蛋白的功能特性非常重要。
2.7 相关性分析
糖基化反应产物的乳化性能与其化学特性指标的相关性如表2所示。乳化性与糠氨酸含量极显著的正相关(r=0.74,p<0.01),与游离氨基含量呈极显著的负相关(r=-0.54,p<0.01),但与色差ΔE和荧光强度无相关性;乳化稳定性与糠氨酸含量、荧光强度呈极显著的正相关(r=0.94,p<0.01;r=0.78,p<0.01),与色差ΔE呈显著的正相关(r=0.51,p<0.05),与游离氨基含量呈极显著的负相关(r=-0.93,p<0.01)。研究结果表明:草鱼肌原纤维蛋白的乳化性和乳化稳定性受糖基化反应程度的影响。这为提高鱼肉肌原纤维蛋白乳化性能提供了参考。

表2 不同加热时间制备的草鱼肌原纤维蛋白-葡萄糖糖基化产物的化学特性指标与乳化性能的相关性分析Table 2 Correlation analysis of the chemical characterization grass carp myofibrillar protein-glucose MRPs and the emulsifying property
3 结论
通过对草鱼肌原纤维蛋白-葡萄糖糖基化产物糠氨酸、荧光强度、游离氨基含量以及色差的测定分析发现,随着加热时间的延长,糠氨酸含量与荧光强度均呈先增大后减小的变化趋势,分别在反应48 h((4.09±0.07) mg/100 mg样品)和反应96 h((4764.33±92.42) AU)达到最大值;游离氨基的含量逐渐降低,在48 h趋于稳定;总色差ΔE值则逐渐增大。红外光谱分析发现,糖基化复合物二级结构没有发生明显的变化。与反应初期相比,该复合物乳化性和乳化稳定性也呈先增大后降低的趋势,均在48 h时达到最高值。进一步通过相关性分析发现,草鱼肌原纤维蛋白的乳化性和乳化稳定性受糖基化反应程度的影响。因此,通过对糖基化反应的控制,实现了具有较高乳化性能的糖基化草鱼肌原纤维蛋白的制备,这为草鱼蛋白在食品工业化中的应用提供理论基础。

