氧化直链淀粉对姜黄素的增溶作用
解晓芬,吕永博,葛黎明,李德富,穆畅道
(四川大学 化学工程学院,四川 成都 610065)
姜黄素是一种黄色脂溶性酚类物质,作为天然色素被广泛用作食品添加剂。近年来,相关研究表明姜黄素具有抗菌、抗炎、抗氧化和抗肿瘤等多种生物活性[1-2],而且,姜黄素有促进血管生成、改善生物体内胶原蛋白和细胞外基质蛋白合成的作用,并可以加快体内伤口的愈合[3]。不过,姜黄素不溶于水,极强的疏水性使其难以在人体内被有效吸收,生物利用度低,大大限制了其临床应用[4]。为了提高姜黄素在人体中的生物利用度,多种方法被用来改善其水溶性。目前,微乳液法、固体分散法、微球或微囊包裹法和环糊精包合法等常被用来提高姜黄素的水溶性[5]。
直链淀粉是自然界植物体内与支链淀粉共同存在的一种天然线性多糖,已被广泛应用于食品、化工、医药等领域[6]。直链淀粉分子在水中可以形成“腔内疏水、外链亲水”的特殊结构,使直链淀粉可作为一种主体分子与不同性质分子通过疏水相互作用形成包合物[7]。近年来,以直链淀粉作为主体分子的包合技术受到了人们越来越多的关注。如使用直链淀粉包合薄荷酮、芳樟醇、柠檬烯、茶树油和水杨酸等以提高其水溶性和稳定性[8-10]。不过,直链淀粉由于具有较高的螺旋度以及分子内较强的氢键作用,导致其在水中的溶解度较低,形成包合物后很容易发生聚沉,严重影响了直链淀粉包合物在水环境中的应用[11]。氧化改性是淀粉化学改性中一种十分普遍的方法[12]。直链淀粉经过氧化改性后制得的氧化产物具有很高的水溶性,并且仍然具备包合能力,与一些天然活性成分形成包合物后可以在水中保持长时间稳定[13-14]。
本文中,笔者重点研究氧化直链淀粉对姜黄素在水中的增溶作用。首先通过H2O2氧化法制备高羧基含量的氧化直链淀粉,然后制备氧化直链淀粉-姜黄素包合物。对氧化直链淀粉和包合物的结构进行表征,并对氧化直链淀粉对姜黄素的包合能力、包合物水溶液的稳定性和包合物的抗氧化活性进行系统研究。
1 材料与方法
1.1 氧化直链淀粉的制备
氧化直链淀粉采用先干法-后湿法的两步氧化法制备[13]。第一步反应为直链淀粉的干法氧化:将60 g直链淀粉与不同体积的30% H2O2在500 mL烧杯中混合均匀,再加入2 mL为0.05%的硫酸铜溶液并继续混匀。将上述混合物转移至圆底烧瓶中,在45 ℃的水浴锅中预热15 min。预热后的反应物在75 ℃的水浴锅中继续连续搅拌反应15 min,得到初步氧化直链淀粉产物。第二步反应为氧化直链淀粉的湿法氧化:将初步氧化产物转移到400 mL的去离子水中,然后在100 ℃条件下连续搅拌反应30 min。反应混合物冷却至室温后,在3 000 r/min离心分离20 min,上清液用无水乙醇进行沉淀。将沉淀物用体积分数80%的乙醇溶液反复洗涤,冷冻干燥后得到氧化直链淀粉产品。上述步骤中,所添加的30% H2O2的体积分别为10、15、20和25 mL时,所制备的氧化直链淀粉分别标记为OA1、OA2、OA3和OA4。
1.2 氧化直链淀粉-姜黄素包合物的制备
首先在55 ℃下制备氧化直链淀粉水溶液,然后将过量的姜黄素加入到溶液中,在连续搅拌下将混合物冷却至室温。冷却至室温后,将溶液以2 000 r/min离心15 min,得到上层稳定的包合物溶液,经冷冻干燥后得到氧化直链淀粉-姜黄素包合物产品。根据所选择的氧化直链淀粉的不同,将包合物分别标记为OA1-C、OA2-C、OA3-C、OA4-C。直链淀粉和姜黄素包合物标记为AMY-C。
1.3 氧化直链淀粉的表征
1.3.1 羧基含量测定
羧基含量的测定采用NaOH滴定法。将样品置于真空干燥箱内干燥48 h,然后将1 g样品加入到100 mL煮沸的去离子水中,在100 ℃下搅拌10 min,随后将溶液冷却至室温并转移至100 mL的容量瓶中,定容至100 mL。样品中羧基含量通过NaOH进行滴定,以酚酞作指示剂,将样品溶液从无色滴定到粉红色,并且保持30 s内不褪色作为滴定终点。直链淀粉分子不含羧基,将其作为空白对照。氧化直链淀粉的羧基含量可由式(1)计算。
COOH含量=45c(V1-V0)×100%
(1)
式中:c是NaOH的浓度;V0是滴定直链淀粉时所消耗的NaOH溶液体积,L;V1是滴定氧化直链淀粉时所消耗的NaOH溶液体积,L;45是羧基的分子量。
1.3.2 醛基含量测定
将12.5 g的盐酸羟胺溶解于50 mL的0.5 mol/L的NaOH溶液中,然后用去离子水将溶液定容至250 mL,制备得到盐酸羟胺溶液。将1 g样品溶于100 mL 100 ℃的去离子水中,然后冷却至室温并用0.1 mol/L的盐酸溶液调节至pH 3.2。向上述溶液中加入60 mL盐酸羟胺溶液,在40 ℃下搅拌4 h,再添加0.1 mol/L的盐酸溶液将pH滴定至3.2。直链淀粉分子不含醛基,将其作为空白对照。氧化直链淀粉中的醛基含量计算见式(2)。
CHO含量=29(V0-V1)×0.1×100%
(2)
式中:0.1是滴定用盐酸的浓度,mol/L;V1是滴定氧化直链淀粉时所消耗的盐酸的体积,L;V0是滴定直链淀粉时所消耗的盐酸的体积,L;29是醛基的分子量。
1.3.3 溶解度测定
将10 g样品加到10 mL去离子水中,在20 ℃下持续搅拌12 h,然后用漏斗过滤悬浊液,将滤液冷冻干燥并称质量。氧化直链淀粉溶解度可由式(3)计算。
S=Mx×10
(3)
式中:Mx是滤液冷冻干燥后的质量,g;S为样品在水中的溶解度(g,以溶解于100 mL水计算)。
1.4 包合物中姜黄素的含量测定
采用紫外可见分光光度法检测包合物中姜黄素的含量,具体方法如下:将0.1 g包合物粉末加到乙醇溶液(体积分数80%)中,超声波处理30 min。然后将悬浊液在8 000 r/min下离心30 min,收集上清液进行紫外可见分光光度分析,并参照标准曲线计算上清液中的姜黄素含量。
1.5 傅里叶变换红外光谱测试
将样品置于真空干燥箱内,在40 ℃的条件下干燥48 h,然后将1 mg样品和200 mg KBr研匀并压片。将所压片用傅里叶变换红外光谱仪进行测试,扫描波数范围为4 000~400 cm-1,分辨率为4 cm-1。
1.6 X线衍射测试
将样品置于真空干燥箱内,在40 ℃的条件下干燥48 h,随后将样品用X线衍射仪进行测试,测试的角度范围为5°~80°,旋转速率为2 (°)/min。
1.7 热稳定性测试
将样品置于真空干燥箱内,在40 ℃的条件下干燥48 h,然后取4~5 mg的样品放入热重分析仪中进行测试,在N2的保护下以10 ℃/min的速率升温,测试的温度范围为40~600 ℃。
1.8 包合物水溶液稳定性测试
采用文献[13]报道的紫外可见分光光度法检测包合物水溶液的稳定性。将1 g样品添加到100 mL去离子水中,在90 ℃搅拌溶解20 min,然后冷却至室温得到包合物溶液。之后拍照记录包合物溶液随时间的变化,并采用紫外可见分光光度法检测包合物溶液中姜黄素的含量随时间的变化。
1.9 包合物抗氧化活性测试
将2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)溶液(7 mmol/L)与过硫酸钾溶液(2.45 mmol/L)等体积混合,并在室温下避光保存12 h得到ABTS·+溶液。ABTS·+溶液用磷酸钠缓冲液(4 mmol/L,pH 7.4)稀释,使其在734 nm处具有约0.700±0.002的初始吸光度。然后将0.1 mL 2.5 mg/mL样品与1.9 mL稀释的ABTS·+溶液混合,在室温下反应5 min后,在734 nm处测定混合物的吸光度A734。ABTS·+自由基清除率由式(4)计算。
ABTS·+自由基清除率=(AC-AS)/AC×100%
(4)
式中:AS是样品的吸光度;AC是不加任何样品的对照组的吸光度。
2 结果与讨论
2.1 氧化直链淀粉的制备
采用H2O2为氧化剂和CuSO4为催化剂进行直链淀粉的氧化。H2O2氧化是一个复杂的自由基链式反应,在Cu2+的参与下,H2O2迅速分解产生自由基,如HO·、HO2·和O2·,这些高活性的自由基容易与直链淀粉的羟基反应,生成醛基和羧基[15]。
表1为直链淀粉和氧化直链淀粉的醛基含量、羧基含量和溶解度。由表1可知,直链淀粉被成功氧化成高羧基含量的氧化直链淀粉,醛基和羧基的含量随着H2O2用量的增加而增加。氧化直链淀粉醛基含量的增速慢于羧基含量,这是因为在氧化过程中羟基首先被氧化成醛基,然后进一步被氧化成羧基。随着H2O2用量的增加,许多醛基被氧化成羧基。羧基是一种典型的亲水性基团,在水中电离后会产生排斥力,减弱直链淀粉分子间的缔合作用,从而可以提高氧化直链淀粉在水中的溶解度。氧化直链淀粉在水中的溶解度随氧化度增加不断提高,最高达到直链淀粉的79倍。高水溶性可以拓宽氧化直链淀粉在水环境中的应用范围[16]。通过优化工艺的直链淀粉两步氧化法,成功制备出高水溶性的氧化直链淀粉[17]。

表1 直链淀粉和氧化直链淀粉的醛基含量、羧基含量和溶解度
注:溶解度以淀粉溶解于100 mL水计算。
2.2 氧化直链淀粉-姜黄素包合物的制备与表征
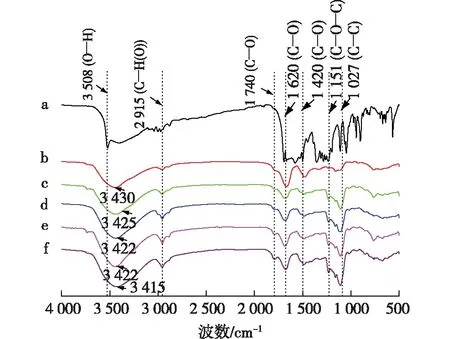
a为姜黄素;b为直链淀粉-姜黄素包合物;c为OA1-C;d为OA2-C;e为OA3-C;f为OA4-C图1 姜黄素(a)、直链淀粉-姜黄素包合物(b)和不同氧化直链淀粉-姜黄素包合物的红外光谱图Fig.1 FT-IR spectra of the curcumin(a),amylose-curcumin inclusion complex(b) and oxidized amylose-curcumin inclusion complexes(c-f)
傅里叶变换红外光谱是研究物质化学结构的有力工具。图1是姜黄素、直链淀粉-姜黄素包合物和氧化直链淀粉-姜黄素包合物的红外光谱图。由图1可以看出:包合物在3 400 cm-1处均有较强的O—H伸缩振动峰,2 915 cm-1处出现C—H的伸缩振动峰[18]。直链淀粉-姜黄素包合物和氧化直链淀粉-姜黄素包合物的红外光谱图基本一致,并没有出现姜黄素的特征吸收峰,呈现与直链淀粉相似的红外光谱特征[13-14]。直链淀粉与客体分子形成包合物后会掩盖客体分子的红外光谱特征峰,呈现直链淀粉的红外光谱吸收特征[13-14]。此外,图1显示包合物的O—H伸缩振动峰随着姜黄素的包合发生了偏移,这主要是被包合的姜黄素与直链淀粉和氧化直链淀粉的羟基之间的相互作用引起的[19]。因此,红外光谱的结果说明直链淀粉、氧化直链淀粉与姜黄素均成功形成了包合物。
热重分析常用于检测基于直链淀粉的包合物的形成[20]。图2是姜黄素、直链淀粉-姜黄素包合物和氧化直链淀粉-姜黄素包合物的TG和DTG图谱。由图2可以看出,姜黄素的最大热分解温度约为370 ℃,明显高于包合物的热分解温度。不过,包合物图谱中姜黄素的热分解峰完全消失,说明姜黄素与直链淀粉和氧化直链淀粉不是简单的共混,而是形成了包合物[20]。从图2还可以看出,直链淀粉-姜黄素包合物的最大热分解温度约为293.5 ℃,氧化直链淀粉-姜黄素包合物的最大热分解温度分别为290.3(OA1-C)、289.9(OA2-C)、289.1(OA3-C)和285.7 ℃(OA4-C)。结果表明直链淀粉-姜黄素包合物的热稳定性最好,氧化直链淀粉-姜黄素包合物的热稳定性随着氧化直链淀粉氧化度的增加而逐渐降低。这主要是因为氧化会导致直链淀粉分子的降解,造成热稳定性降低,与已有结果相符[13]。
图3(a)是直链淀粉和不同氧化直链淀粉的X线衍射图谱(XRD)图谱。直链淀粉的晶型主要有A、B和C这3种类型,在XRD图谱上A型结晶在15°和23°两处有较强的衍射峰,B型结晶在17°处有较强的衍射峰,而C型结晶为A型和B型的混合[21]。由图3(a)可以看出,直链淀粉在15°、17°、20°和23°处具有衍射峰,说明本研究使用的直链淀粉晶型为C型。另外,氧化直链淀粉的结晶峰消失,出现了一个弥散的非结晶峰,这说明氧化后直链淀粉结晶能力大大降低,仅有部分短程有序结构存在以形成弥散型的吸收峰。图3(b)为姜黄素、直链淀粉、姜黄素和直链淀粉物理混合物(AMY/C)及包合物(AMY-C)的XRD图谱。由图3(b)可以看出,姜黄素具有很多结晶峰,具有很强的结晶能力。而姜黄素与直链淀粉物理共混物的XRD图谱与直链淀粉的基本一致,这主要是因为姜黄素的添加量较少,其衍射峰被直链淀粉的衍射峰所掩盖。值得注意的是,直链淀粉与姜黄素形成包合物后,直链淀粉和姜黄素的衍射峰均消失,取而代之的是弥散的非结晶峰。这说明姜黄素与直链淀粉形成包合物后,直链淀粉的内部结构发生改变,形成了一种新的聚集态结构。图3(c)为不同氧化直链淀粉-姜黄素包合物的XRD图谱。由图3(c)可知,氧化直链淀粉与姜黄素形成包合物后,氧化直链淀粉和姜黄素的衍射峰消失,同样形成了新的聚集态结构。

a为姜黄素;b为直链淀粉-姜黄素包合物;c为OA1-C;d为OA2-C;e为OA3-C;f为OA4-C图2 姜黄素(a)、直链淀粉-姜黄素包合物(b)和不同氧化直链淀粉-姜黄素包合物的的TG和DTG图谱Fig.2 TG and DTG spectra of the curcumin(a),amylose-curcumin inclusion complex(b) and oxidized amylose-curcumin inclusion complexes (c-f)
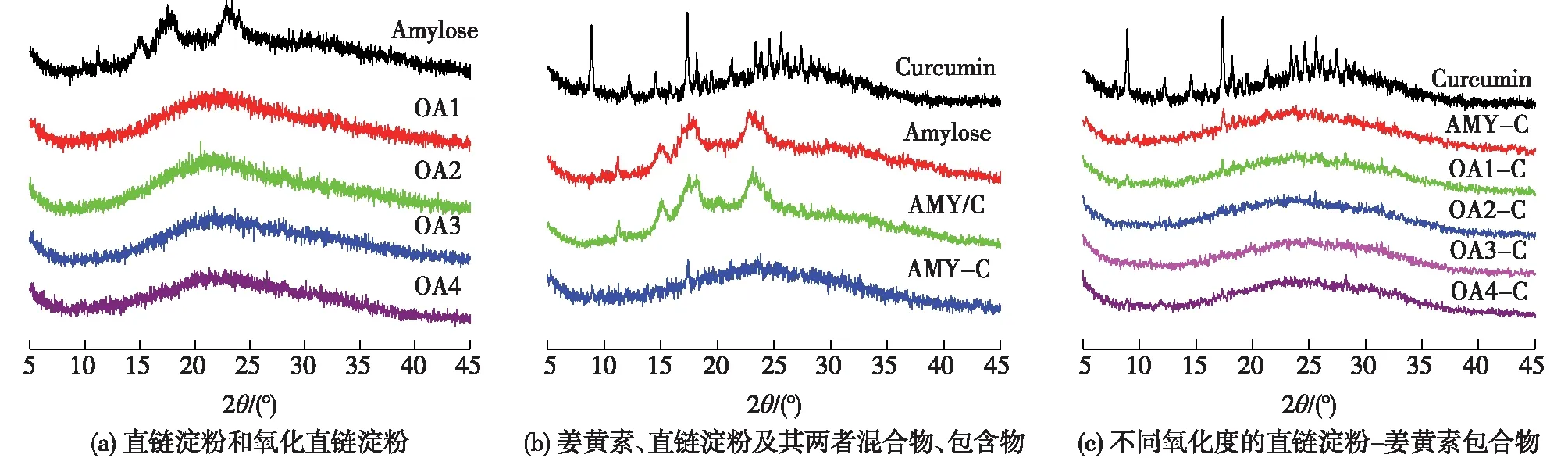
图3 直链淀粉和氧化直链淀粉(a),姜黄素、直链淀粉、直链淀粉与姜黄素物理混合物(AMY/C)(b)和 包合物(AMY-C),不同氧化直链淀粉-姜黄素包合物(c)的XRD图谱Fig.3 X-ray diffraction patterns of amylose and oxidized amylose(a),curcumin,amylose,amylose curcumin blend and amylose-curcumin inclusion complex(b), curcumin and oxidized amylose-curcumin inclusion complexes(c-f)
2.3 氧化直链淀粉对姜黄素的包合作用
表2是直链淀粉和氧化直链淀粉对姜黄素的单位包合量和增溶能力。由表2可知,随着氧化度的增加,氧化直链淀粉对姜黄素的单位包合量逐渐降低。这是因为氧化过程中直链淀粉葡萄糖残基上C-2、C-3和C-6位上的羟基被氧化,破坏了氧化直链淀粉在水中的螺旋结构;同时,氧化伴随着直链淀粉分子的降解,减少了氧化直链淀粉在水中的螺旋结构,从而降低了氧化直链淀粉包合疏水性活性物质的能力[13]。不过,由表2可以看出,氧化直链淀粉对姜黄素在水中的增溶能力和增溶倍数显著高于直链淀粉,而且呈先增大后减小的趋势。这是因为氧化直链淀粉随着氧化度的升高溶解度不断升高,形成包合物后变相地增加了姜黄素在水中的溶解度。然而,随着氧化程度的增加,氧化直链淀粉的螺旋结构被破坏得越来越严重,对姜黄素的增溶能力开始下降[14,17]。
表2 直链淀粉和氧化直链淀粉对姜黄素的包合量和增溶能力
Table 2 Content of curcumin in amylose and oxidized amylose and solubility of curcumin in saturated amylose and oxidized amyloses aqueous solutions

样品包合量/(mg·g-1)增溶能力*/mg增溶倍数AMYC2.6±0.0030.5±0.033620OA1C0.53±0.0043.0±0.0272 720OA2C0.44±0.0014.1±0.0763 720OA3C0.14±0.0041.6±0.0981 460OA4C0.06±0.0020.9±0.0551 116
注:*姜黄素样品在饱和水溶液(100 g)中的溶解度。
由表2可以看出,直链淀粉和氧化直链淀粉对姜黄素均具有显著的增溶作用。直链淀粉对姜黄素的增溶倍数达到620倍,氧化直链淀粉对姜黄素的增溶倍数最高可以达到3 720倍。
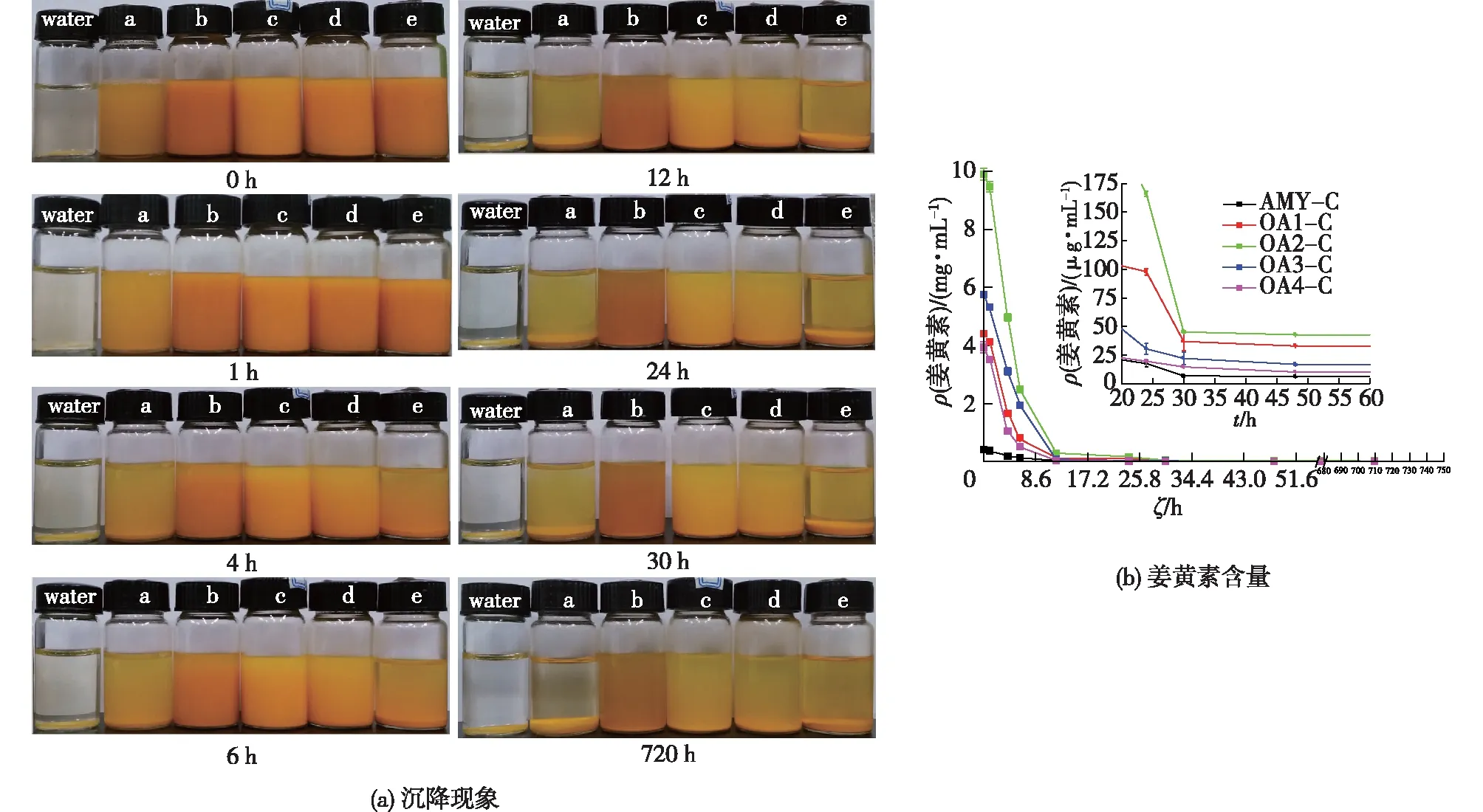
a—AMY-C;b—OA1-C;c—OA2-C;d— OA3-C;e—OA4-C图4 不同包合物水溶液随时间的沉降现象(a)和对应上层溶液中姜黄素含量(b)变化图Fig.4 Photographs of saturated aqueous solutions of AMY-C,OA1-C,OA2-C,OA3-C and OA4-C under differnet time (a) and the corresponding content of curcumin in supernatant (b)
表3是部分代表性增溶方法对姜黄素在水中的增溶效果。
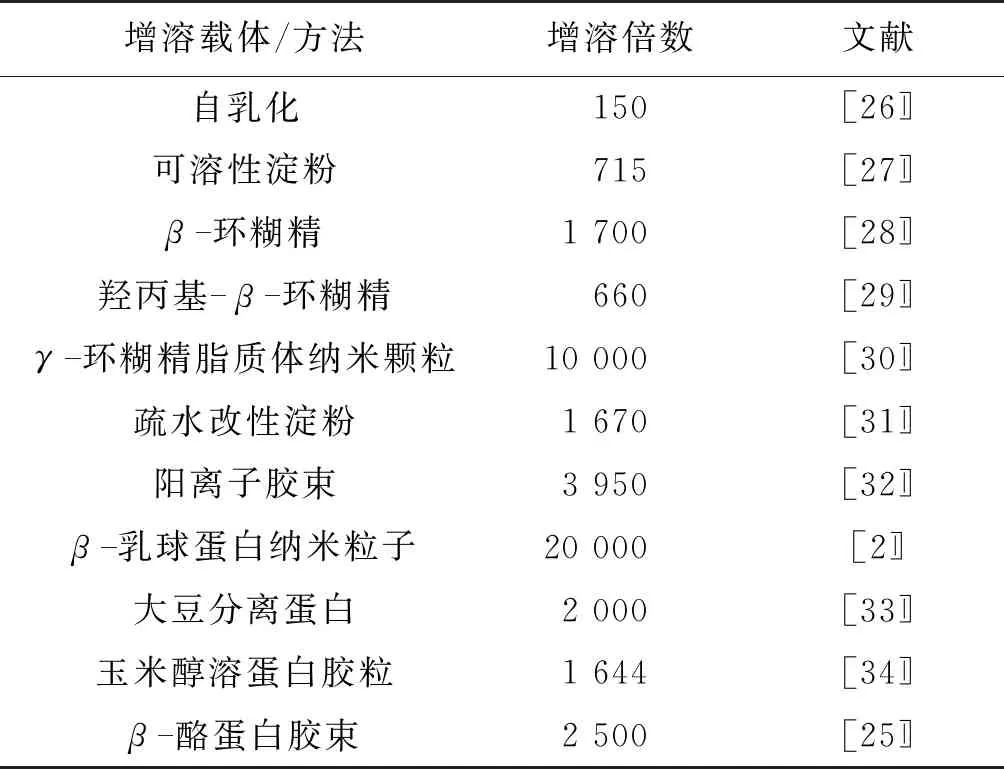
表3 部分代表性增溶方法对姜黄素在水中的增溶效果
由表3可知,很多载体或方法被用来提高姜黄素的水溶性,均表现出一定的效果。例如,在水溶液中通过自乳化作用可将姜黄素增溶150倍[22],使用大豆分离蛋白为载体可使姜黄素增溶2 000倍[23],通过β-环糊精包合姜黄素可使姜黄素增溶1 700倍[24],通过β-酪蛋白胶束可使姜黄素的溶解度增加2 500倍[25]。与已有结果相比,氧化直链淀粉对姜黄素在水中的增溶作用非常显著,姜黄素在水中的溶解度得到了很大程度的提高。而且,氧化直链淀粉的制备工艺简单,材料廉价,以氧化直链淀粉增溶姜黄素具有应用前景。
2.4 氧化直链淀粉-姜黄素包合物水溶液的稳定性
图4(a)为不同包合物水溶液随时间的沉降结果。直链淀粉分子在水溶液中具有聚集成大颗粒并形成沉淀的趋势,这一现象即是淀粉的老化性质[35]。由图4(a)可知,姜黄素分散在水中后会迅速沉淀,溶液变成无色。直链淀粉-姜黄素包合物的水溶液随时间逐渐分层,发生老化沉淀,颜色由黄色逐渐变为浅黄色。相比而言,氧化直链淀粉-姜黄素包合物的水溶液颜色变化较慢,说明其稳定性得到了提高,这主要是由于氧化直链淀粉分子间氢键的破坏以及所引入的羧基之间的排斥力作用[14]。图4(b)为不同包合物水溶液随着时间变化上层溶液中姜黄素含量的变化图。由图4(b)可知,不同氧化直链淀粉对姜黄素的增溶效果明显不同,OA2-C溶液具有最高的姜黄素含量,与表2中的数据相符。随着静置时间延长,包合物溶液上层中姜黄素的含量均在逐渐减少,与包合物溶液颜色变化和沉降现象相符。不过,由图4(b)可知,氧化直链淀粉-姜黄素包合物溶液中姜黄素的含量在沉降过程中始终远远高于直链淀粉-姜黄素包合物,OA2对姜黄素具有最高的增溶能力。
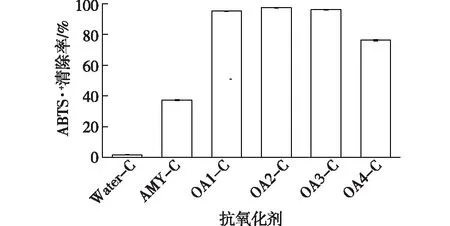
图5 姜黄素水溶液、直链淀粉-姜黄素包合物和氧化直链淀粉-姜黄素包合物水溶液的抗氧化活性Fig.5 Antioxidant activities of inclusion complexes as determined by ABTS·+ radical scavenging
2.5 氧化直链淀粉-姜黄素包合物的抗氧化活性
姜黄素具有良好的抗氧化活性[1-2],但由于不溶于水的性质,其在水环境中无法发挥活性。对姜黄素水溶液、直链淀粉-姜黄素包合物水溶液和氧化直链淀粉-姜黄素包合物水溶液的抗氧化活性进行测试,进一步反映氧化直链淀粉对姜黄素的增溶作用。自由基连锁反应是脂质过氧化的常见机制,抗氧化剂可通过消除自由基终止过氧化反应[36]。ABTS·+是极性和非极性样品抗氧化活性测定中广泛使用的合成自由基[37]。通过检测样品对ABTS·+的清除能力来评价样品的抗氧化活性,结果见图5。由图5可知,姜黄素由于不溶于水而没有表现出抗氧化活性,包合物则表现出明显的抗氧化活性。样品水溶液的抗氧化活性与其中姜黄素的含量直接相关。如氧化直链淀粉-姜黄素包合物水溶液具有明显高于直链淀粉-姜黄素包合物水溶液的抗氧化活性,这主要是由于氧化直链淀粉-姜黄素包合物水溶液中姜黄素的含量高于直链淀粉-姜黄素包合物,而且氧化直链淀粉-姜黄素包合物水溶液更稳定。此结果进一步表明氧化直链淀粉对姜黄素具有更高效的增溶作用。
3 结论
采用H2O2为氧化剂和CuSO4为催化剂,通过调节氧化剂的用量制备了具有不同氧化度的氧化直链淀粉。通过氧化改性,氧化直链淀粉的水溶性得到了大幅度提升,其水中的溶解度随着氧化度的升高不断增大。以氧化直链淀粉为载体包合姜黄素,可显著提高姜黄素在水中的溶解度,增溶倍数最高可以达到3 720倍。而且,相比于直链淀粉-姜黄素包合物,氧化直链淀粉-姜黄素包合物在水中的沉降速度减缓,溶液稳定性得到了提高。基于溶解度的提高和溶液稳定性的改善,氧化直链淀粉-姜黄素包合物水溶液呈现出更高的抗氧化活性。本文的研究结果表明氧化直链淀粉是一种有效的姜黄素增溶剂,具有应用前景。

