基于多巴胺-氧化石墨烯复合物的搅拌棒吸附萃取/高效液相色谱法测定食用油中黄曲霉毒素
李珺沬,律 涛,刘 彦,李 程,王新宇,马海燕
(河北医科大学 药学院,河北 石家庄 050017)

黄曲霉毒素(Aflatoxin,AF)主要是黄曲霉和寄生曲霉产生的次生代谢产物[1],是一种剧毒物质,被世界卫生组织(WTO)的癌症研究机构(IARC)划定为天然存在的Ⅰ类致癌物[2]。黄曲霉毒素B1、B2、G1和G2(AFB1、AFB2、AFG1和AFG2)(分子结构式如图1)普遍存在于霉变的粮食及粮食制品中[3],然而,由于AF化学结构极其稳定,普通的食物处理方法很难将其消除[4],所以一旦AF进入人类食物链,即对人体健康造成极大的危害。目前,全世界每年约有25%的食物可能受到AF的污染[5],尤其用于食用油生产的主要原料花生、葵花籽、大豆、芝麻等,在贮藏、运输、生产和加工等各环节均易受到黄曲霉菌侵染[6-7],导致AF中毒事件屡见报道[8],而食用油中AF的检测方法研究却非常有限。因此,研究建立食用油中AF的检测方法对于保障食品安全具有重要意义。
目前,AF的检测方法主要有薄层色谱法[9]、荧光分光光度法[10]、酶联免疫法[11-14]、免疫亲和柱净化/高效液相色谱法[15-18]等。然而薄层色谱法的特异性差、灵敏度低;荧光分光光度法只能检测AF总量,不能实现AFB1、AFB2、AFG1、AFG2的单独测定;酶联免疫法的特异性强、分析速度快,但稳定性较差,假阳性较多;而免疫亲和柱法依赖于与抗体的结合,可能产生抗体交联反应,导致测定结果不准确。
石墨烯是碳原子以SP2杂化轨道组成的具六角型蜂巢晶格结构的二维纳米材料[19],可经氧化制得具有含氧官能团的氧化石墨烯[20-21]。氧化石墨烯表面上的官能团能与不同的试剂反应得到功能化石墨烯,其可作为优越的吸附材料用于样品的前处理研究[22-25]。近年来,受贻贝足丝蛋白5(Mfp-5)超强黏附特性的启发,贻贝仿生化学也逐渐成为材料学、化学和生物医学等领域的研究热点[26]。多巴胺可作为Mfp-5的模型分子,通过复杂的氧化-自聚和组装,黏附于有机或无机固体材料表面,并能够通过化学键的作用与吸附材料形成聚多巴胺-吸附材料复合物涂层,从而为吸附材料在样品前处理领域的研究开辟了更加广阔的前景[26-27]。
本研究基于贻贝仿生化学制备多巴胺-氧化石墨烯复合物固相萃取材料,并将其键合在含有磁子的聚四氟乙烯材质的搅拌棒上,利用搅拌棒吸附萃取/高效液相色谱/荧光检测器对食用油中的AFB1、AFB2、AFG1和AFG2进行分析。该方法具有高效、灵敏、重现性好等特点,为食用油中痕量AF的分析提供了有效手段。
1 实验部分
1.1 仪器、试剂与样品
L-6200A高效液相色谱仪(日本Hitachi公司);2475荧光检测器(美国Waters公司);柱后衍生系统(北京创新通恒科技有限公司);DF-101S集热式恒温加热磁力搅拌水浴锅(巩义市科华仪器设备有限公司);HGC-24型氮吹仪(天津恒高技术有限公司)。
AFB1、AFB2、AFG1和AFG2标准溶液(美国Sigma公司);氧化石墨烯水分散液(济宁利特纳米技术有限责任公司);甲醇、乙腈(色谱纯,美国Tedia Scientific公司);盐酸多巴胺(山东西亚化学工业有限公司);碘(济南萧试化工有限公司);所用其它试剂均为分析纯,实验用超纯水由美国Millipore公司Milli-Q纯水系统制备。
实验所用食用油购自石家庄市某市场。
1.2 色谱条件
色谱柱:Kromasil C18色谱柱(5 μm,250 mm × 4.60 mm);流动相:甲醇-乙腈-水(10%磷酸调至pH 3.5,体积比3∶ 3∶ 5);柱温:25 ℃;进样量:20 μL;流速:0.8 mL/min;荧光检测:λex=360 nm,λem=450 nm;衍生溶液:0.05%碘溶液;衍生试剂流速:0.3 mL/min;衍生温度:70 ℃。
1.3 混合标准溶液的配制
分别精密量取AFB1、AFB2、AFG1和AFG2标准溶液适量于10 mL容量瓶中,加甲醇稀释至刻度,摇匀,制成含AFB1、AFB2、AFG1和AFG2均为50 μg/L的混合标准储备液。将混合标准储备液用甲醇逐级稀释,配制成含AFB1、AFB2、AFG1和AFG2分别为10、5、2、1、0.5、0.2、0.1 μg/L的系列混合标准溶液,于4 ℃避光保存。
1.4 SBSE搅拌棒的制备及表征方法
将含磁子的搅拌棒置于含2 g/L多巴胺的Tris-HCl缓冲溶液(pH 8.5)中,于30 ℃磁力搅拌水浴锅中缓慢匀速搅拌12 h,取出搅拌棒,于60 ℃恒温干燥箱中干燥30 min,将搅拌棒置于2 g/L氧化石墨烯水分散液中,于65 ℃磁力搅拌水浴锅中反应12 h,取出搅拌棒,于60 ℃恒温干燥箱中干燥30 min。重复以上实验步骤3次,得到具有一定多巴胺-氧化石墨烯复合物涂层厚度的SBSE搅拌棒,该搅拌棒能够批量制备,每个搅拌棒可重复使用20次。
应用扫描电镜对SBSE搅拌棒上的涂层进行表征。将上述已涂层的SBSE搅拌棒置于甲醇中超声清洗30 s,于60 ℃恒温干燥箱中干燥2 h,取出,采用离子喷镀仪进行金离子镀膜,于扫描电子显微镜下观察,对SBSE搅拌棒涂层效果进行表征。
1.5 样品前处理方法
精密量取食用油样品1 mL于10 mL离心管中,加入甲醇-水(7∶ 3)溶液[28]5 mL,超声提取10 min,以3 500 r/min离心5 min,精密量取上清液3 mL于西林瓶中,用水稀释至10 mL。
将制备好的搅拌棒置于上述溶液中,在磁力搅拌水浴锅中于50 ℃ 300 r/min萃取20 min,取出,于1 mL解吸溶剂甲醇中洗脱10 min,解吸溶液于45 ℃氮气流下吹干,以0.1 mL流动相复溶,作为供试品溶液。
2 结果与讨论
2.1 SBSE搅拌棒涂层效果的表征
通过扫描电镜技术对SBSE搅拌棒的涂层效果进行表征。由图2可见:未经涂层的SBSE搅拌棒表面光滑(图2A及插图),经多巴胺-氧化石墨烯复合物涂层后的SBSE搅拌棒表面呈粗糙、褶皱形态(图2B及插图),这种搅拌棒表面由光滑到粗糙、褶皱现象的变化是由于多巴胺聚合氧化石墨烯后能够形成高度交联的多孔性结构所致。实验结果还表明,多巴胺-氧化石墨烯复合物已成功聚合到搅拌棒上,形成了多巴胺-氧化石墨烯复合物涂层的SBSE搅拌棒。

2.2 样品前处理条件的优化
2.2.1萃取温度的优化考察了萃取温度在30~70 ℃范围时SBSE对AF萃取效果的影响。结果表明:随着萃取温度的升高,4种AF的峰面积逐渐增大,当温度为50 ℃时萃取效果最佳,之后继续提高萃取温度,各待测组分的峰面积逐渐减小。因此,本实验选择最佳萃取温度为50 ℃。
2.2.2搅拌速度的优化搅拌能够加快溶液中待测组分的传质速率,缩短萃取时间。本实验考察了不同搅拌速度(100、200、300、400、500 r/min)对萃取效果的影响。结果表明,当搅拌速度为300 r/min时,各待测组分的峰面积最大,萃取效果最佳。因此,本实验选择最佳搅拌速度为300 r/min。
2.2.3萃取时间的优化考察了不同萃取时间(5、10、20、30、40 min)对萃取效果的影响。结果表明:随着萃取时间的延长,各待测组分的峰面积逐渐增大,当萃取时间为20 min时,4种AF的峰面积达到最大值,之后继续延长萃取时间,各待测组分的峰面积变化不明显。因此,选择最佳萃取时间为20 min。
2.2.4离子强度的优化考察了体系中加入不同质量分数(0、1%、2%、3%、4%)的NaCl对萃取效果的影响。结果表明,离子强度的变化对4种AF的萃取量有明显影响,随着NaCl加入量的增大,各待测组分的峰面积均呈下降趋势。因此,本实验选择不添加NaCl。
2.2.5解吸时间的优化解吸时间是影响待测组分回收率的重要因素。本实验考察了不同解吸时间(2、5、10、15、20 min)对萃取效果的影响。结果表明,随着解吸时间的增加,4种AF的峰面积逐渐增大,当解吸时间达到10 min时,萃取效果最佳,之后继续增加解吸时间,各待测组分的峰面积趋于平缓。因此,本实验选择最佳解吸时间为10 min。
2.3 方法评价
2.3.1线性关系、定量下限与检出限按“1.2”色谱条件,对系列浓度的混合标准溶液进样测定,以目标物的峰面积(y)对其质量浓度(x,μg/L)绘制标准曲线,结果如表1所示。AFB1、AFB2、AFG1和AFG2在0.200~10.0 μg/L范围内呈良好的线性关系,相关系数r2≥ 0.998 9。取系列混合标准溶液的最低浓度溶液逐级稀释,进样并记录色谱图,分别以信噪比S/N=10和S/N=3计,得到该方法的定量下限(LOQ)和检出限(LOD)分别为0.100~0.200 μg/L和0.025~0.050 μg/L(见表1)。

表1 4种AF的线性范围、线性方程、定量下限、检出限及相关系数Table 1 Linear ranges,linear equations,LOQs,LODs and correlation coefficients of 4 AFs
2.3.2回收率与精密度以土榨花生油为例,按“1.5”方法进行样品前处理,分别向不含AFB1、AFB2、AFG1和AFG2的土榨花生油样品中添加低、中、高(0.2、1、5 μg/L) 3个浓度水平的混合标准溶液适量,每组样品平行实验6次,连续测定6 d,结果如表2所示。4种AF的加标回收率为81.5%~96.9%,日内相对标准偏差(RSD)为1.7%~3.4%,日间RSD为1.9%~3.5%,表明该方法的准确度和精密度良好。

表2 4种AFs的平均回收率和精密度Table 2 Mean recoveries and precisions of 4 AFs
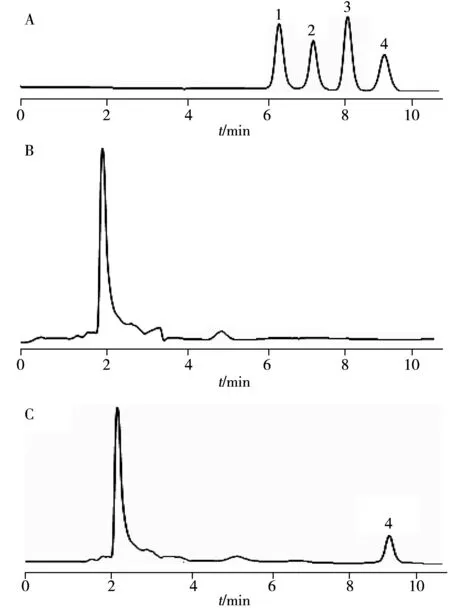
图3 AFs混合标准溶液(A)、空白土榨花生油样品(B)和含AFB1的土榨花生油样品(C)的色谱图Fig.3 Chromatograms of AFs mixsture standards(A),blank groundnut oil sample extracted by native method(B) and groundnut oil sample containing AFB1 extracted by native method(C)1.AFG2;2.AFG1;3.AFB2;4.AFB1
2.4 方法应用
采用该方法对市售5份花生油(其中2份为正规厂家生产,3份为榨油作坊生产)、5份葵花籽油、5份大豆油和5份芝麻油样品进行检测,色谱图见图3。结果表明:1份土榨花生油样品检出AFB1,检出量为2.2 μg/kg,未超标[29],其它样品未检出上述4种AFs。推测原因可能是由于AF对花生具有较高的亲和性,在潮湿环境下更易受到AF污染;由于榨油作坊原料储藏不当,在加工过程中未对重度污染的原料进行挑选剔除,因此AF的检出率较高,而正规厂家的食用油由于采用标准化生产,因此产品质量能够得到有效保障。
2.5 检测方法的比较
考察了该方法与国标方法[28]的检测结果差异,取不含AFB1、AFB2、AFG1和AFG2的同一土榨花生油样品,分别向其中添加低、中、高(0.2、1、5 μg/L)3个浓度水平的适量混合标准溶液,在相同条件下,分别采用本方法与国标方法平行测定6次,计算回收率(表3)。结果表明,该方法与国标方法的回收率无显著性差异(P>0.05)。
3 结 论
本研究基于贻贝仿生化学技术,以多巴胺-氧化石墨烯复合物为固相萃取材料制备搅拌棒,建立了搅拌棒吸附萃取/高效液相色谱检测食用油中AFB1、AFB2、AFG1和AFG2的方法。自制的搅拌棒能够批量制备、重复利用,从而大大提高了实验效率;通过对SBSE条件进行考察,优化出最佳萃取条件,并将该方法应用于食用油中4种AF的测定,实验结果表明,该方法具有操作简单、灵敏度高、重现性好等特点,能够满足痕量AF的测定要求,为食用油中AF残留的测定提供了方法参考。

表3 本方法与国标方法的实验结果比对Table 3 Comparison results obtained from the presented method and the national standard method

