碘标准溶液的均匀性、稳定性及不确定度研究
迟天顺,姚 佳
(云南省产品质量监督检验研究院,云南昆明 650000)
使用间接法标定碘标准溶液的原理为先加过量的碘标准溶液与待测溶液充分反应,用淀粉为指示剂,再用已知浓度的硫代硫酸钠标准溶液滴定过量的碘,计算碘标准溶液的浓度。其反应原理为:
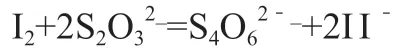
通常反应在中性或者弱酸性条件下反应,pH 过高会发生歧化反应引起标准溶液浓度误差。

强酸性条件下Na2S2O3会发生分解,I-则容易被分解。
碘单质在常温下溶解度只有0.03g 左右,易溶于汽油,乙醇等溶剂。由于碘化钾可以提供碘离子可溶于水的溶质,可以增大碘单质在水中的溶解度,所以在配制过程中加碘化钾助溶解。碘能溶于碘化物中是因为I2与碘离子生成了离子I3_。I2_+I_=I3_在这个平衡中,溶液里总有单质碘的存在,因此许多碘化钾溶液的性质与碘溶液相同。
单质碘在常温下易升华,所以碘标准溶液也可能不稳定,空气、温度、光照等因素对碘标准溶液的浓度影响较大。
1 实验部分
1.1 碘标准溶液的配制
称取13.000g 碘和35.000g 碘化钾,溶于100mL 水中,置于棕色瓶中,放置2d,稀释至1 000mL,摇匀即为待标液。
1.2 碘标准溶液的标定
(1)试剂
①蒸馏水(实验室用水二级)
②盐酸[c(HCL)=0.1mol/L]。取8.3mL 浓盐酸(12mol/L)溶液水中,稀释至1 000mL。
③硫代硫酸钠标准滴定溶液[c(Na2S2O3)=0.100 0mol/L]。
④淀粉指示剂,1%。取1g 淀粉于100mL 水中,煮沸后冷却。(2)仪器
①25mL 吸量管,检定。
②50mL 酸式滴定管,检定。
③250mL、500mL 碘量瓶。
④5mL 刻度管、250mL 量筒。(3)标定
用25mL 吸量管吸取25.00碘待标液置于250mL 碘量瓶中,加150mL 蒸馏水(15~20℃),加5mL 盐酸溶液(2.2.1.2),用硫代硫酸钠标准滴定液(2.2.1.3)滴定,临近终点时加入2.0mL淀粉指示剂(2.2.1.4),继续滴定至蓝色消失,记录消耗的硫代硫酸钠标准滴定液的体积为V1。
同时做水消耗碘的空白试验:取250mL 蒸馏水(15~20℃),加5mL 盐酸溶液(2.2.1.2),加0.1mL 碘待标液及2mL淀粉指示剂(2.2.1.4),用硫代硫酸钠标准滴定液(2.2.1.3)滴定至蓝色消失,记录消耗硫代硫酸钠标准滴定液的体积为V2。
(4)碘标准溶液的计算

式中:
V1为碘待标液消耗硫代硫酸钠标准滴定液的体积,单位为(mL);
V2为空白消耗硫代硫酸钠标准滴定液的体积,单位为(mL);C1为硫代硫酸钠标准滴定液的浓度,单位为(mol/L)V3为吸取碘待标液的体积,25.00mL。
V4为空白试验中加入碘待标液的体积,0.10mL。
2 碘标准溶液均匀性设计及结果
根据CNAS-GL003-2018 《能力验证样品均匀性和稳定性评价指南》规定,采用单因子方差分析(one way ANOVA)方法,从碘标准溶液随机量取25.00mL 样品10 个。再根据GB/T 601-2016,两人做标定,每人做10个平行,实验结果如表1所示。
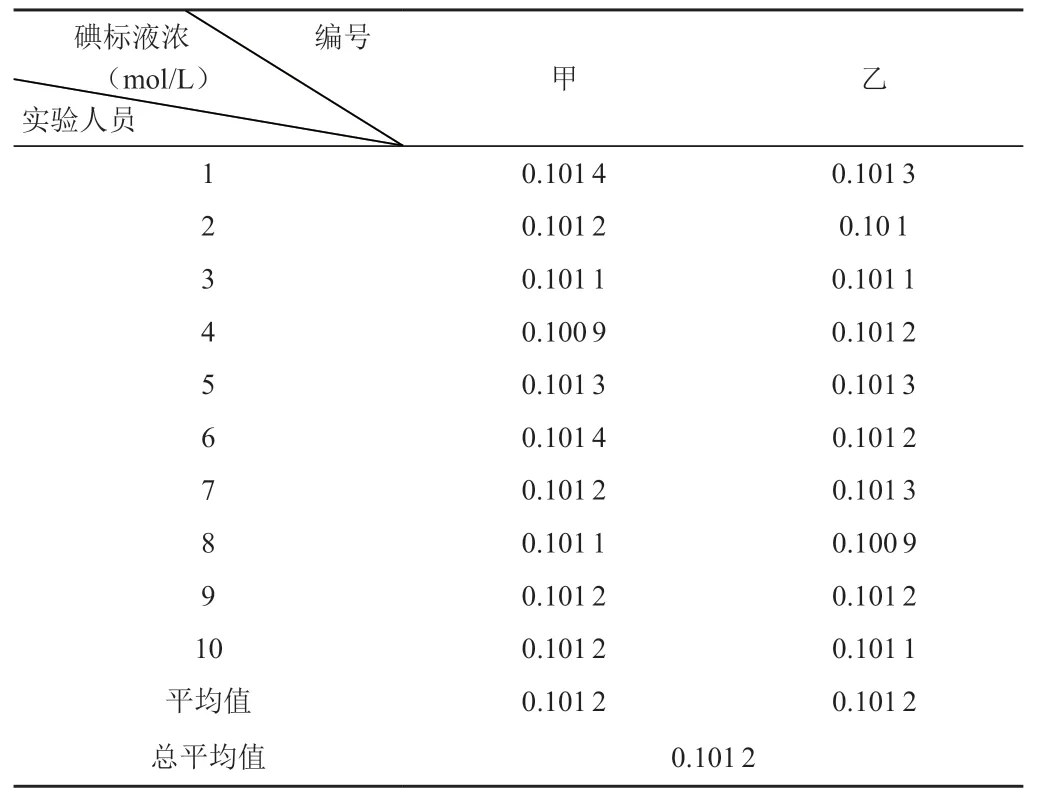
表1 碘标液均匀性结果
对表1做单因子方差分析,结果见表2。

表2 单因子方差分析结果
查F分布表可知F0.05(9,10)=3.02,从表2 可以看出,F值为2.33<F临界值3.02,表明在0.05显著水平时新配制的碘标注溶液是均匀的。
3 碘标准溶液稳定性设计及结果
3.1 稳定性设计
在常温下,35d 内对碘标准溶液的浓度进行标定,每周标定一次,采用t检验法对碘标准溶液的浓度进行评价,计算t和t临界值比较,分析其显著性。
根据CNAS-GL003-2018,t值的计算公式为:

3.2 储存时间和储存温度对碘标准溶液的影响
35d 内对常温保存碘标准溶液进行标定,结果见表3。

表3 35天内碘标准溶液浓度
查表得t临界值t0.05(17)=2.11,通过表3可以得出,甲、乙两人的t值均小于t临界值,标准溶液在配制5周内都是稳定的。
4 碘标准溶液不确定度评价
4.1 不确定度来源
从数学模型(4)可以得出不确定度的来源见图1。

图1 加入复现性的碘标准溶液不确定度来源
4.2 相对合成不确定度表达式
由于碘标准溶液的浓度是由两个人做10个平行标定所得,复现性标准不确定度不可以忽略。所以图1加入了复现性标准不确定度μ(R)。合成相对不确定的表达式为:

式中:
μ´rel(cI2)为加入复现性的碘标准该溶液的相对不确定度,mol/L;
μrel(cI2)为碘标准溶溶液的相对不确定度,mol/L;μrel(R)为复现性相对不确定度mol/L;
4.3 碘标准溶液的不确定度μ(cI2)来源
从图2可以得出,碘标准溶液的不确定度的来源有两个部分。

图2 碘标准溶液不确定度来源
4.3.1 体积引起的不确定度μ(V)
4.3.2 硫代硫酸钠标准溶液引起的不确定度μc(Na2S2O3)
4.3.3 碘标准溶液的不确定度的合成

4.4 相对不确定度评定
4.4.1 评定μ(R)两人10平行标定碘标准溶液结果见表3,计算μ(R)。

表4 两人10平行标定碘待标液结果
计算相对标准偏差:

碘标液的浓度是标定20份平行,根据贝塞尔公式:
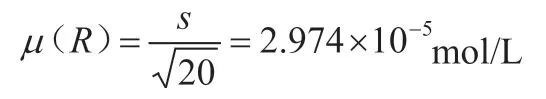
所以,相对标准偏差为:

4.4.2 评定μc(I2)
(1)评定μ(V)
从图2 可以看出,引起μ(V)的不确定度有以下3个方面线性叠加:
(2)评定μ1(V)
滴定消耗硫代硫酸钠标准溶液的体积的终点判断引起的不确定度,μ1(V);终点判断是观察蓝色消失为终点而来,不同实验人员读数也会引起不确定度。实验人员读取消耗硫代硫酸钠标准溶液的体积见表4
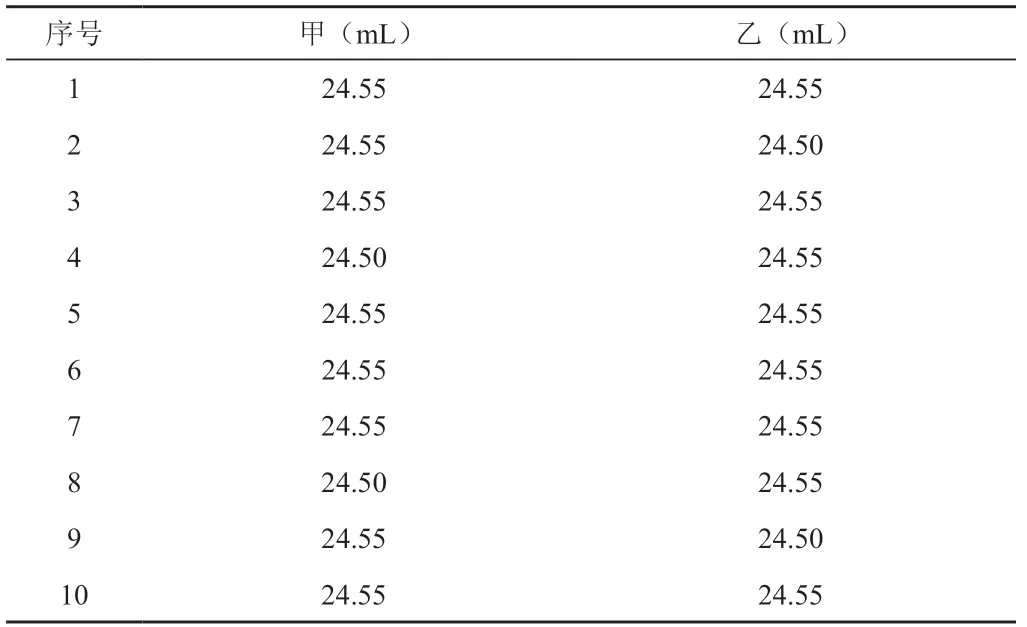
表4 各实验人员读取消耗硫代硫酸钠标准溶液的体积
计算标准偏差:

甲乙两人做20平行,根据贝塞尔公式:

(3)评定μ(T)
在吸取25mL 碘标准溶液时,碘标准溶液温度与20℃差别引起的相对不确定度,μ(T);
标定碘标准溶液时的温度为15℃,水的膨胀系数为0.000 21/℃,则因温度产生的体积增量值为(20-15)×0.000 21×25=0.026 250,则25mL 标准溶液由于温度引起的不确定度为:

(4)评定μ2(V50)
50mL 滴定管最大允许误差引起的不确定度,μ2(V50)
根据JJG196-2006《常用玻璃量器》规定,50mL 滴定管允许的误差为±0.05mL,则其不确定度为:

(5)评定μc(Na2S2O3)
查硫代硫酸钠标准溶液证书,得出:

据上述可得出μ(V)的合成不确定度为:
则相对不确定度:

μ(cI2)的相对不确定为:
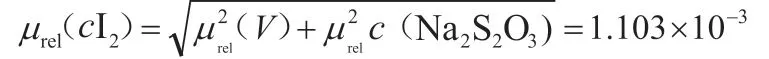
加入复现性的合成相对不确定度为:
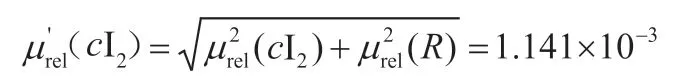
4.5 碘标液浓的扩展不确定度及浓度表示
根据JJF1059.1-2012《测量不确定度评定与表示》,当取k=2时,

标定浓度为0.1mol/L 的碘标准溶液的结果为:

5 结语
综上所述,碘标准溶液在配制后35d 内是稳定的,影响碘标准溶液的不确定度的主要因素为标定碘标准溶液时温度和玻璃器皿的误差引起,碘标准溶液的温度与20℃相差越大则引起的误差则越大,玻璃器皿应通过相关机构的检定。
硫代硫酸钠标准溶液引起的不确定度应给予重视,购买硫代硫酸钠时去正规厂家购买,并确认证书有效性,谨防买到假冒伪劣产品,影响实验结果。
碘标准溶液应使用棕色瓶避光保存,在使用过程中应尽量密封好,避免和空气长时间接触,由专业人士管理,并填写标准溶液领用记录,碘标准溶液需要定期进行复标以保证碘标准溶液的浓度有效。

