固相萃取/高效液相色谱法对火龙果中手性苯醚甲环唑的分离测定
张利强,邢淑莲,林丽云,林 玲,叶剑芝,杨春亮*
(1.中国热带农业科学院 农产品加工研究所,农业农村部农产品加工质量安全风险评估实验室(湛江),广东 湛江 524002;2.中国热带农业科学院 湛江实验站,广东 湛江 524002)
物质与其镜像不能重叠的性质称为手性(Chirality),是自然界普遍存在的基本属性。由于生物体中许多生化反应在手性环境条件下发生,使得对映体虽具有相同的理化性质,但在毒性、生物活性及与手性的生命系统作用时常表现出明显差异[1]。如20世纪60年代典型的“反应停事件”,沙利度胺(Thalidomide)的R-型对映体具有抑制妊娠反应活性,而S-型对映体具有严重的胚胎毒性和致畸作用[2]。三唑类手性农药种类众多且应用广泛,但由于其对映体存在不同的杀菌活性和毒理效应而被美国环境保护署(EPA)列为潜在的手性致癌物[3-4]。因此,建立测定手性农药对映体含量的新方法,对于明确对映体活性和毒理效应,客观全面了解手性农药在环境中的确切行为具有重要研究意义。
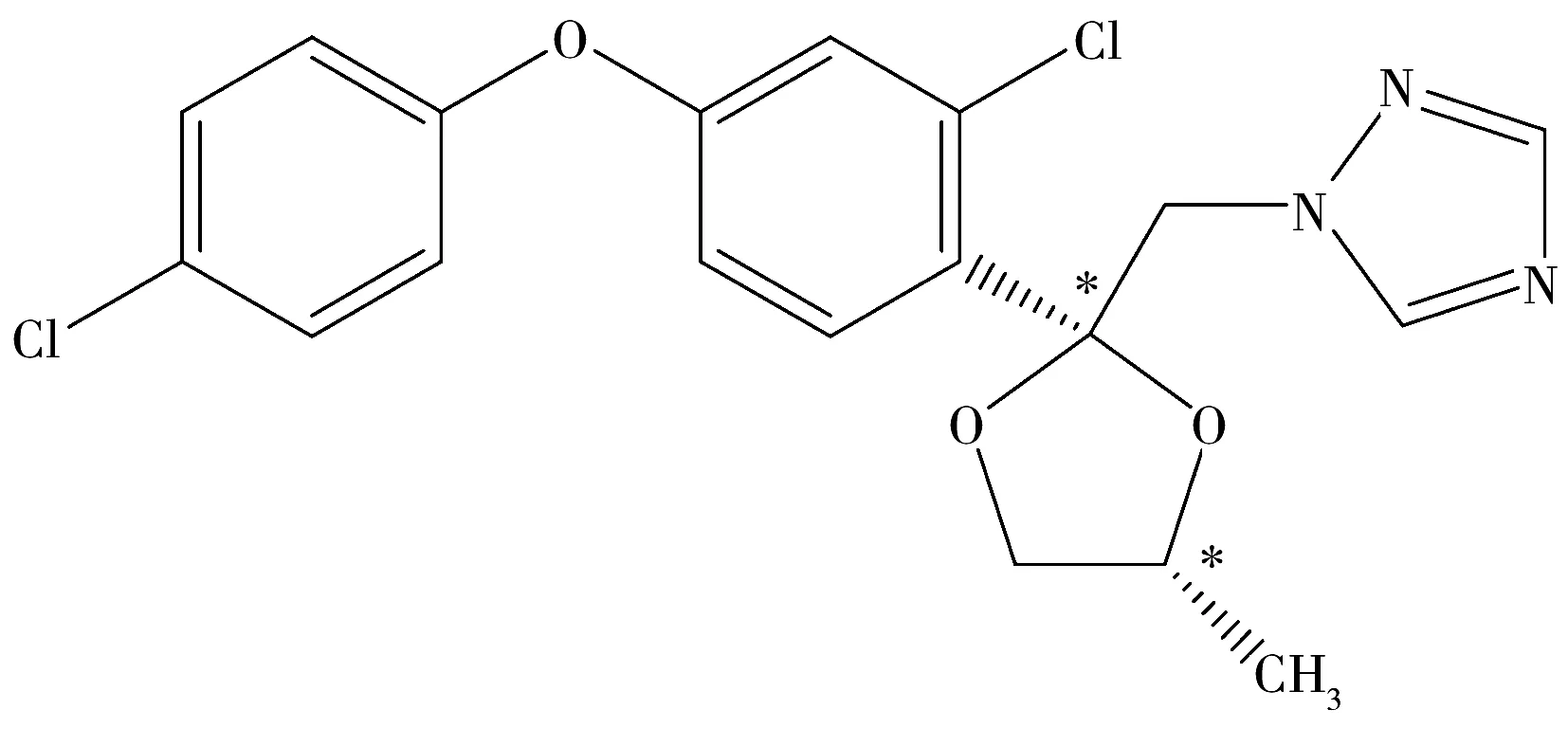
图1 手性农药苯醚甲环唑的化学结构Fig.1 Chemical structure of chiral pesticide difenoconazole*denoted chiral center

苯醚甲环唑4个手性对映体的拆分和测定与仅含1个手性中心的其他三唑类农药相比难度较大。有关苯醚甲环唑等三唑类农药对映体的拆分方法主要有毛细管电泳法[8-10]、超临界流体色谱法[11-13]和高效液相色谱法[14-17]。液相色谱法因无需样品气化,柱容量高,分离条件温和,且该仪器技术日趋成熟,已成为三唑类农药手性拆分的主流方法[18]。上述仪器方法[8,13-15]对其他三唑类农药均能实现较好的基线分离,而对苯醚甲环唑其中2个对映体(2R,4R)-苯醚甲环唑与(2S,4S)-苯醚甲环唑却不能完全分离或分离时间较长[16]。本研究以火龙果为代表,建立了一种石墨化炭黑/氨基固相小柱净化,直链淀粉-三(3-氯-4-甲基苯基氨基甲酸酯)键合手性柱(IF-3)进行拆分的高效液相色谱法。该方法分离时间较短,分离效果好,灵敏度高。适合推广用于火龙果等水果中手性农药苯醚甲环唑含量的测定。
1 实验部分
1.1 仪器与试剂
岛津LC-20AD高效液相色谱仪,配有二极管阵列检测器、自动进样器(日本岛津公司);PL-602L电子天平(美国梅特勒-托利多公司);24N-EVAP112型氮吹仪(美国Organomation公司);MS-3振荡器(德国IKA公司);立式大容量高速离心机(日本日立公司)。
苯醚甲环唑外消旋体标准品(纯度≥98%,德国Dr.Ehrenstorfer公司);正己烷、丙酮、乙腈、乙醇(色谱纯,德国默克公司);氯化钠(优级纯,天津市科密欧化学试剂有限公司);Sep-Pak Carbon/NH2固相萃取柱(500 mg/500 mg,6 mL,美国Waters公司);Chiralcel IF-3(4.6 mm×250 mm,3 μm),填料为直链淀粉-三(3-氯-4-甲基苯基氨基甲酸酯)共价键合3 μm硅胶(日本大赛璐化学工业公司),其他试剂均为分析纯,实验用水为超纯水。火龙果样品从市场随机购买。
1.2 实验方法
1.2.1色谱条件手性色谱柱:Chiralcel IF-3(4.6 mm×250 mm,3 μm),填料为直链淀粉-三(3-氯-4-甲基苯基氨基甲酸酯)共价键合3 μm硅胶。流动相为正己烷-乙醇(92∶ 8,体积比),使用前经0.45 μm滤膜过滤,手动摇匀。流速为1.0 mL/min,检测波长为220 nm,进样量为60 μL。所有样品至少平行测定2次。
1.2.2标准溶液的配制准确称取25 mg苯醚甲环唑外消旋标准品于25 mL容量瓶中,用丙酮溶解并定容至刻度,得到1 000 mg/L的外消旋苯醚甲环唑储备液,即对映体的质量浓度均为250 mg/L。于4 ℃冰箱中避光保存,临用前恢复至室温并摇匀。按样品前处理过程将空白样品处理后得到空白基质提取液,用此基质溶液将标准储备液稀释至所需浓度,得到一系列不同浓度的苯醚甲环唑基质标准溶液。
1.2.3样品前处理方法选取新鲜的火龙果,带皮切成小片,用打碎机磨成果浆。分别称取火龙果试样10.00 g于3个50 mL离心管中(1、2、3号),1号离心管中不添加外消旋苯醚甲环唑标液作为空白;2号离心管中添加0.20 mL 20 mg/L的外消旋苯醚甲环唑标液作为样品1;3号离心管中添加1.40 mL 20 mg/L的外消旋苯醚甲环唑标液作为样品2。各离心管的液体混匀后作为模拟样品,用于回收率实验。
分别加入20.0 mL乙腈于上述离心管中,混匀,加入4.0 g氯化钠,于2 000 r/min涡旋1 min,再以8 000 r/min离心5 min,吸取上层乙腈清液氮吹至约1 mL。用4.0 mL乙腈-甲苯(3∶ 1,体积比,下同)预先淋洗石墨化炭黑/氨基小柱,至液面近干时,将提取液加入到小柱中,再向浓缩管中加入2.0 mL乙腈-甲苯(3∶ 1),涡旋后一并加入到小柱。然后用10.0 mL上述混合溶剂洗脱,洗脱液氮气吹干,用正己烷定容至1.00 mL,过0.22 μm有机滤膜后待测。
2 结果与讨论
2.1 色谱条件的优化
2.1.1手性色谱柱的选择目前关于苯醚甲环唑手性拆分的研究较少,文献报道中采用的手性色谱柱有纤维素-三(3,5-二甲基苯基氨基甲酸酯)(Chiralcel OD柱)[13,15]、纤维素-三(4-甲基苯基甲酸酯)(Chiralcel OJ柱)[15,17]和纤维素-(3,5-二甲基苯基氨基甲酸酯)[7](Chiralcel IB-3柱)。根据前期实验室数据和文献资料,考察了Chiralcel OD柱(4.6 mm×250 mm,3 μm)、Chiralcel OJ柱(4.6 mm×250 mm,3 μm)和Chiralcel IF-3(4.6 mm×250 mm,3 μm)对苯醚甲环唑的拆分效果。结果显示,(2R,4R)-苯醚甲环唑、(2S,4S)-苯醚甲环唑、(2R,4S)-苯醚甲环唑在OJ柱上完全分不开,在OD柱上未基线分离,且用时较长(超过50 min),而在IF-3柱上,除(2R,4R)-苯醚甲环唑、(2S,4S)-苯醚甲环唑不能完全分离外,其他对映体均能实现完全分离,且用时较短。实验最终选择IF-3手性柱进行分离。
2.1.2流动相组成的优化分别配制体积比为90∶ 10、92∶ 8和95∶ 5的正己烷-乙醇3种流动相,考察了乙醇用量对分离效果的影响。4个对映体的保留时间和分离度见表1。结果表明,流动相中乙醇体积分数为10%时,洗脱速度最快;而乙醇体积分数为5%时虽分离度最好,但洗脱时间较长。为兼顾洗脱速度和分离度,选用正己烷-乙醇(92∶ 8)为流动相。
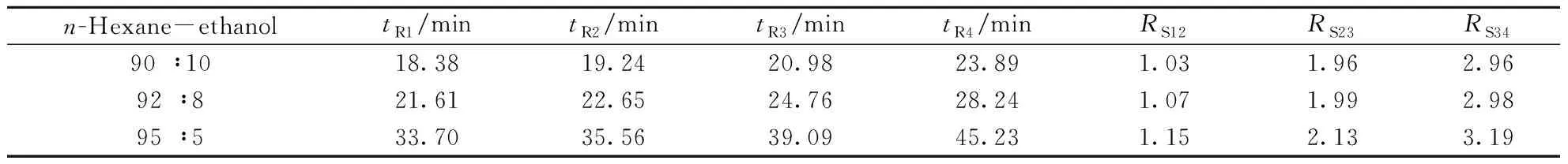
表1 不同流动相中苯醚甲环唑对映体的保留时间及分离度Table 1 Retention times and resolutions of difenoconazole enantiomers in different mobile phases
*number(1-4) denoted were(2R,4R)-difenoconazole,(2S,4S)-difenoconazole,(2R,4S)-difenoconazole and(2S,4R)-difenoconazole,respectively
2.1.3流速的选择分别考察了流动相流速为0.8、1.0、1.2、1.4 mL/min时对洗脱时间、柱前压力和分离度的影响。实验得到RS12分别为1.12、1.08、1.04、1.00,RS23分别为2.05、2.03、1.99、1.94;RS34分别为3.03、3.01、2.94、2.91。由于一针样品所需时间取决于最后一个色谱峰,因此重点考察了(2S,4R)-苯醚甲环唑的保留时间,分别为37.31、27.90、24.60、20.93 min。柱前压力分别为6.0、7.5、9.1、10.7 MPa。由于较大的柱前压力会对色谱柱耐用性造成影响。因此综合考虑分析时间、分离度和柱子损伤等因素,选择流速为1.0 mL/min。
2.1.4进样量的选择分别考察了进样量为20、30、40、50、60、70、80 μL时对分离效果的影响。结果显示,4个对映体的响应值均随进样量的增大而增加,但分离度逐渐减小。综合考虑响应值和前两个对映体间的分离度,同时避免样品量增加对色谱的污染,实验最终选择进样量为60 μL。
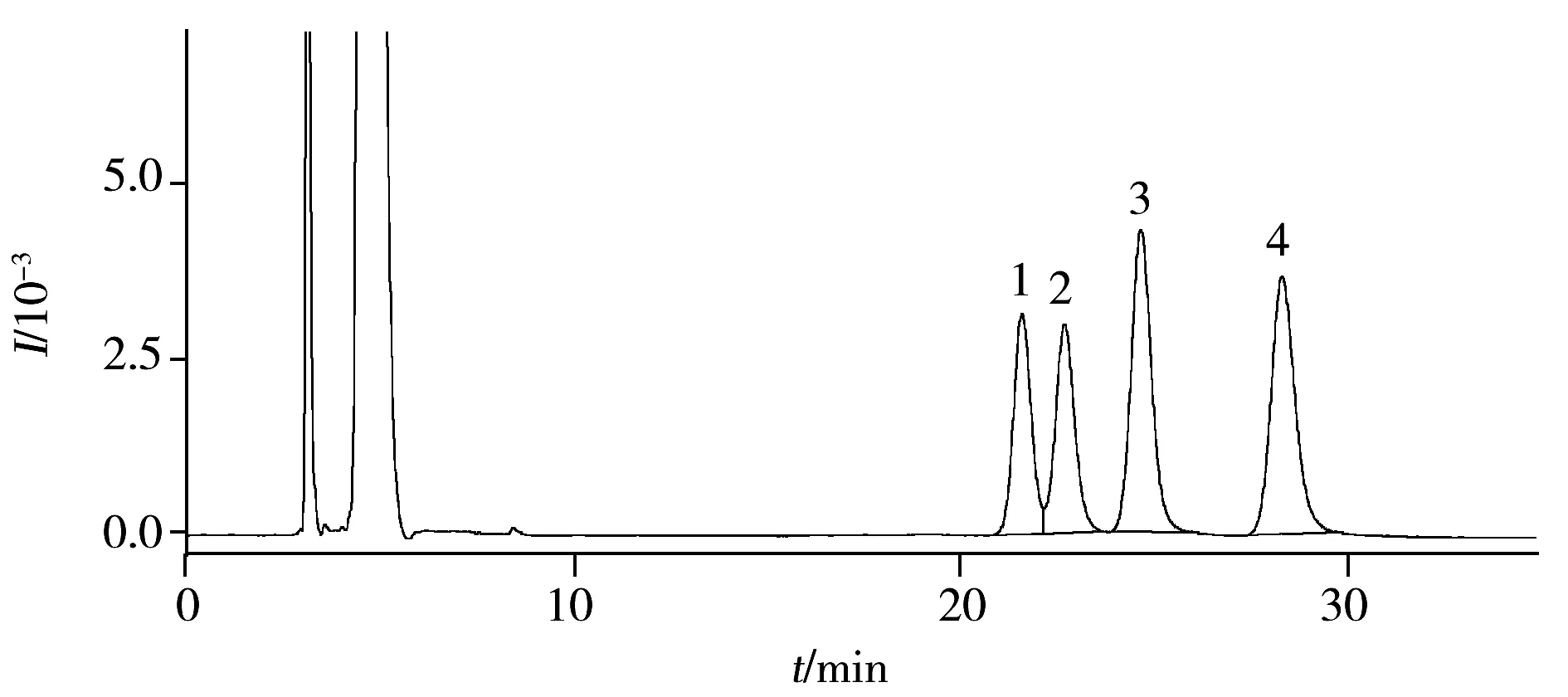
图2 外消旋苯醚甲环唑标准溶液的色谱图Fig.2 Chromatogram of difenoconazole enantiomers peak number(1-4) were(2R,4R)-difenoconazole,(2S,4S)- difenoconazole,(2R,4S)-difenoconazole and (2S,4R)-difenoconazole,respectively
综上,确定优化后的手性分离色谱条件为:手性色谱柱Chiralcel IF-3(4.6 mm×250 mm,3 μm),流动相为正己烷-乙醇(92∶ 8),流速为1.0 mL/min,进样量为60 μL。在优化色谱条件下对苯醚甲环唑对映体进行拆分,可在35 min内实现基线分离(图2)。
2.2 溶剂效应的考察
前期实验发现,不同氮吹浓缩程度的上机液出峰质量存在明显差别,因此考察了乙腈和正己烷分别作为复溶溶剂时对出峰质量的影响。结果表明,当乙腈作为复溶溶剂时,对检测信号干扰较大,基线明显不稳定,且苯醚甲环唑4个对映体的峰形展宽变差,前2个对映体不能完全分离;而正己烷作为复溶溶剂时基线平稳,杂峰较少,苯醚甲环唑4个对映体的峰形对称尖锐,基本全部分离。因此,样品检测时需严格控制氮吹浓缩过程,以避免乙腈残留对出峰质量的影响。
2.3 基质作用的考察
前期实验结果显示,基质标准中苯醚甲环唑对映体(10 mg/L)的峰形明显好于试剂标准,因此对不同浓度标准溶液的基质作用进行了考察,试剂标准和基质标准溶液按“1.2.2”配制。结果显示,当质量浓度较低时,试剂标准和基质标准中苯醚甲环唑4个对映体的峰形和峰面积基本相同;当试剂标准质量浓度增至20 mg/L时,柱子过载造成峰形变差,4个对映体无法分开,而基质标准溶液质量浓度即便增至40 mg/L,4个对映体仍能基本全部分离,且峰形对称尖锐。因此在样品测定时选择基质标准溶液进行校准定量,以确保结果的准确性。
2.4 基质标准曲线的绘制
用空白样品提取液适当稀释外消旋苯醚甲环唑储备液,使其质量浓度分别为0.40、1.0、4.0、10、40 mg/L,由于外消旋苯醚甲环唑标准溶液中4个对映体含量相同,各对映体的质量浓度分别为0.10、0.25、1.0、2.5、10 mg/L。将基质标准溶液按优化的色谱条件进行液相色谱分离测定。以峰面积(y)为纵坐标,苯醚甲环唑对映体的质量浓度(x,mg/L)为横坐标,绘制标准曲线。经4个对映体单个标准溶液分别上机测定比对,确认出峰先后顺序为:(2R,4R)-苯醚甲环唑、(2S,4S)-苯醚甲环唑、(2R,4S)-苯醚甲环唑、(2S,4R)-苯醚甲环唑。回归方程分别为:(2R,4R)-苯醚甲环唑:y1=50 198x1+37 324,r1=0.999 5;(2S,4S)-苯醚甲环唑:y2=53 528x2+9 923,r2=0.999 5;(2R,4S)-苯醚甲环唑:y3=84 607x3+114 966,r3=0.998 7;(2S,4R)-苯醚甲环唑:y4=81 929x4+31 206,r4=0.999 4。
上述结果表明,苯醚甲环唑对映体在0.10~10 mg/L范围内线性关系良好。按3倍信噪比(S/N=3)确定单个对映体的检出限为0.025 mg/L。

表2 火龙果样品中苯醚甲环唑的平均回收率与相对标准偏差(n=4)Table 2 Average recoveries and relative standard deviations for difenoconazole in dragon fruit sample(n=4)
2.5 回收率实验
分别称取10.00 g火龙果样品3份,其中1份做空白,另2份添加不同量的苯醚甲环唑标准品,按“1.2.3”方法进行前处理后测定,平均回收率和相对标准偏差(RSD)见表2。以加标样品信噪比S/N≥10时空白样品的加标浓度确定方法的定量下限(LOQ),得到LOQ为0.10 mg·kg-1(见表2)。结果显示,该方法回收率较好,在0.4、2.8 mg/kg加标水平下,4个对映体的平均回收率分别为83.7%~99.3%和86.4%~91.6%,RSD分别为1.3%~7.2%和1.4%~3.1%。火龙果样品空白和添加外消旋苯醚甲环唑标准溶液后的色谱图见图3。

3 结 论
本文利用直链淀粉-三(3-氯-4-甲基苯基氨基甲酸酯)键合手性柱(IF-3)实现了对手性农药苯醚甲环唑对映体的拆分。通过优化分离条件,成功拆分了苯醚甲环唑4个对映体,并建立了快速测定火龙果中苯醚甲环唑对映体残留量的新方法。该方法分离时间较短,分离效果好,灵敏度高,适用于火龙果等水果中手性农药苯醚甲环唑含量的测定。

