液相色谱-串联质谱联用技术检测人尿中去氨加压素及其在人尿中的消除研究
闫 宽,董 颖,徐友宣,马艳华,张力思,杨志勇,冯飞飞
(国家体育总局反兴奋剂中心,北京 100029)

图1 去氨加压素的分子结构式(MW=1 068.426 4)Fig.1 Molecular structural formula of desmopressin(MW=1 068.426 4)
去氨加压素(1-Desamino-8-D-arginine-vasopressin)是人工合成的精加压素(Vasopressin)类似物,其结构是将精加压素1位的半胱氨酸以及8位的L-精氨酸分别换成β-巯基丙酸和D-精氨酸(图1)。该药物临床常用于中枢性尿崩症、遗尿症、术中止血、预防出血及某些出血性疾病的治疗,其主要原理为拮抗肾脏集尿管中的V2受体,增加细胞水分的再吸收以达到抗利尿的作用。由于其对血液具有一定的稀释作用,世界反兴奋剂机构(简称WADA)于2012年将去氨加压素列入禁用清单中的掩蔽剂类禁用物质[1-5]。
由于去氨加压素为小肽类药物,且易溶于水,因此无法使用液-液萃取等常规前处理方式,直接进样的检测方法又暂时无法达到WADA对该药物的检测限,因此检测去氨加压素的前处理方式只能使用固相萃取[6-8]。固相萃取是世界各国实验室对于小肽类药物检测的主流方法,但文献报道的前处理步骤较复杂且检测仪器价格昂贵[9-11]。Esposito等[10-11]采用去脂、过夜冷冻干燥等前处理手段降低尿液带来的基质干扰,提高去氨加压素的分辨率,并使用了热电公司的QE仪器确保灵敏度在pg/mL级别,该方法灵敏度很高,适合小批量样品的定性定量,但无法实现短时间内大批量样品的检测,且仪器昂贵。国内尚无从人尿液中检测该药物的报道[12-13]。因此建立一种快速、价廉、高通量检测该药物的方法十分必要。同时文献中提到可在3种服药方式(口服、注射、鼻内)后2 h的尿液样品中检出去氨加压素原型,但也仅限对受试后留取的样品进行定性实验,且国内外暂无对服用去氨加压素后体内消除情况的报道[12-13]。因此,检测并研究志愿者受试后留取的尿液样本,可以明确该药物的检测窗口期,为兴奋剂检测工作提供一定的参考信息。
本文在前人研究的基础上,对样品前处理进行了改进,减少了前处理时间,实验得到的检出限能够达到WADA对于实验室检测的技术要求,可在不漏检的情况下提高工作效率。首次完成了受试后较长时间内阳性样品的检测,将可检测窗口期增至10 h左右,最高可达到13 h,增强了实际检测的效果和必要性,并可为兴奋剂检查工作提供一定依据和帮助,同时采用LC-MS/MS检测并绘制了去氨加压素代谢产物在人体内的代谢曲线,加深了对去氨加压素在体内代谢和消除的理解。
1 实验部分
1.1 仪器与试剂
Agilent1290/6460C液相色谱-串联四极杆质谱仪(美国安捷伦科技公司);GENIE VORTEX-2 旋涡混合器(美国Scientific Industries公司);Mettler PM200电子天平(感量0.001 g,德国IKA公司);Milli-Q 超纯水系统(美国Millipore公司);TECHNE(Dri-Block DB-3D)氮气干燥仪(英国Bibby公司)。
甲醇(美国Fisher Scientific公司),异丙醇、甲酸、乙腈、甲基叔丁基醚(美国Dikma科技有限公司),甲酸铵(瑞士Fluka分析试剂公司),乙酸乙酯(国药集团化学试剂有限公司),上述试剂均为色谱纯;氨水(北京化工厂)、磷酸二氢钠、十二水合磷酸氢二钠(分析纯,国药集团化学试剂有限公司)。液相色谱柱:Onyx Monolothic C18(100 mm× 2.0 mm,美国Phenomenex公司);固相萃取柱:Sep-Pak Vac 6cc C18-500 mg(Waters中国有限公司);尖底进样瓶(美国Wheaton公司);螺口进样瓶、螺口瓶盖、钳口进样瓶、钳口瓶盖(美国安捷伦仪器公司);2 mL及 5 mL 低吸附试管(德国Eppendorf公司)。
采用内标法进行定量。去氨加压素的标准品与用作内标的去氨加压素类似物(DEAMINO-CYS1,VAL4,D-ARG8)-VASOPRESSIN均购自西格玛奥德里奇(上海)贸易有限公司,纯度≥98%。
用于志愿者受试的药品名为醋酸去氨加压素片,为辉凌(瑞士)制药有限公司产品。
1.2 实验方法
1.2.1样品前处理使用3 mL甲醇对C18固相萃取柱进行活化后,加入2 mL磷酸盐缓冲液(用氨水调至pH 8.5)进行淋洗,将2 mL待测尿样加入SPE柱,控制载样流速小于1 mL/min,待样品过柱充分后用3 mL纯水对SPE柱进行淋洗,随后用3 mL体积比为80∶ 20的乙腈-乙酸乙酯(含5%甲酸)混合溶液洗脱,尽量吹干固相萃取柱并收集洗脱液,将洗脱液经氮气吹干(40 ℃)后,加入初始流动相并定容至200 μL,采用LC-MS/MS进行分析。由于去氨加压素为小肽类物质,在前处理过程中用低吸附试管以降低对该物质回收率的影响。
1.2.2色谱条件色谱柱:Phenomenex Onyx Monolothic C18(100 mm× 2.0 mm);流动相:A为10 mmol/L甲酸铵水溶液(用甲酸调至pH 3.5),B为乙腈。洗脱梯度:0~10 min,10%~90% B,10~12 min,90%B;平衡时间:3 min。流速:0.4 mL/min;柱温:40 ℃;进样量:10 μL。
1.2.3质谱条件离子源:电喷雾离子源;离子采集模式:正离子;毛细管电压:4 000 V;干燥气温度:350 ℃;干燥气流量:10 L/min;雾化气压力:20 psi;鞘气温度:400 ℃;鞘气流量:12 L/min。
1.3 去氨加压素的代谢实验
8名健康志愿者(4男4女),年龄在23~25岁之间。留取空白尿后,服用0.2 mg醋酸去氨加压素片,留取受试后第1 d的全部尿样,及后3 d每隔12 h采集1次的阳性尿样。所有尿样均立刻于-20 ℃冰箱中冷冻保存。使用优化后的前处理方法对尿样进行处理后上机检测,基于实验结果绘制原型物质代谢的曲线图,以确定该物质的检测窗口期。
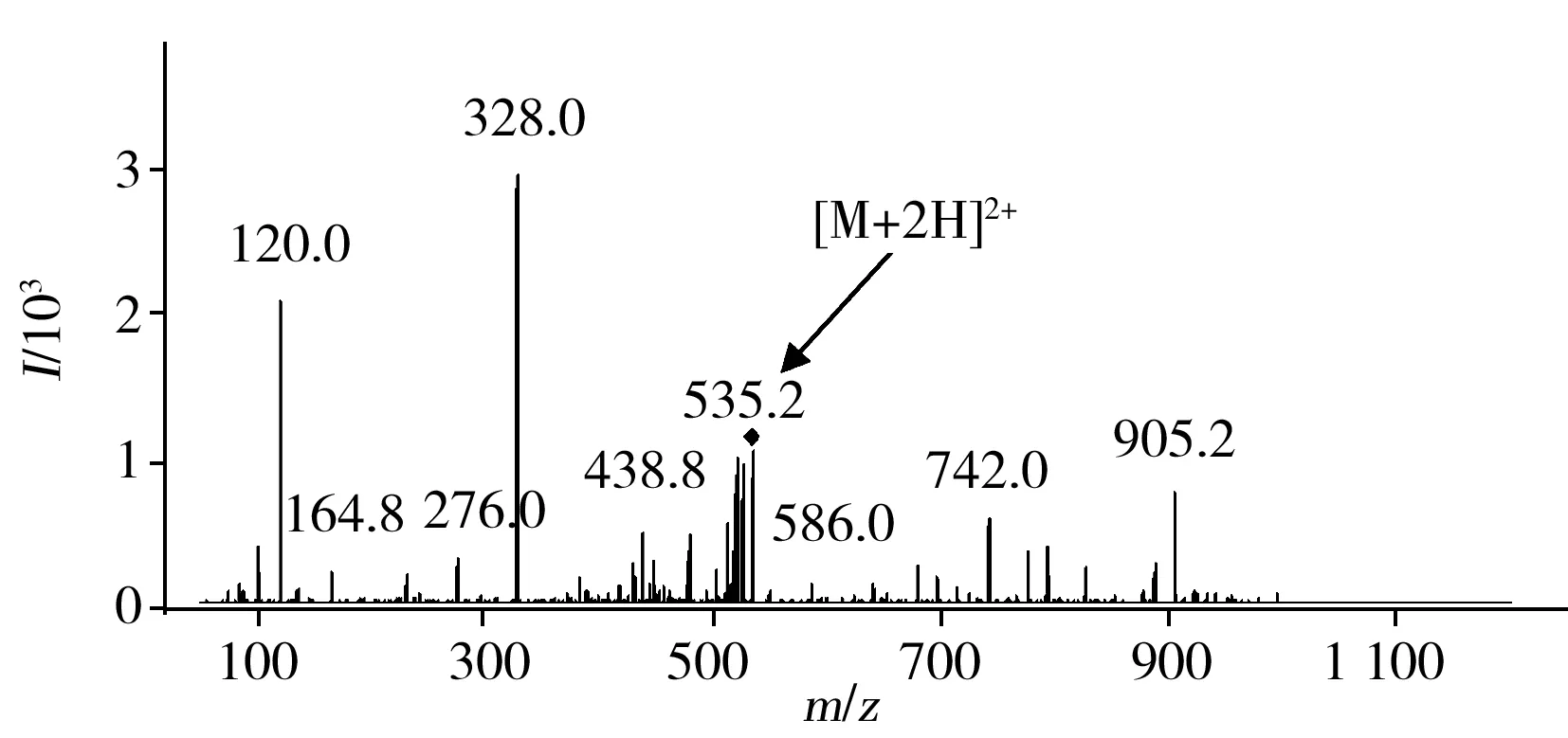
图2 去氨加压素的子离子扫描图Fig.2 The product ion scan result of desmopressin
2 结果与讨论
2.1 质谱条件的优化
根据化合物结构,选用ESI+电离模式对母离子进行全扫描,确定母离子,去氨加压素由于其小肽的结构,更易产生双电荷离子[M+2H]2+。使用SIM模式优化加速电压以保证母离子的传输效率,使用子离子扫描模式打碎母离子,寻找合适的子离子碎片(图2)。经过裂解规律的分析,选择碎片m/z328.0、120.0为子离子,与文献报道一致[9]。最后,使用MRM模式对选择的诊断离子对进行碰撞能优化。表1为优化后的质谱参数。

表1 去氨加压素及内标物的质谱参数Table 1 Mass parameters of desmopressin and IS
*quantitative ion
2.2 色谱条件的优化
由于去氨加压素具有小肽类结构,且分子量大于1 000,可能导致色谱柱堵塞或快速老化,因此本实验选择分离大分子物质的专用填料一体柱Phenomenex Onyx Monolothic C18(100 mm× 2.0 mm)。相比于甲醇,有机相选择乙腈可使目标物的响应和分离效果更理想,选择pH 3.5的10 mmol/L甲酸铵水溶液为水相可提高离子化效率。实验结果表明,去氨加压素及内标物质的基线分离效果良好,峰宽均在0.2 min左右,去氨加压素的保留时间约为2.7 min,内标物的保留时间为3.3 min左右(见图3)。

2.3 前处理条件的优化
2.3.1缓冲液pH值的选择根据不同比例配制不同pH值(6.5、7.0、7.5、8.0、8.5)的缓冲液(用甲酸或氨水进行调整),并考察了不同pH值下去氨加压素的响应值(质量浓度为2 μg/L的加标尿样)。结果显示,由于去氨加压素为碱性物质,采用pH 8.5的缓冲液时,其在SPE柱上的回收效果最佳。
2.3.2洗脱液的选择在空白尿样中添加相同浓度的药物,分别以甲醇、异丙醇、乙腈、乙酸乙酯和甲基叔丁基醚等常用有机溶剂(均含体积分数为5%的甲酸)为洗脱溶剂,对比了去氨加压素在质谱中的响应强度。结果显示,以乙酸乙酯为洗脱液时,去氨加压素在质谱中的响应强度最大,回收效果最好,且信噪比最佳;乙腈的回收效果次之。将乙酸乙酯和乙腈按照一定比例混溶后作为洗脱溶剂,实验结果显示,当乙腈和乙酸乙酯的体积比为80∶ 20时(含5%甲酸)洗脱能力最好。实验进一步考察了洗脱溶剂中不同甲酸含量(0%、5%、10%、15%)的影响,结果表明,甲酸为5%时的洗脱效果最佳。因此,实验最终选择体积比为80∶ 20的乙腈-乙酸乙酯(含5%甲酸)混合溶液作为洗脱液。
2.4 线性范围及检出限
配制不同质量浓度的去氨加压素混合标准溶液(0.5、1、2、5、10、15、20 μg/L),在优化色谱条件下进行检测,以去氨加压素及内标的峰面积比(y)与质量浓度(x,μg/L)制作标准曲线,得到去氨加压素的线性方程和相关系数(r2),按照信噪比接近3计算该方法的检出限(LOD)。结果表明,去氨加压素的线性范围为0.5~20 μg/L,线性方程为y=0.002 1x-0.595 5,r2=0.997 2,检出限为0.2 μg/L。
2.5 回收率与相对标准偏差
使用10份不同空白尿样分别配制去氨加压素的加标水平为0.5、2、5 μg/L的尿样,进行日内精密度实验;再用6份不同空白尿样分别配制上述3个水平的去氨加压素加标尿样,进行日间精密度、提取回收率及基质效应实验,结果见表2。在低、中、高3个水平下的日内、日间相对标准偏差(RSD)均小于10%,提取回收率均高于59%,基质效应为83.2%~121.3%。表明实验存在一定的基质增强或抑制效应,但基本控制在±20%内,符合WADA对基质效应的一般要求,可以满足尿样中去氨加压素的检测要求。

表2 去氨加压素的相对标准偏差、回收率及基质效应Table 2 RSDs,recoveries and matrix effects of desmopressin
2.6 实际样品检测
采用本方法测定了8位志愿者受试后0~24 h内的阳性尿样,并将结果与空白尿及配制的加标样品进行对比。图4分别为添加了0.5 μg/L的对照样品、某位志愿者受试前的空白样品及其服药后2 h左右留取的阳性样品的药物检测情况。
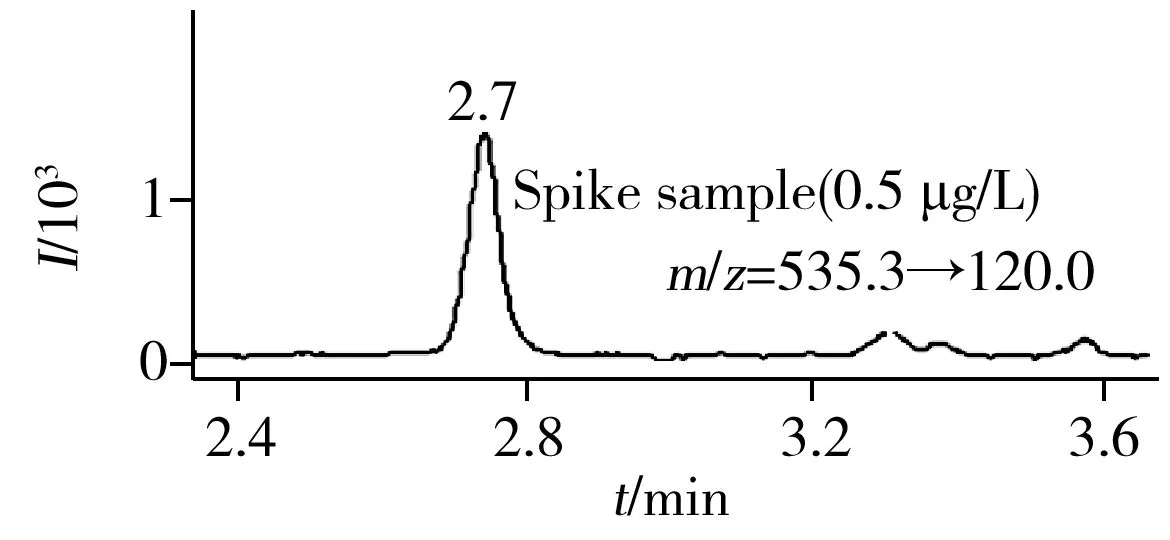
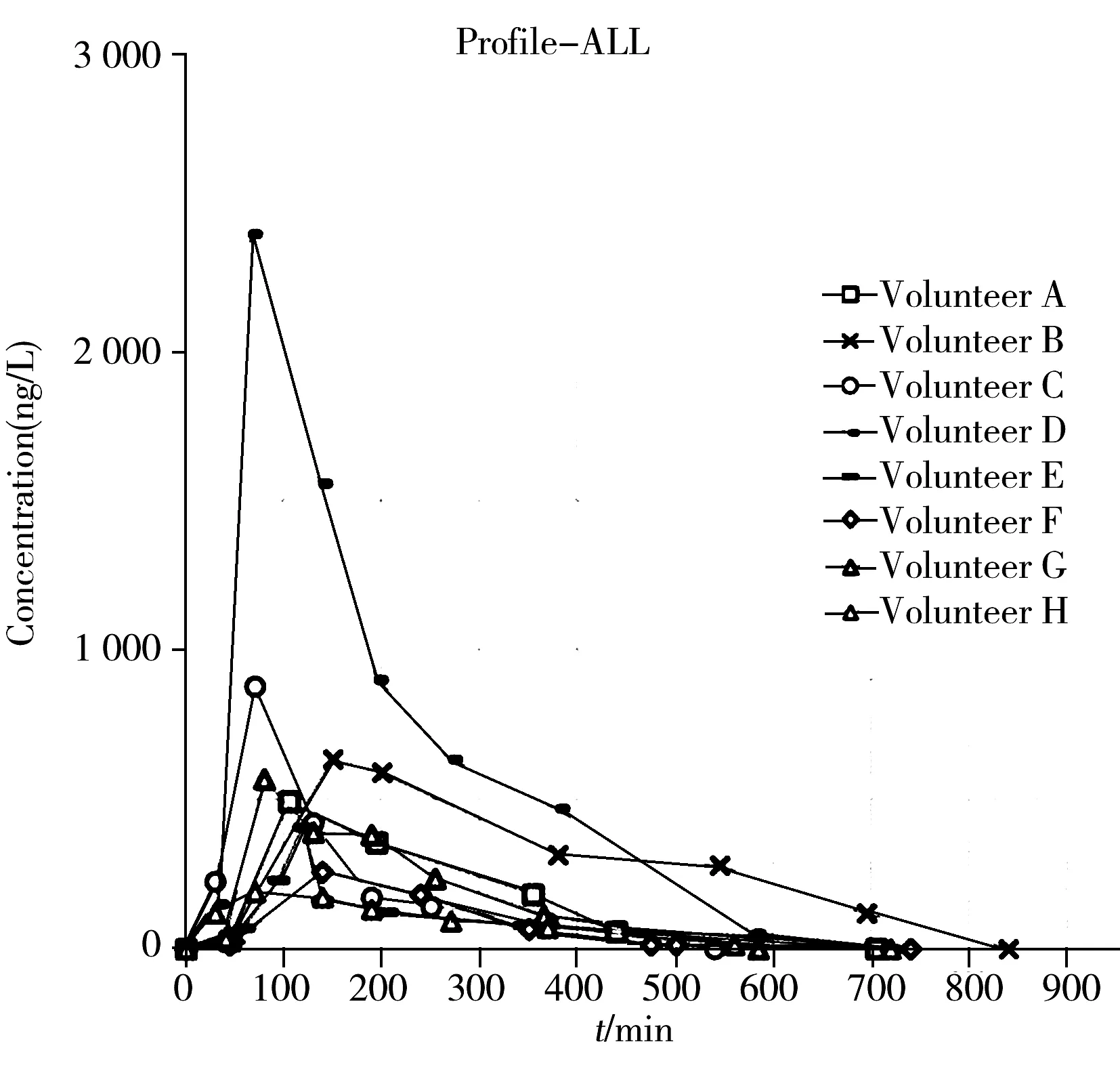
图5 志愿者服药后留取的尿样中去氨加压素的检测浓度Fig.5 Desmopressin concentration after volunteers took the drug
图5显示了8名志愿者服药前后尿样中去氨加压素原型代谢的检测浓度,最高检出质量浓度达2.4 μg/L,最长可检测时间达到服药后800 min(约13 h),去氨加压素在尿中浓度达到峰值的平均时间在服药后70~150 min。相比于已有文献报道,本研究首次采用LC-MS/MS检测人体服用去氨加压素后的原型代谢情况并绘制代谢曲线;同时明确了去氨加压素在人体内的代谢峰值时间;且相比其他报道仅在服药后120 min(2 h)收集的尿液样品中检出去氨加压素原型,本研究在服药后最长800 min之后(约13 h左右)仍可检出药物原型。详细数据见表3。
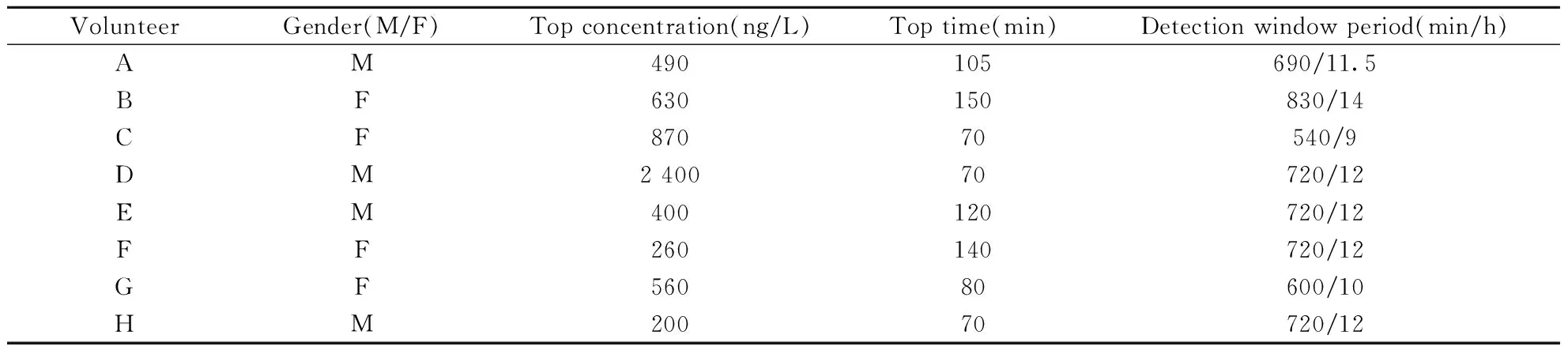
表3 8位志愿者服药后尿样中去氨加压素的检测数据Table 3 Analysis data of desmopressin from 8 volunteers positive urine
M:male;F:female
3 结 论
本研究建立并优化了对检测去氨加压素具有专属性和有效性的检测方法,在保证一定回收率,满足WADA对该物质检出限要求的同时,缩短了前处理时间。后续实验证明该方法可从阳性尿样中检测出去氨加压素,同时,根据检测多人服药后留取的阳性尿,绘制并明确了单次服用该药物在人体内的消除情况,并确定了检测窗口期。本方法简便,通用性广,检测成本低,且相比已有文献将去氨加压素的检测窗口期延长至服药后800 min,提升了检测能力,为兴奋剂检查部门提供了数据参考。

