基于离子印迹聚合物微球固相萃取/微波等离子体发射光谱法测定地表水中痕量铅
梁维新,潘佳钏,宋玉梅,郭鹏然
(广东省测试分析研究所 广东省水环境污染在线监测工程技术研究中心 广东省化学危害应急检测技术重点实验室,广东 广州 510070)
地表水中的铅主要来源于工业活动产生的废水污染、含铅燃料的废气沉降、重金属矿的开采冶炼以及含铅制品的生产使用等[1]。铅可通过污染饮用水源以及食物链富集等途径进入并在人体蓄积,导致人体神经、造血、骨骼以及消化等多个系统产生严重损伤[2-3],严重威胁人体健康。
目前铅的检测方法主要包括原子吸收光谱法(AAS)、电感耦合等离子体发射光谱法(ICP-AES)以及电感耦合等离子体质谱法(ICP-MS)等。其中AAS法需使用乙炔等易爆炸性气体,安全隐患高[4];ICP-AES法检出限高,且消耗大量价格昂贵的氩气;ICP-MS法检出限低、线性范围宽,但仪器价格昂贵,且使用氩气为工作气体,运行成本高[5]。目前商品化的微波等离子体发射光谱仪(MP-AES)可直接采用空气与氮气运行,成本低,安全性高,线性范围宽,且与ICP-OES的检测性能相近,但其对铅的检出限比生活饮用水卫生标准(GB 5749-2006)以及地表水环境质量标准(GB 3838-2002)限值高,制约了其在水中铅的分析上的应用。
离子印迹技术是一种通过合成对模板离子具有特异性识别能力的聚合物而实现萃取和目标离子富集的技术,将离子印迹技术结合固相萃取[6-8]、磁性固相微萃取[9-11]、电化学传感器[12-14]以及膜分离[15]等技术实现铅的富集和检测已多有报道。与其他富集方法相比,固相萃取法具有成本低、选择性高、富集因子高等优势[16],目前已得到了广泛应用,其富集材料大多采用本体聚合法制备,但需要破碎研磨步骤,且得到的聚合物形状不规则。皮克林乳液聚合法通过水/油两相界面的固体颗粒维持和稳定乳液结构[17],可减少对环境有害的表面活性剂的使用,且无需破碎研磨即可得到形状规则的聚合物微球,方法简便。本文通过皮克林乳液聚合法合成离子印迹微球,将铅离子印迹固相萃取技术与MP-AES联用建立了地表水中痕量铅的测定方法,并应用于实际水样的分析。
1 实验部分
1.1 仪 器
微波等离子体原子发射光谱仪(Agilent 4100 MP-AES),仪器工作条件:常规雾化进样系统(CNSI)雾化室;Concentirc nebulizer雾化器,雾化器压力为240 kPa;积分时间3 s,样品提升时间10 s,稳定时间10 s;3通道蠕动泵;背影校正Auto方式。三重四极杆电感耦合等离子体串联质谱仪(Agilent 8800),仪器工作条件:射频功率1.55 kW;雾化器:MicroMist型;等离子气流量:15.0 L/min;载气流量:0.9 L/min;辅助气流量:0.9 L/min;采样深度:8 mm;扫描方式:跳峰;氧化物比率:1.12%;双电荷比率:1.56%;内标:115In。SHA-BA型恒温水浴振荡器(常州奥华仪器有限公司);BSA224S-CW型电子分析天平(赛多利斯公司);TDL-40B型离心机(上海安亭科学仪器厂);KQ-500E型超声发生器(昆山市超声仪器有限公司);BF-2000F型氮气吹扫仪(八方世纪科技有限公司)。
1.2 试剂与材料
甲基丙烯酸(MAA)、二甲基丙烯酸乙二醇酯(EGDMA)、偶氮二异丁腈(AIBN)均购自北京市百灵威科技有限公司;聚乙二醇辛基苯基醚(TX-100)购自江苏强盛功能化学有限公司;气相二氧化硅购自德国赢创德固赛有限公司;硝酸铅购自天津市光复精细化工研究所;甲苯、甲醇、硝酸购自广州化学试剂厂;以上试剂均为分析纯,实验用水为去离子水(18.2 MΩ· cm)。
地表水样品分别采自珠江广州河段、肇庆市鼎湖山及广州市新塘饮用水源地,经0.45 μm滤膜过滤去除杂质后,常温保存备用。
1.3 铅离子印迹聚合物微球的制备
在具塞玻璃小瓶中加入0.49 g的MAA、20 mg的硝酸铅、1.51 mL的EGDMA 以及0.5 mL甲苯,混合超声3 min制备油相;将20 mg气相二氧化硅、20 mg的AIBN溶于10 mL 0.3%的TX-100溶液中,超声5 min制备水相。将油相和水相混合制备稳定的皮克林乳液。将皮克林乳液通氮气2 min后,将玻璃小瓶置于恒温油浴锅中,于70 ℃引发自由基聚合,聚合17 h后将所得固体沉淀用甲醇和高纯水反复浸泡清洗以除去可溶性物质,再加入30 mL的10%氢氟酸浸泡6 h以除去微球表面的二氧化硅,最后以10%硝酸通过索氏提取法去除离子印迹微球中的Pb2+,清洗并干燥,即得IIPMs固体微粒,合成方法原理如图1所示。
非离子印迹微球(NIPMs)的制备方法与IIPMs的制备方法类似,但在合成过程不加入硝酸铅。

图1 皮克林乳液聚合法合成IIPMsFig.1 Preparation of IIPMs via Pickering emulsion polymerization
1.4 特异性吸附性能的评价
离子印迹聚合物的选择性吸附性能采用分配系数(Kd)、选择性系数(k)、相对选择性系数(k’)描述,各参数按以下公式进行计算[18]:Kd=qe/Ce;k=Kd(Pb)/Kd(x);k’=kIIPMs/kNIPMs。式中:qe为各离子的平衡吸附量(mg/g);Ce为各离子的平衡质量浓度(mg/L);Kd(Pb)为Pb2+的分配系数;Kd(x)为竞争离子的分配系数;kIIPMs为IIPMs的选择性系数;kNIPMs为NIPMs的选择性系数。
1.5 等温吸附实验

1.6 铅离子印迹聚合物的固相萃取
准确称取75 mg的IIPMs,将其填入1 mL的SPE空柱管中,上下放置筛板以防止微球泄漏,压紧筛板后即得铅离子印迹固相萃取柱。用高纯水对固相萃取柱洗涤活化后,再将一定体积的Pb2+溶液过柱,通过外加负压将柱抽至近干,用5%的HNO3溶液洗脱吸附在柱中的Pb2+,收集洗脱液,利用MP-AES法测定洗脱液中Pb2+含量,并计算加标回收率。
2 结果与讨论
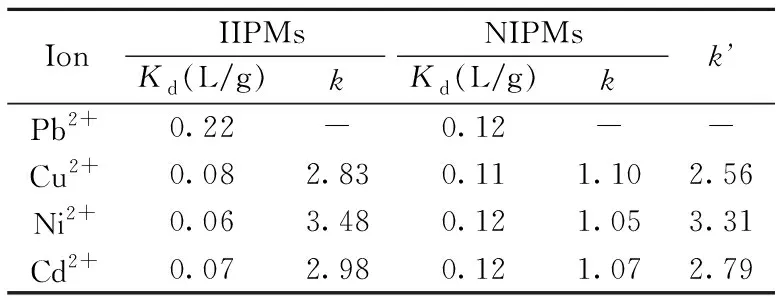
表1 IIPMs/NIPMs选择性吸附评价结果Table 1 Selective adsorption parameters of IIPMs and NIPMs
2.1 特异性吸附性能的评价
本实验选择与Pb2+有相同离子电荷和不同离子半径的Cu2+、Ni2+、Cd2+作为竞争吸附离子(半径大小Pb2+=120 pm、Cd2+=114 pm、Ni2+=69 pm、Cu2+=71 pm)[19]评价IIPMs的选择性吸附能力(表1)。结果显示,IIPMs对Pb2+的分配系数(Kd)明显高于竞争离子,是竞争吸附离子的2.8~3.5倍,表明IIPMs具有较好的特异性识别以及抗干扰能力;而相对选择性系数(k’)均在2.5以上,证明了离子印迹微球对Pb2+具有很好的选择吸附效果。
2.2 IIPMs固相萃取柱性能的评价
2.2.1吸附容量为考察吸附容量,分别将30、40、50、60、70 mL的Pb2+溶液(1.5 mg/L,pH 6.5)以0.5 mL/min的流速通过固相萃取柱,经4 mL 5%的HNO3洗脱并测定,结果表明其吸附回收率随Pb2+加入量的增大而逐渐下降,当溶液体积低于50 mL(Pb2+的加入量≤75 μg)时,吸附回收率高于90%。若以90%吸附回收率进行评估,75 mg 填料量计算,则IIPMs对Pb2+的最大吸附量为1.0 mg/g,此结果与等温吸附结果接近(见表2中qm)。同时考察了在高富集流速下IIPMs固相萃取柱对Pb2+的吸附情况,分别将20、40、60、80、100 mL的Pb2+溶液(20 μg/L,pH 6.5)以5 mL/min的流速通过固相萃取柱,实验结果显示,当样品加入量在60 mL以内(Pb2+的加入量≤1.2 μg),以4 mL 5%的HNO3洗脱时,回收率均高于90%,故后续实验控制Pb2+的加入量在1.2 μg以下,为兼顾最大富集倍数和仪器进样量要求,后续实验选择洗脱体积为4 mL。

表2 IIPMs/NIPMs对Pb2+的等温吸附拟合结果Table 2 Fitting results of isothermal adsorption of Pb2+adsorbed by IIPMs and NIPMs
2.2.2溶液pH值对萃取性能的影响采用IIPMs固相萃取柱以5 mL/min的流速分别对25 mL 20 μg/L的Pb2+溶液进行富集,然后用4 mL 5%HNO3洗脱,考察溶液pH值对富集效果的影响,结果表明,当溶液的pH值为3.0、4.0、5.0、6.0、7.0时,Pb2+的回收率分别为86.1%、91.9%、93.6%、104%和104%。这是由于低pH值溶液中大量的H+与Pb2+产生竞争吸附作用[20]而降低了富集效果,因此,IIPMs固相萃取柱在弱酸性或中性溶液中对Pb2+的富集效果最佳。
2.2.3溶液浓度对回收率的影响采用IIPMs固相萃取柱以5 mL/min的流速对25 mL不同质量浓度的Pb2+溶液进行富集,然后用4 mL 5%HNO3洗脱,以考察Pb2+浓度对富集效果的影响。结果显示,当Pb2+的质量浓度为10、20、30、40 μg/L时,回收率分别为94.4%、101%、99.9%和101%,说明IIPMs固相萃取柱对不同浓度的Pb2+均具有良好的吸附效果。
2.2.4富集倍数将一系列1 μg/L的Pb2+溶液(pH 6.5)以5 mL/min的流速通过固相萃取柱,当溶液体积在1 000 mL以内时,吸附回收率高于90%,继续增大溶液体积,吸附回收率则出现明显下降,因此以4 mL洗脱液计算,IIPMs的最大富集倍数为250倍。由于富集溶液体积较大会导致富集时间过长,以最低富集溶液质量浓度(1 μg/L)计算,当富集倍数为25倍时,已达到MP-AES的定量下限20 μg/L(以5%HNO3为空白样品,MP-AES连续测定11次,按10倍标准偏差计算),因此后续实验选择富集倍数为25倍。
2.2.5重复利用性能按照固相萃取程序对同一根IIPMs固相萃取柱进行吸附和洗脱操作,经重复使用12次后,IIPMs固相萃取柱对Pb2+仍具有良好的吸附和洗脱能力,加标回收率均在93%以上,表明IIPMs固相萃取柱的重复利用性能良好。
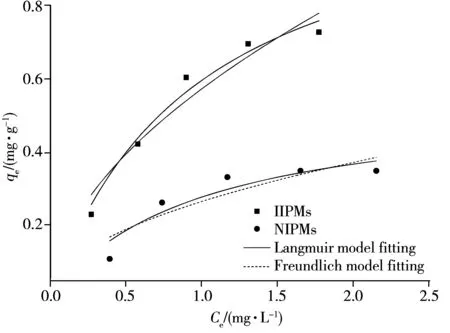
图2 等温吸附拟合曲线Fig.2 Curves of isothermal adsorption fitting
2.3 等温吸附及形貌表征
按照“1.5”方法进行等温吸附试验,据表2和图2可知,IIPMs吸附Pb2+的过程符合Langmuir等温吸附模型,拟合优度(r2=0.969 7),属于单分子层吸附,通过拟合计算得到最大单层饱和吸附容量为1.20 mg/L。IIPMs对Pb2+的吸附能力均明显强于NIPMs,这可能是由于在合成过程中引入了铅离子的IIPMs较NIPMs具有更小粒径(IIPMs=26.6 μm,NIPMs=35.2 μm)以及更多孔的表面(图3A、B),有利于增大微球的比表面积,从而提升其吸附能力。
2.4 线性范围、方法精密度及检出限
以5%HNO3配制一系列不同质量浓度的Pb2+标准溶液并绘制标准曲线,结果显示,Pb2+在0.02~1 mg/L范围内线性良好,相关系数(r)为0.999 6。在最优固相萃取条件下(富集体积100 mL,洗脱体积4 mL,pH 6.5),以1 μg/L和10 μg/L去离子水介质的Pb2+为富集溶液,按照固相萃取程序平行实验8次并进行测定,相对标准偏差(RSD)分别为5.2%和2.4%,表明该方法具有良好的精密度。由于MP-AES对Pb2+的动态线性范围可达4~5个数量级,洗脱后高、低浓度的样品均可直接进样分析。以去离子水为样品,按照3倍空白标准偏差(σ)所对应的质量浓度以及富集倍数计算得方法的检出限为0.26 μg/L,其灵敏度可满足生活饮用水卫生标准(GB 5749-2006)以及地表水环境质量标准(GB 3838-2002)的测定要求。

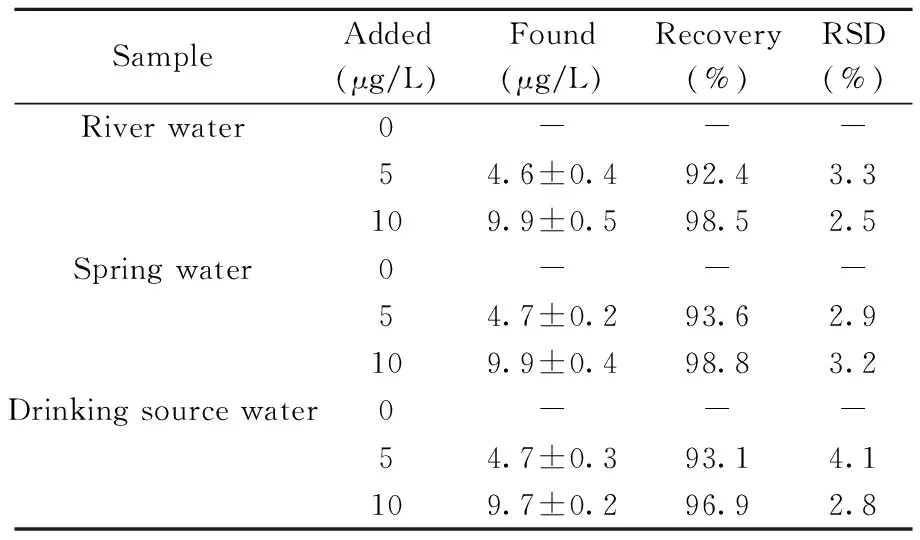
SampleAdded(μg/L)Found(μg/L)Recovery(%)RSD(%)River water0---54.6±0.492.43.3109.9±0.598.52.5Spring water0---54.7±0.293.62.9109.9±0.498.83.2Drinking source water0---54.7±0.393.14.1109.7±0.296.92.8
-:no detected
2.5 实际地表水样的测定
在最优固相萃取条件下(富集溶液体积100 mL,洗脱溶液体积4 mL),采用本方法与直接进样ICP-MS法对实际水样进行测定,两种方法在地表水样品中均未检出Pb2+;采用本方法测定地表水样品的加标回收率为92.4%~98.8%,相对标准偏差不大于4.1%(表3)。表明该方法具有良好的准确度和精密度,可用于地表水中痕量铅的检测。本研究丰富了MP-AES技术的应用范围。
3 结 论
本文以皮克林乳液聚合法制备了铅离子印迹微球(IIPMs),并将铅离子印迹固相萃取技术与微波等离子体发射光谱法联用,建立了地表水中痕量Pb2+的离子印迹固相萃取/微波等离子体发射光谱测定方法。样品富集后以5%HNO3洗脱,可直接进行MP-AES分析测定。固相萃取的最大富集倍数为250倍,富集时间为30~40 min。该方法的成本低,精密度良好,检出限低,满足生活饮用水卫生标准及地表水环境质量标准的要求。

