高浓度二氧化碳气调包装通过调节酚代谢抑制鲜切莲藕的酶促褐变
谢君,代钰,王宏勋,3,易阳,3,侯温甫,3,艾有伟,闵婷
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023)(2.武汉食品化妆品检验所,湖北武汉 430023)(3.湖北省生鲜食品工程技术研究中心,湖北武汉 430023)
莲藕(NelumbonuciferaG.)广泛种植在中国,是全球最受欢迎的蔬菜之一[1~3]。近来,随着消费者生活方式的改变,鲜切莲藕作为新型加工蔬菜受到越来越多的关注[4,5]。然而,鲜切产品质量下降的主要挑战是酶促褐变,酶促褐变会影响感官和质量,并限制了鲜切莲藕的保质期[6~8]。因此,了解如何延缓和防止酶促褐变是延长鲜切莲藕贮藏寿命的重要途径。
目前延缓鲜切果蔬褐变方法报道很多,包括化学处理,如有机酸[9,10],亚硫酸盐[11],过氧化氢[12]和电解水[13],24-表油菜素内酯[14]和物理处理,如气调包装[15],热处理[16]和低温储藏等[17]。其中气调包装在保持果蔬天然质量和延长保质期效果明显[18~21],特别是高浓度的CO2MAP[8,22]。据报道,100% CO2MAP结合抗褐变处理和热处理延长鲜切莲藕保质期效果良好[8]。邢等[23]的研究结果表明,化学浸渍,肉桂油熏蒸和中度真空包装显著降低了鲜切莲藕褐变。
莲藕的褐变诱因主要表现为酶促褐变[24]。其中PAL是苯丙烷类物质代谢中第一个关键酶,负责合成酚类、木质素和花青素的前体物质,其中形成的酚为果蔬酶促褐变反应提供底物[25],PAL基因参与鲜切果蔬的褐变已有报道。PPO是植物体内普遍存在的一种氧化还原酶,是引起果蔬酶促褐变最关键的酚酶之一[26],PPO作为果蔬酶促褐变最关键基因已在较多果蔬中被分离鉴定,包括甘薯和荔枝等。POD是广泛存在于植物中的一种氧化还原酶,在H2O2存在的情况下,能将酚类物质和类黄酮氧化聚合形成褐色物质参与果蔬酶促褐变[27]。Xu等研究发现蝴蝶兰中PhPOD基因上调是导致其组织培养中外植体褐变的主要原因[28]。由此可见,PAL、PPO和POD可能在果蔬褐变中起着重要作用。
前人研究报道了PAL,PPO和POD基因参与果蔬褐变[15,29]。我们前期研究结果表明NnPAL1,NnPPOA,NnPOD1-6是高温诱导下鲜切莲藕褐变的候选基因[17]。然而,高浓度CO2MAP对鲜切莲藕PAL,PPO和POD酶及其编码基因的影响鲜有报道。为了进一步阐明高浓度CO2MAP抑制鲜切莲藕酶促褐变的机理,本研究采用高浓度CO2MAP对鲜切莲藕在贮藏过程中褐变度,总酚含量,PAL,PPO和POD酶活性及基因进行了研究。
1 材料与方法
1.1 材料与试剂
新鲜莲藕(鄂莲五号),采于武汉汉口北四季美农贸批发市场。
磷酸二氢钠、磷酸氢二钠、乙醇、福林酚、无水碳酸钠、没食子酸、邻苯二酚、愈创木酚、H2O2、聚乙二醇6000、聚乙烯吡咯烷酮,国药集团化学试剂有限公司;Trition X-100,biosharp生物科技有限公司;苯丙氨酸解氨酶测定试剂盒,南京建成科技有限公司。
1.2 仪器与设备
CP214(C)型电子天平,上海奥豪斯仪器有限公司;V-1100D紫外分光光度计,上海美普达仪器有限公司;GL-20G-Ⅱ离心机,上海安亭科学仪器厂;IMS-20雪科制冰机,常熟市雪科电器有限公司;XHF-D高速分散器,宁波新芝生物科技股份有限公司;HH-S2数显恒温水浴锅,金坛市医疗仪器厂;DHG-9123A电热鼓风干燥箱、DHP-9082型电热恒温培养箱,上海恒一科学仪器有限公司;HYC-326A医用冷藏箱,青岛海尔特种电器有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;A360型紫外可见分光光度计,翱艺仪器(上海)有限公司;气调包装机成套设备,上海福帝包装机械有限公司;FHW-450型保鲜膜封接机,浙江江南实业有限公司;MIR-154型低温贮藏箱,日本三洋。DYCP-31DN电泳仪,北京市六一仪器厂;SW-CJ-2FD型双人单面净化工作台,苏州净化;T100 TM Thermal Cycler PCR仪,美国伯乐;CFX96荧光PCR仪,美国伯乐;凝胶成像系统,美国伯乐。
1.3 方法
1.3.1 原料预处理
莲藕(鄂莲五号)从商业池塘(汉口北,武汉)购买,然后运送到实验室。莲藕的尺寸和地面颜色均匀,并且没有缺陷和机械损伤。处理前,莲藕在4 ℃保存24 h。用自来水冲洗莲藕以除去土壤并去皮。然后使用锋利的不锈钢刀将它们沿着莲藕的横截面切成5 mm厚的切片。转入清水中浸泡2 min后,将这些鲜切莲藕切片用滤纸吸干水分,进行不同 MAP(100%CO2和空气),每盒两片,分别转入冰箱(4 ℃,20 ℃)中。
所有处理均进行三次重复。样品在液氮中冷冻,储存于-80 ℃进一步使用。
1.3.2 褐变度的测定
参考以前的文献测定褐变度[17],4 ℃下,用30 mL蒸馏水将3.0 g肉组织匀浆,在4 ℃下以10,000 g离心5 min。收集上清液,在25 ℃水浴中保温5 min。使用分光光度计在 410 nm测量吸光度,褐变度表示为A410×10。
《论语》中的恕和忠关系紧密,常以忠恕并提或并列。忠恕的目的是仁,是仁的内容,行恕的目的是体现忠。《论语》指出:“子曰:‘参乎!吾道一以贯之’。曾子曰:‘唯’。子出,门人问曰:‘何谓也?’曾子曰:‘夫子之道忠恕而已矣’。”其意是指,孔子讲:“曾参呀!我的学说贯穿着一个基本思想。”曾子说:“是的。”孔子走了出去,别的学生问道:“这是什么意思呢?”曾子说:“先生的学说就是忠和恕罢了。”很清楚,忠恕已成为《论语》道德准则的核心内容。
1.3.3 总酚含量的测定
参考以前的文献测定总酚含量[17],将3.0 g新鲜的肉组织样品用30 mL的60%乙醇匀浆,并以10,000 r/min离心5 min。将上清液(10 mL)用40 mL 60%乙醇稀释以进行下一次测量。将0.125 mL溶液和0.625 mL蒸馏水混合,然后加入0.125 mL福林酚试剂。充分混合后,将混合物在室温下静置3 min,然后加1.25 mL 7%NaCO3和1.0 mL蒸馏水H2O。在25 ℃水浴中避光静置90 min后,使用分光光度计测量在760 nm处的吸光度。使用没食子酸的标准曲线来量化总酚含量。结果表示为没食子酸当量/kg鲜重(mg/kg)。
1.3.4 PAL、PPO和POD酶活性的测定
PAL、PPO和POD酶的提取和活性测定按照以前的文献所述进行[17]。通过分光光度法将PAL酶活性单位(U)定义为每克鲜重每分钟吸光度值在290 nm变化0.1所需的酶量。一个单位(U)的PPO活性被定义为在420 nm处每分钟引起吸光度改变0.001所需的酶量。用分光光度法将POD酶活性单位(U)定义为在470 nm每分钟引起吸光度改变0.01所需的酶量。
1.3.5 RNA提取和CDNA合成
根据以前的文献制备总 RNA。TURBO Dnase(Ambion)被用于去除总RNA中污染的基因组DNA的痕迹。用iScript cDNA合成试剂盒(Bio-Rad)进行cDNA合成[30]。
1.3.6 实时定量PCR
Min等文献描述了用于 PCR分析的寡核苷酸引物。根据以前的文献使用SsofastEvaGreenSupermix试剂盒(Bio-Rad)和CFX96荧光PCR进行实时PCR以进行基因表达研究[17]。
1.3.7 数据分析
使用Origin 8.0软件绘制图片;使用DPS7.05软件进行最小显著性差异(LSD)分析。
2 结果与分析
2.1 褐变度
不同的MAP(100% CO2和空气)用于鲜切莲藕切片贮藏研究。研究结果表明两种MAP在整个储存期间促进了不同程度的褐变(图1)。相比于对照,100%CO2MAP鲜切莲藕的褐变明显延缓,褐变度(BD)仅从0.260增加到0.346,而在贮藏35 d后的空气对照中,褐变程度(BD)到0.460。
BD作为果蔬褐变的主要指标用于评价其褐变情况。通过测定褐变度发现100%CO2MAP的褐变度值明显低于对照。因此,这一结果进一步证明了高浓度CO2能有效延缓鲜切莲藕褐变进程[8]。
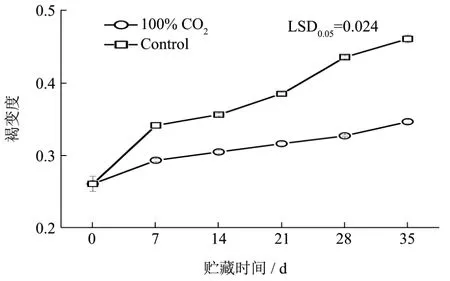
图1 不同气调包装4 ℃贮藏鲜切莲藕褐变度Fig.1 BD value of modified atmosphere packaging fresh-cut lotus roots in 4 ℃
2.2 总酚含量
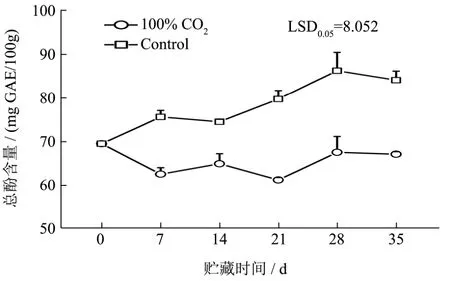
图2 不同气调包装4 ℃贮藏鲜切莲藕总酚含量Fig.2 Total phenol content of modified atmosphere packaging fresh-cut lotus roots in 4 ℃
如图2所示不同的MAP对贮藏期间鲜切莲藕总酚含量的影响明显不同。100%CO2MAP的样品中总酚含量没有明显变化,从第0 d的69.491 mg/kg到第35 d的67.101 mg/kg。但是空气组增长较快,从第0 d的69.491 mg/kg增加到第35 d的84.050 mg/kg。结果表明,高浓度的CO2MAP在贮藏期间延缓了总酚含量的增加,这与前期研究结果相一致[17]。
2.3 PAL、PPO和POD活性
如图3所示,贮藏期间两种不同MAP对PAL、PPO和 POD酶活性的影响均明显不同。两种不同MAP样品的PAL活性显示出不同程度的增加,从初始值为 5.363 U/g至第 35 d分别为 100%CO2组的11.418 U/g和空气组的 17.473 U/g。其中100%CO2MAP的样品PAL活性显示较慢的增长。

图3 不同气调包装4 ℃贮藏鲜切莲藕PAL、PPO和POD酶活性Fig.3 PAL, PPO and POD avtivity of modified atmosphere packaging fresh-cut lotus roots in 4 ℃
与PAL类似,两种不同MAP中样品的PPO活性显示不同程度的增加,从初始值为0.611 U/g至第35 d分别为 100%CO2组的 0.833 U/g和空气组的 1.311 U/g。在整个贮藏期间,100%CO2组样品的PPO活性增加缓慢。100%CO2样品的POD活性显示出轻微的变化,并保持较低的值,从第0 d的0.034 U/g到第35 d的0.078 U/g。然而,空气组中的POD活性迅速增加,从0.034 U/g至第35 d的0.144 U/g。与空气组对比,在整个贮藏期间,100% CO2组样品的POD活性增加较为缓慢。
前人研究报道了PAL,PPO和POD参与了鲜切莲藕的酶促褐变[18,31]。通过分析两种不同 MAP条件下PAL,PPO和POD酶活性的变化。结果表明在100%CO2组的样品中,PAL,PPO和POD活性的与贮藏过程中鲜切莲藕的褐变程度相一致,这一结果与前人报道相一致[32~34]。然而,也有一些不同的观点,Gao等[5]人发现100% O2处理的鲜切莲藕,其PPO活性最低,其褐变抑制效果最好,这可能是由于品种的差异所致。
2.4 NnPAL、NnPPO和NnPOD基因表达



图4 不同气调包装4 ℃贮藏鲜切莲藕中NnPAL、NnPPO、NnPOD基因表达分析Fig.4 NnPAL, NnPPO and NnPOD expression patterns in response to different modified atmosphere packaging in fresh-cut lotus root
如图4所示,2个NnPAL基因对两个不同的MAP响应不一样。NnPAL1的表达对气调包装特别敏感,在整个贮藏过程中,空气组被不断诱导,在35 d达到峰值,但100%CO2组在第21 d开始下调。NnPAL2的表达较为恒定,表达量较低。
NnPPO基因表现出相似的表达模式。空气包装的鲜切莲藕的NnPPOA基因在整个贮藏期间被持续诱导,但是在贮藏后期100%CO2组的NnPPOA的表达下调。然而,在两种不同MAP之间的NnPPOC表达没有发现明显差异。
在NnPOD基因家族中,与对照相比,NnPOD2和NnPOD3的表达分别下降了30多倍和280倍,并且与酶活性的变化相一致。在两种不同的MAP样品中NnPOD1和NnPOD4的表达均呈不同程度增加,其表达水平相对低于NnPOD2和NnPOD3。相比之下,100% CO2组在整个贮藏过程中NnPOD5和NnPOD6被持续诱导。与其他NnPOD基因不同,NnPOD7的表达无显著变化。
前期研究发现NnPAL,NnPPO和NnPOD参与莲藕的褐变[17]。本研究发现 100%CO2包装的鲜切莲藕的NnPAL1,NnPPOA和NnPOD2/3比其他基因家族成员下调更明显。据报道苹果和PbPAL1,PbPAL2和PbPPO1的梨中Md-PPO参与了组织褐变,其表达模式与高浓度 CO2MAP的表达模式相似[15,35]。此外,NnPAL1,NnPPOA和NnPOD2/3的表达变化与PAL,PPO和POD酶活性的变化并行发生。然而,我们前期的研究发现在高温下NnPAL1,NnPPOA和NnPOD1-6的上调与新鲜莲藕褐变度的增加相一致[17]。综合前期报道和目前结果,NnPAL1,NnPPOA和NnPOD2/3被认为是鲜切莲藕褐变的重要候选基因,有待进一步的功能分析。
3 结论
综上所述,本研究分析了两种不同MAP对鲜切莲藕的褐变度,总酚含量,PAL,PPO和POD酶活性及其编码基因表达的影响。结果表明,100%CO2MAP对延缓鲜切莲藕褐变效果明显。PAL,PPO和POD酶活性的变化与 100%CO2MAP贮藏的褐变程度相一致。此外,NnPAL1,NnPPOA和NnPOD2/3的表达变化与PAL,PPO和POD酶活性的变化以及褐变度相一致,说明高浓度CO2MAP可能通过下调NnPAL1,NnPPOA和NnPOD2/3的表达延缓鲜切莲藕褐变进程。

