发酵大麦分离蛋白对3T3-L1细胞棕色化的影响
谷耀光,肖香,张家艳,董英
(江苏大学食品与生物工程学院,江苏镇江 212013)
肥胖及其相关的代谢综合征已成为全球面临的挑战,使人类承受着共同的压力与负担。研究发现棕色脂肪细胞可迅速将脂肪酸转化为热量从而消耗脂肪,为缓解肥胖带来的一系列健康问题提供了新的思路[1]。2009年,Cypess等已经确定成年人体内存在棕色脂肪[2],棕色脂肪被激活后通过UCP1蛋白将脂肪酸转化为热量[3]。但是在人体中,棕色脂肪组织随着年龄的增长会逐渐减少,成年以后含量极低,并且由于激活条件苛刻,其功能难以展现。近年来,不断有研究发现,在长期寒冷环境或者某些药物的刺激下,机体内的白色脂肪细胞经棕色化反应变为米色脂肪,使其具有棕色脂肪细胞的形态和功能[4]。但是米色脂肪的形成同样需要一定的激活条件。因此,研究与开发促进白色脂肪棕色化的食源性成分,具有重要的理论意义和应用前景。
课题组前期研究发现,乳酸菌发酵大麦提取物(LFBE)能够抑制3T3-L1细胞的脂滴合成。史腊妮等人研究表明LFBE中蛋白质含量高于未发酵大麦提取物(RBE),且LFBE能够显著下调脂肪细胞分化关键基因C/EBPα、SREBP-1c的表达,上调GLUT4的表达,从而减少细胞中脂肪酸的累积,增强细胞对葡萄糖的代谢能力,抑制3T3-L1细胞脂滴合成[5]。张家艳等人研究发现,LFBE能显著降低营养型肥胖大鼠的体重,降低其血清和肝脏总甘油三酯(TG)及总胆固醇(TC)含量,并提高肥胖大鼠的糖耐受量[6]。Aung等发现脂肪组织分泌的爱帕琳肽(Apelin)是G蛋白偶联受体APJ的配体,属于内源性多肽类激素,Apelin可以上调脂肪细胞PGC-1α和UCP1的表达,提高细胞耗氧量,促进线粒体增殖[7]。LFBE与RBE相比蛋白质含量明显升高,尤其是蛋白质大分子被分解成相对分子质量较小的蛋白质,很可能参与了抑制脂肪细胞分化等反应。
本文旨在初步分离纯化乳酸菌发酵大麦蛋白质,研究其与3T3-L1前脂肪细胞可能发生的棕色化反应,并初步探索其作用途径。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
大麦品种为扬饲3号,购自盐城市双增农化科技有限公司;植物乳杆(Lactobacillus plantarum dy-1,菌株编号:CGMCCNo.601)实验室自行分离鉴定。
Millipore超滤膜购自美国Merck Millipore公司;G-25凝胶柱购自美国GE Healthcare公司。
3T3-L1细胞,南京医科大学曹新教授赠送;DMEM(Dulbecco’s Modified Eagle Medium)购自美国 Corning公司;胎牛血清购自美国 Gibco公司;CCK-8试剂盒购自碧云天公司;3-异丁基-1-甲基黄嘌呤(IBMX)、胰岛素(INS)和地塞米松(DEX)购自上海创赛科学仪器有限公司;胰蛋白酶溶液购自BBI Life Science公司;青霉素-链霉素溶液购自生工生物工程(上海)股份有限公司;荧光定量PCR引物由上海生工生物工程技术服务有限公司合成;荧光定量PCR相关试剂购自Takara公司;葡萄糖检测试剂盒,购自爱尔兰 Megazym公司;其他生化试剂均为分析纯,购自国药集团上海化学试剂有限公司。
3T3-L1细胞诱导液的配制:
基本培养基(BM):DMEM 高糖培养基,含有10% FBS、100 U/mL青霉素和100 U/mL链霉素。
诱导培养基Ⅰ(DMⅠ):含有10 μg/mL胰岛素,0.5 mmol/L IBMX和1 μmol/L地塞米松的BM。
诱导培养基Ⅱ(DMⅡ):含有10 μg/mL胰岛素的BM。
1.1.2 主要仪器与设备
冷冻离心机,美国Beckman公司;超滤器装置,美国Merck Millipore公司;AKTApurifier蛋白纯化系统,美国 GE Healthcare公司;垂直电泳仪,美国BIO-RAD公司;倒置显微镜,南京江南永新光学有限公司;FlexStationⅡ多功能酶标仪,美国 Molecular Devices公司;CFX96荧光定量PCR仪,美国BIO-RAD公司。
1.2 实验方法
1.2.1 发酵液的制备
大麦发酵液制备:将脱壳后的大麦用水洗净,37 ℃烘干表面水分,采用锤式磨粉机磨粉并过100目筛,按大麦粉(W)∶水(V)=1(kg)∶7(L)的比例在发酵罐中混合均匀。将250 mL菌液8000 r/min离心15 min,弃上清,用水悬浮菌体,加入发酵罐,密封,31 ℃、180 r/min条件下发酵24 h,8000 r/min离心20 min,收集上清液备用。
相同条件下制备RBE-P溶液,不加乳酸菌。
1.2.2 LFBE-P的制备
向离心后的上清液中加入饱和硫酸铵溶液,使终浓度为60%,4 ℃ 8000 r/min离心40 min,收集沉淀,用 PBS(pH=7.4)分别溶解沉淀,采用考马斯亮蓝法测量蛋白浓度,标准曲线如图1。
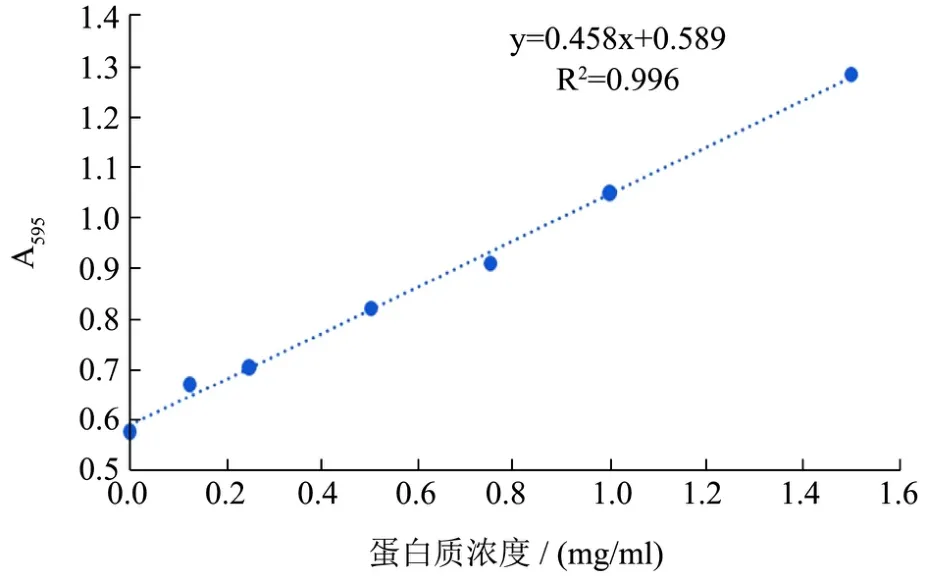
图1 考马斯亮蓝法测量蛋白质浓度标准曲线Fig.1 Standard curve for protein concentration via Bradford
将 PBS溶解后的蛋白溶液过 0.22 μm滤膜,将GE Hitrap desalting预装柱装载于AKTApurifier蛋白纯化系统,流速5 mL/min,在线监测280 nm处吸光值和电导率,收集蛋白峰。脱盐后,将溶液置于相对分子质量500 u的透析袋,封口,用聚乙二醇掩埋透析袋,待脱去部分水后,收集浓缩后的蛋白溶液即为LFBE-P,并测量蛋白浓度。
1.2.3 SDS-PAGE蛋白质电泳
将蛋白质溶液和 loading buffer按照 4∶1(V∶V)混合后,煮沸5 min使其变性。配制10%分离胶和5%浓缩胶,上样后初始电压80 V,直到样品被压成一道细线,提高电压至120 V约2 h,取出凝胶,考马斯亮蓝染色1 h,摇床脱色过夜,采用凝胶成像系统扫描泳带。
1.2.4 LFBE-P中三种相对分子质量范围蛋白质的制备采用Millipore超滤装置,3 ku和20 ku超滤膜,分别收集滤过液和截留液,超滤完成后用NaOH和蒸馏水依次清洗超滤膜,保存于福尔马林溶液。LFBE-P按分子量分为三部分:小于3 ku,3 ku~20 ku和大于20 ku。
1.2.5 3T3-L1细胞培养
用BM培养细胞,控制培养箱的温度为37 ℃,CO2浓度为5%,待细胞生长至80%时胰蛋白酶消化传代,选取对数期细胞用于实验。
1.2.6 LFBE-P的细胞毒性测定
将3T3-L1细胞以5×104个/mL的浓度接种于96孔板,每孔接种100 μL,培养箱中孵育12 h,待细胞贴壁后加入含指定蛋白浓度的培养基,分为调零组,空白组和实验组,每组6个平行,分组设置如表1。
将96孔板在培养箱中孵育24 h后,每孔加入10 μL CCK-8溶液,继续孵育2 h,使用双波长法(检测波长450 nm,参比波长650 nm)测定OD值。

表1 LEBE-P对3T3-L1细胞的毒性实验Table 1 Cytotoxicity test of LFBE-P for 3T3-L1 adipocytes

表2 3T3-L1细胞诱导分化步骤Table 2 Procedure for 3T3-L1 adipocytes differentiation
1.2.7 3T3-L1前脂肪细胞诱导分化
将对数期细胞接种于六孔板,用BM培养细胞至完全融合,继续培养48 h,此时为day0。按照表2所示开始诱导分化。RBE-P的终浓度为20 μg/mL(day0 to day8)。
1.2.8 细胞消耗葡萄糖量测定
采用葡萄糖氧化酶法,即 Megazyme的D-GLUCOSE试剂盒,吸取0.1 mL标准葡萄糖溶液(1 mg/mL)于试管中,加入3 mL GOPOD酶液,50 ℃孵育20 min,对样品稀释后做同样处理,在510 nm处测量吸光值。
细胞消耗葡萄糖量的计算方法:
培养基中初始葡萄糖含量-培养后培养基中葡萄糖含量∶
葡萄糖含量(μg/0.1 μL)=100×(ΔAsample-ΔAblank)/(ΔAstandard-ΔAblank)
其中:水的OD值为ΔAblank,标准葡萄糖为ΔAstandard,样品为 ΔAsample。计算后转化为 μmol作图(Mglucose=180.16 g/mol),其中培养基体积为2.5 mL(六孔板)。
1.2.9 白色脂肪棕色化相关基因相对表达量的测定
采用TAKARA RNA extraction kit试剂盒法提取诱导分化后的3T3-L1细胞总RNA。提取RNA后按试剂盒步骤进行逆转录成cDNA,实时荧光定量PCR的扩增条件:95 ℃预变性 30 s,95 ℃变性 15 s,60 ℃退火34 s,共40个循环。基因的相对表达量用2-ΔΔCt计算。在Geen bank中查询小鼠的mRNA序列,应用primer3.0设计引物,相关基因的引物序列如表3。

表3 实时荧光定量PCR引物设计Table 3 Gene-specific primers used for real-time PCR
1.2.10 统计方法
采用统计软件SPSS 21.0对数据进行分析,Excel软件进行作图,各组数据以±SD(平均值±标准偏差)表示,采用单项方差分析,用DPS来确定数据间的显著性差异,显著性水平设定为p<0.05。
2 结果与讨论
2.1 LFBE-P与RBE-P的比较分析

图2 Hitrap desalting G-25凝胶柱图谱Fig.2 Hitrap desalting 25 gel filtration chromatogram
蛋白质沉淀复溶于PBS溶液中,由于含有高浓度的盐,需要对溶液进行脱盐处理。GE的Hitrap desalting G-25凝胶柱具有高效的脱盐能力,脱盐结果见图2。电导率峰位置在蛋白吸收峰之后,收集蛋白吸收峰并浓缩,即可得LFBE-P溶液。
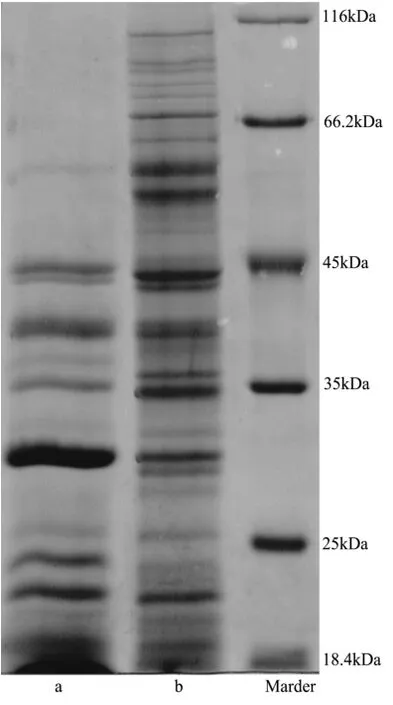
图3 SDS-PAGE聚丙烯酰胺电泳图谱Fig.3 SDS-PAGE Polyacrylamide gel electrophoresis
通过SDS-PAGE聚丙烯酰胺凝胶电泳,对LFBE-P和RBE-P进行分析,由图3可知,RBE-P相对分子质量分布广泛,大分子蛋白质较多。经过乳酸菌发酵以后,分子量在45 ku以上的大分子蛋白几乎全部消失,表明大麦中的可溶性大分子蛋白质经过乳酸菌作用后被分解成相对分子质量较小的蛋白质。
同时,由电泳图谱3可知,发酵前后蛋白的种类均有很多,因此对LFBE-P功能活性的研究,需对其进行初步的分离提纯。
2.2 LFBE-P对3T3-L1细胞存活率的影响
3T3-L1是前脂肪细胞,在一定刺激下会被诱导分化成成熟的脂肪细胞。对药物的作用浓度一般采用MTT法和CCK8法进行研究,由于乳酸菌发酵大麦产物能够与 MTT反应,因此选择 CCK8作为鉴定LFBE-P最佳作用浓度范围的方法。
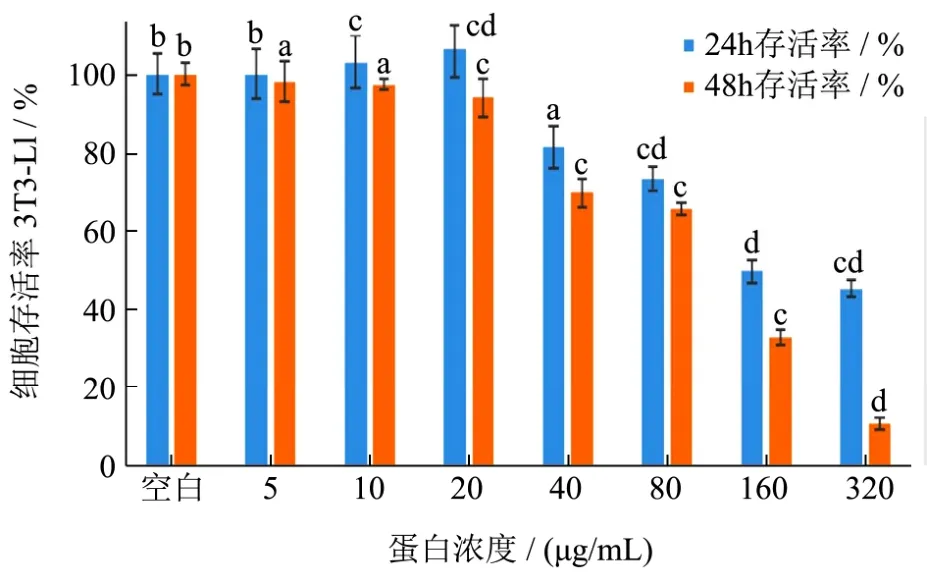
图4 LFBE-P对3T3-L1细胞增殖的影响Fig.4 Effect of LFBE-P on the proliferation of 3T3-L1 preadipocytes
图4表示了LFBE-P对3T3-L1细胞存活率的影响,由于细胞培养需要每隔48 h进行换液,以供细胞营养代谢所需,因此需要研究48 h以内的细胞毒性试验。由图4可知,低浓度LFBE-P对3T3-L1细胞的抑制率不明显,反而有略微的促进其生长的能力。当蛋白质浓度大于40 μg/mL时,对细胞开始产生明显的抑制作用,此时的细胞存活率分别为81%(24 h)和69%(48 h)。当蛋白质浓度继续升高,到320 μg/mL时,3T3-L1细胞经过48 h培养,存活率仅为10.8%,表明大部分细胞已经死亡。在此基础上,最终选择LFBE-P作用浓度为 10 μg/mL,15 μg/mL 和 20 μg/mL。
2.3 LFBE-P诱导3T3-L1细胞棕色化的作用
2.3.1 LFBE-P对3T3-L1细胞葡萄糖消耗量的影响
图5表示RBE-P和LFBE-P对3T3-L1细胞葡萄糖消耗量的影响。由图可知,在24 h以内,细胞对葡萄糖的消耗量,RBE-P比空白提高了 28.7%,而LFBE-P在低浓度(10 μg/mL)下对葡萄糖消耗量低于RBE-P,随着浓度升高,葡萄糖消耗量逐渐上升,20 μg/mL的LFBE-P相比空白提高了近一倍,比对照组提高了80%。Yi Han等人利用槲皮素诱导3T3-L1细胞棕色化,发现细胞的代谢水平提高,并且在胰岛素的作用下,细胞在分化早期对葡萄糖利用率迅速提高[8]。Laura等人通过激活G蛋白偶联受体,使皮下白色脂肪组织细胞发生棕色化反应,线粒体迅速增殖,进而加强细胞的氧化呼吸和对葡萄糖消耗量[9]。本研究中细胞在受到LFBE-P的刺激下,短期内即可迅速提高对葡萄糖的利用率,提高能量代谢效率,有明显的棕色化脂肪细胞的性状。在培养时间达48 h后,细胞对葡萄糖的消耗量趋于稳定,由于培养基中底物充足,可能是因为六孔板中细胞数量受限,相关酶的活力已趋于饱和。
综上,LFBE-P相比RBE-P能够显著提高3T3-L1细胞对葡萄糖的利用率。

图5 RBE-P和LFBE-P对3T3-L1细胞葡萄糖消耗量的影响Fig.5 Effect of RBE-P and LFBE-P on glucose consumption of 3T3-L1 preadipocytes
2.3.2 LFBE-P对3T3-L1细胞棕色化特征基因表达的影响
以胰岛素诱导 3T3-L1分化成脂肪细胞为对照,观察 RBE-P和 LFBE-P对其分化的影响。荧光定量PCR对3T3-L1细胞mRNA含量的分析结果如图6所示。
UCP1是白色脂肪棕色化过程中最重要的蛋白质之一。Maria等人研究发现棕色脂肪细胞的线粒体产热能力远高于白色脂肪细胞,棕色化脂肪细胞的主要特征表现为提高有氧呼吸速率,线粒体扩增,利用线粒体内膜的UCP1蛋白分解脂肪酸和葡萄糖产生热量[10]。Ayalon等人对比了肥胖和正常小鼠脂肪组织的UCP1表达量,发现前者UCP1含量低于后者,表明UCP1在白色脂肪细胞中的表达量比较低[11]。UCP1蛋白是棕色化脂肪细胞实现其功能的重要执行蛋白,因此其基因表达量可以间接反映细胞是否发生了棕色化。
由图6a可知,RBE-P组与正常脂肪细胞的UCP1表达量基本相同,而LFBE-P仅仅在10 μg/mL的浓度时即可显著上调UCP1表达量,是RBE-P表达量的1.5倍。且UCP1基因表达量与LFBE-P浓度呈正相关,20 μg/mL时基因上调接近2倍。
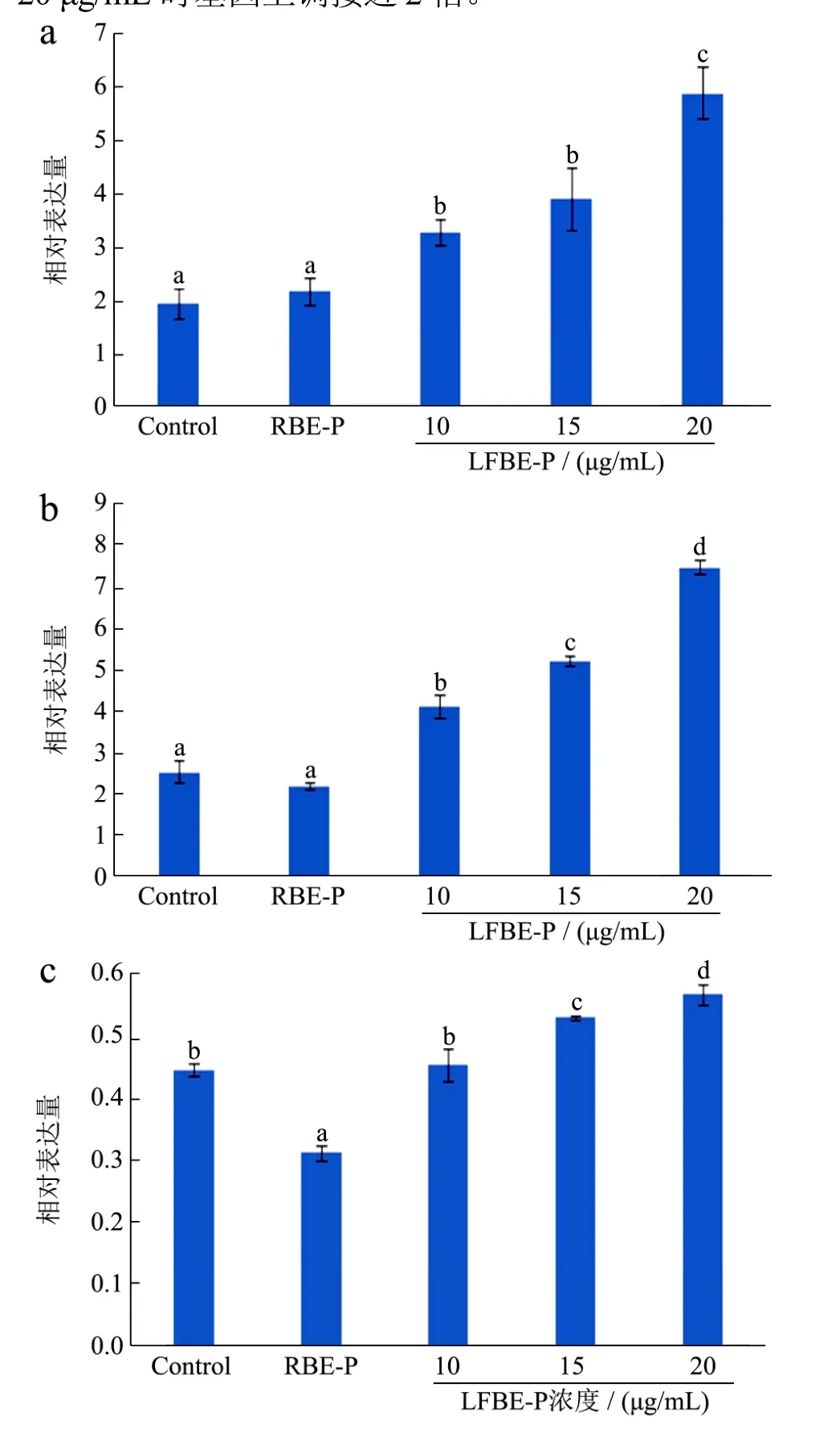
图6 RBE-P和LFBE-P对3T3-L1细胞棕色化相关基因表达的影响Fig.6 Effect of RBE-P and LFBE-P on brown-specific gene expression
过氧化物酶体增殖激活受体 γ的共激活剂PGC-1α是细胞棕色化过程中的重要转录因子,PGC-1α涉及体内能量代谢,是线粒体增殖过程中的关键调节因子[12],因此,其表达量与细胞内线粒体数量呈正相关,同时可以反映细胞的氧化呼吸能力的提升。Katarina等人发现,抑制Gq蛋白可以提高米色脂肪的含量,引起PGC-1α和UCP1表达量上升,最终导致细胞能量代谢得以增强[13]。
由图6b可知,在RBE-P作用下PGC-1α的表达比对照组低13%,说明RBE-P对PGC-1α的表达具有抑制作用,不利于3T3-L1细胞的棕色化。LFBE-P可提高PGC-1α的表达量,增加幅度与LFBE-P的浓度相关,20 μg/mL时PGC-1α的表达量是对照组的2倍,且三组不同浓度与对照组相比均差异显著(p<0.05)。
PRDM16是一种锌指转录因子,在棕色脂肪细胞中含量丰富,有助于棕色脂肪细胞中产热基因 UCP1和CIDEA的表达,激活细胞的产热程序,从而使细胞高效利用脂肪。Mirko等人发现miRNA-133能够下调PRDM16的表达量,对miRNA-133的抑制可以提高PRDM16含量,进而促进棕色脂肪细胞分化[14]。在白色脂肪细胞中 PRDM16的表达有利于细胞分化成米色脂肪细胞,表现出类似于棕色脂肪产热的能力[15]。
由图6c可知,低浓度的LFBE-P对PRDM16的调节作用不明显,浓度为20 μg/mL时,PRDM16表达量上调27%。而RBE-P对PRDM16有抑制作用,其表达量较对照组降低了30%。因此,LFBE-P能够在一定程度上促进PRDM16的表达,有利于3T3-L1细胞棕色化。
2.4 不同相对分子质量的LFBE-P诱导3T3-L1细胞棕色化
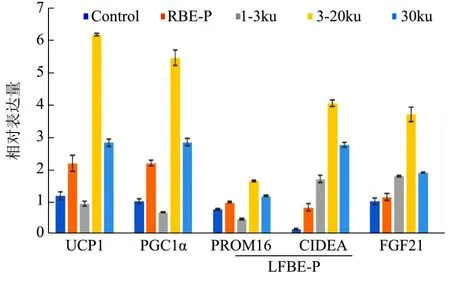
图7 LFBE-P不同相对分子质量对棕色化相关基因表达的影响Fig.7 Effect of LFBE-P with different molecular weights on brown-specific gene expression
由于LFBE-P中含有很多杂蛋白,甚至可能含有抑制 3T3-L1细胞棕色化的部分物质。因此,将其按照相对分子质量分为三部分:1~3 ku,3~20 ku和大于20 ku,分别进行试验。
由图7不难看出,成熟的3T3-L1脂肪细胞,对产热相关基因的表达均处于较低水平,可见白色脂肪细胞的产热能力很低。RBE-P对棕色化相关基因的表达具有不同程度的微调。LFBE-P中相对分子质量处于 3~20 ku范围内的蛋白,能够明显提高 UCP1和PGC-1α的表达量,说明LFBE-P中的主要活性成分是3~20 ku的蛋白质。而分子量小于3 ku的蛋白,反而对棕色化相关基因的表达有抑制作用,不利于3T3-L1细胞的棕色化。
Fgf21是一种成纤维细胞生长因子,在胰岛素的作用下会促进脂肪细胞对葡萄糖的摄取能力,Murielle等人研究表明Fgf21能够提高细胞的能量消耗和脂肪利用率,并且不必依赖UCP1蛋白的产热功能,从而抑制肥胖[16]。由图7可知,LFBE-P中相对分子质量为 3~20 ku的蛋白质可以显著促进 3T3-L1细胞中Fgf21和Cidea的表达,进而提高细胞的脂解作用和产热能力。但是,基因表达水平只是 3T3-L1细胞发生棕色化的主要证据之一,其具体的分子机制和相关的信号调节通路还需要进一步的研究。
3 结论
RBE-P能够在一定程度上促进棕色化基因的表达,但是效果不明显。LEBE-P可显著提高3T3-L1细胞产热基因如UCP1的表达,浓度为20 μg/mL时即可使其表达量提高近2倍,在24 h内细胞对葡萄糖的利用率比空白组提高80%。LFBE-P中包含了相对分子质量不同的系列蛋白,其中相对分子质量3~20 ku的蛋白对提升UCP1、PGC-1α和Fgf21表达量的幅度最大,即诱导白色脂肪细胞棕色化的作用最为明显,但其作用机制尚需进一步研究。

