普洱茶提取物及其复合配方改善糖尿病大鼠的糖脂代谢紊乱
李惠,陈曦,刘畅,黄晶,洪淼,郝丽萍,杨雪锋
(1.华中科技大学同济医学院公共卫生学院营养与食品卫生学系,食品营养与安全湖北省重点实验室,湖北武汉430030)(2.武汉跃莱健康产业有限公司研究院,湖北武汉 430023)
Ⅱ型糖尿病(Type 2 diabetes mellitus,T2DM)发病率逐年升高[1],成为威胁全球人类健康的重要公共卫生问题。2016年世界卫生组织公布的数据显示:2014年全球糖尿病发病率为8.5%,约有4.22亿患者。而2型糖尿病更是占其中的90%,中国目前Ⅱ型糖尿病的发病率已超过全球平均水平,高达 11.6%[2]。糖尿病患病率逐年增加对于我国经济发展、人民健康和生活水平都是一项巨大的挑战。长期高能量膳食导致的糖脂代谢紊乱和胰岛素抵抗在2型糖尿病的发生发展中具有重要的作用,寻求有效的膳食干预措施防治Ⅱ型糖尿病成为研究者关注的热点。
研究表明,普洱茶具有一定程度的降糖降脂作用。动物实验表明,普洱茶水提物能够促进Wistar大鼠骨骼肌葡萄糖转运,改善大鼠胰岛素抵抗[3],还可以降低小鼠内脏脂肪含量,但是对小鼠的体重不产生影响[4]。也有研究表明,普洱茶提取物和绿茶提取物能够降低STZ糖尿病模型大鼠空腹血糖,同时均能降低血糖曲线下面积,但是普洱茶提取物在降低动物空腹血糖和血糖曲线下面积方面要优于绿茶提取物[5]。菊粉低聚果糖又称为菊糖,是一种功能性植物多糖,水解后生成低聚果糖[6],也具有一定调节糖脂代谢的功效。动物实验发现,低聚果糖能够增加胰岛素敏感性,改善大鼠的胰岛素抵抗状态[7],并且能够调节肠道菌群的构成,增加乳酸杆菌、双歧杆菌等有益菌的含量,从而调节糖尿病大鼠的血糖水平[8,9]。另有研究发现,低聚果糖可以增加Wistar大鼠的排便量以及粪便脂肪含量,减少脂肪摄取,达到降脂的效果[10]。玉米须含有多种对人体有益的化学成分及营养物质,我国传统医学记载其有显著的利尿、降血糖、抑菌等功效[11]。也有动物实验表明,玉米须可以降低小鼠的基础血糖水平,并且抑制外源葡萄糖刺激下的血糖升高[12]。玉米须水提物则可以降低2型糖尿病大鼠血清游离脂肪酸、胆固醇和甘油三酯水平,改善大鼠脂代谢[13]。可见,普洱茶提取物、低聚果糖和玉米须提取物对于糖脂代谢紊乱具有一定的调节作用,但其复合配方改善糖/脂代谢紊乱和胰岛素抵抗的研究尚未见报道。本文将着重探讨三者复合配方对糖尿病大鼠糖/脂代谢紊乱和胰岛素抵抗的影响,为开发新的保健食品提供理论依据。
1 材料与方法
1.1 受试物
普洱茶提取(棕色粉末,3000 g/袋,茶多酚含量≥10%),由大闽食品(漳州)有限公司提供,人体推荐摄入量2 g/d,按成人60 kg·bw计为0.033 g/(kg·bw)。
低聚果糖,(菊粉,白色粉末,4000 g/袋,低聚果糖含量≥95%);由河南旗诺食品配料有限公司提供,人体推荐摄入量6 g/d,按成人60 kg·bw计为0.100 g/(kg·bw)。
玉米须提取物,(浅棕色粉末,3000 g/袋,葡萄聚糖≥60%),由南京泽朗生物科技有限公司提供,人体推荐摄入量 2 g/d,按成人 60 kg·bw 计为 0.033 g/(kg·bw)。
复合配方,普洱茶粉、低聚果糖、玉米须提取物按一定的比例混合,人体推荐摄入量10 g/d,按成人60 kg·bw 计为 0.167 g/(kg·bw)。
1.2 试剂和仪器
链脲佐菌素(Streptozocin,STZ)、无水柠檬酸,上海凌峰化学试剂有限公司;柠檬酸三钠,上海凌峰化学试剂有限公司;葡萄糖试剂盒,北京中生北控生物科技股份有限公司;血清胰岛素ELISA试剂盒,瑞典Mercodia公司;总胆固醇试剂盒,北京中生北控生物科技股份有限公司;甘油三酯试剂盒,北京中生北控生物科技股份有限公司;SpectraMax M2全自动酶标仪,美国Molecular Devices/MD公司;低温高速离心机,德国Eppendorf 5804R;血糖仪及血糖试纸,罗氏诊断产品有限公司;ZW-A微量震荡器,中外合资深圳天南海北有限公司;电动匀浆器,美国Terre Haute公司。
1.3 饲料
大鼠饲料购自北京华阜康生物科技股份有限公司。高热能饲料组成为:猪油10%、蔗糖15%、蛋黄粉15%、酪蛋白5%、胆固醇1.2%、胆酸钠0.2%、磷酸氢钙0.6%、石粉0.4%、小鼠维持饲料52.6%。
1.4 动物实验
本次实验糖/脂代谢紊乱、胰岛素抵抗模型造模方法,参照国食药监保化[2012]107号《辅助降血糖功能评价方法》。
健康成年雄性Sprague Dawley大鼠80只,体重为 130~150 g,由北京维通利华实验动物技术有限公司提供(批准证号:SCXK<京>2016-0011)。饲养于华中科技大学实验动物中心(实验动物设施许可证号:SYXK(鄂)2016-0057)。环境温度 20~26 ℃,相对湿度40%~70%。适应性喂养1周后,按体重随机分为8组:正常对照组、模型对照组及6个受试物组。正常对照组给予普通饲料,模型对照组和受试物组给予高脂饲料。普洱茶、低聚果糖、玉米须组分别按人体推荐摄入量的 20 倍(0.667 g/(kg·bw)、2.000 g/(kg·bw)、0.667 g/(kg·bw))经口灌喂给予受试物,低、中、高剂量复合配方组分别按人体推荐配方剂量的5倍(0.833 g/(kg·bw))、10 倍(1.667 g/(kg·bw))、20 倍(3.333 g/(kg·bw))经口灌胃给予受试物,正常对照组和模型对照组同时经口灌喂给予同体积的溶剂。大鼠灌胃量0.75 mL/(100 g·bw)。
饲养期间,每周记录实验大鼠的体重变化。饲养4周后,模型对照组和6个受试物组禁食12 h(不禁水),给予链脲佐菌素30 mg/(kg·bw)腹腔注射,注射量1 mL/(100 g·bw)。注射后继续给予高热能饲料喂饲3~5 d,进行葡萄糖耐量试验。实验结束,各组动物禁食3~4 h处死,取腹壁脂肪称重,计算脏体比。取血清及组织样品-80 ℃保存,测定血清胰岛素、血清及肝脏总胆固醇、甘油三酯水平。
1.5 指标检测
1.5.1 葡萄糖耐量试验
实验开始和实验结束时,分别进行葡萄糖耐量试验。各组动物禁食 3~4 h,进行尾静脉采血,弃去第一滴血,采用罗氏血糖仪测定空腹血糖即给葡萄糖前(0 h)血糖值,各受试物组给予不同浓度受试物,模型对照组给予同体积溶剂,正常对照组不做处理,15 min后各组经口给予葡萄糖2.5 g/(kg·bw),测定给葡萄糖后各组0.5、2 h的血糖值。观察各组空腹血糖、给葡萄糖后(0.5、2 h)血糖及血糖曲线下面积(Area under curve of glucose,AUC)的变化。AUC=(0 h血糖+0.5 h)×0.5/2+(2 h+0.5 h)×1.5/2。
1.5.2 血清葡萄糖、胰岛素检测
1.5.2.1 血清葡萄糖检测
采用葡萄糖试剂盒测定大鼠血清葡萄糖浓度。将葡萄糖校准品分别进行0、2、4、8、16倍稀释,制作标准曲线;
血清8倍稀释后加入96孔板混匀,波长505 nm,全自动酶标仪读取各孔吸光度。根据标准曲线和各孔吸光度值计算血清葡萄糖浓度。
1.5.2.2 血清胰岛素检测
各组动物禁食3 h,采用大鼠ELISA试剂盒检测血清胰岛素。将胰岛素校准品分别进行0、2、4、8、16倍稀释,制作标准曲线,将血清和酶结合液加入96孔板混匀,孵育2 h,洗脱6次,加入底物孵育15 min后终止反应。波长450 nm,全自动酶标仪读取各孔吸光度。根据标准曲线和各孔吸光度值计算血清胰岛素浓度。根据血清葡萄糖浓度和胰岛素浓度计算胰岛素抵抗指数(Homeostasis model assessment,HOMA-IR)。胰岛素抵抗指数(HOMA-IR)=胰岛素/22.5e-ln血糖≈血清葡萄糖浓度×胰岛素浓度/22.5。
1.5.3 血清以及肝脏TC、TG检测
采用胆固醇和甘油三酯检测试剂盒测定大鼠血清和肝脏总胆固醇(Total cholesterol,TC)、甘油三酯(Triglycerides,TG)浓度。将校准品分别进行0、2、4、8、16倍稀释,制作标准曲线;血清4倍稀释后加入96孔板混匀,37 ℃孵育10 min,波长510 nm,全自动酶标仪读取各孔吸光度。根据标准曲线和各孔吸光度值计算血清TC、TG浓度。准确称取大鼠肝脏样品100 mg,置于900 μL异丙醇中,冰上匀浆后于4 ℃冰箱静置48 h,随后3000 r离心15 min,取上清,测定步骤同血清TC、TG测定。
1.6 数据统计分析
采用Excel进行数据录入,统计分析采用T检验、方差分析SNK检验(方差齐时)及DunnettT3检验(方差不齐时)(SPSS 23.0)。
2 结果与讨论
2.1 大鼠体重变化及脏体比
大鼠体重变化情况如表1所示。各组大鼠初始体重无显著性差异,模型对照组体重从第一周末开始显著高于正常对照组(p<0.05);普洱茶组和高剂量复方组体重从第一周末开始显著低于模型对照组(p<0.05),中剂量复方组体重从第二周末开始显著低于模型对照组(p<0.05),低剂量复方组体重从第四周末开始也显著低于模型对照组(p<0.05)。模型对照组及各受试物组经STZ造模后,出现多食、多饮、多尿以及体重下降“三多一少”的2型糖尿病症状,所以实验末期大鼠体重出现下降的趋势。
实验结束时,各组大鼠腹壁脂肪重量及腹壁脂肪占体重的比值(脏体比)见表 2。模型对照组腹壁脂肪重量及脏体比显著高于正常对照组(p<0.05)。经方差分析,与模型对照组相比,普洱茶组、低聚果糖组、低、中、高剂量复方组腹壁脂肪重量及脏体比明显降低(p<0.05),而玉米须组没有显著差异。
表1 受试物对大鼠体重的影响Table 1 Effects of test substances on body weight in rats(±SD,g)

表1 受试物对大鼠体重的影响Table 1 Effects of test substances on body weight in rats(±SD,g)
注:*p< 0.05,与正常对照组比较;#p< 0.05,与模型对照组比较。
组别 动物数量/n 始重 第一周末 第二周末 第三周末 第四周末 末重正常对照组 10 239.80±6.75 298.80±8.34 353.20±16.99 376.40±13.16 416.40±12.83 427.20±17.20模型对照组 8 242.80±6.61 310.00±10.66* 370.90±16.75* 413.30±17.97* 455.00±24.15* 428.30±28.28普洱茶组 8 246.40±11.06 285.50±21.19# 334.00±30.30# 362.50±32.65# 390.60±47.36# 364.60±39.65#低聚果糖组 8 242.80±8.45 293.80±24.33 345.40±33.68 384.40±42.62 427.90±44.42 415.60±34.55玉米须组 8 245.60±9.26 309.10±20.38 376.30±28.27 403.60±42.56 439.30±48.99 419.10±48.95低剂量复方组 8 240.80±3.37 297.30±10.19 346.00±16.7 379.60±18.35 404.10±21.94# 387.10±46.5中剂量复方组 8 240.40±5.37 291.90±15.63 338.30±15.45# 372.00±16.85# 404.60±24.4# 379.00±25.14#高剂量复方组 8 241.00±6.87 281.60±7.54# 315.50±9.68# 334.10±7.12# 360.00±6.00# 337.40±11.94#
表2 受试物对大鼠腹壁脂肪重量和脏体比的影响Table 2 Effects of test substances on abdominal fat weight and organ coefficient in rats(±SD)

表2 受试物对大鼠腹壁脂肪重量和脏体比的影响Table 2 Effects of test substances on abdominal fat weight and organ coefficient in rats(±SD)
组别 动物数量/n 腹壁脂肪/g 脏体比/%正常对照组 10 2.58±1.48 0.61±0.35模型对照组 8 5.55±1.16* 1.29±0.23*普洱茶组 8 2.05±0.38# 0.57±0.11#低聚果糖组 8 3.83±1.39# 0.91±0.29#玉米须组 8 5.09±1.69 1.22±0.39低剂量复方组 8 1.58±0.49# 0.40±0.10#中剂量复方组 8 2.62±1.47# 0.69±0.40#高剂量复方组 8 1.64±0.71# 0.49±0.21#
注:*p< 0.05,与正常对照组比较;#p< 0.05,与模型对照组比较。
2.2 受试物对大鼠葡萄糖耐量的影响
大鼠实验前后糖耐量试验结果的比较见表 3。实验后模型对照组0.5小时血糖值≥10 mmol/L,模型对照组0.5 h、2 h任一时间点血糖值、血糖曲线下面积显著高于正常对照组(p<0.05),可见本实验糖代谢紊乱模型成立。经方差分析,与模型对照组相比:中剂量复方组0.5 h血糖显著降低(p<0.05),其他受试物组未见明显变化。血糖曲线下面积出现下降的趋势,但是也未见显著差异。
2.3 受试物对大鼠胰岛素抵抗指数(HOMA-IR)的影响
实验结束时,各组大鼠血清葡萄糖浓度、胰岛素浓度和胰岛素抵抗指数结果见表 4。经方差分析,模型对照组血清葡萄糖浓度和胰岛素浓度显著高于正常对照组(p<0.05),可见胰岛素抵抗模型成立。与模型对照组相比,各受试物组血清葡萄糖浓度没有显著差异;普洱茶组、低聚果糖组及低、中、高剂量复方组胰岛素浓度和胰岛素抵抗指数呈显著下降(p<0.05)。
表3 实验前后大鼠空腹血糖及血糖曲线下面积Table 3 Fasting glucose and the area under curve of glucose before and after the experiment(±SD,mmol/L)

表3 实验前后大鼠空腹血糖及血糖曲线下面积Table 3 Fasting glucose and the area under curve of glucose before and after the experiment(±SD,mmol/L)
注:*p< 0.05,与正常对照组比较;#p< 0.05,与模型对照组比较。
组别 实验前(±SD) 实验后(±SD)空腹血糖 0.5 h血糖 2 h血糖 AUC 空腹血糖 0.5 h血糖 2 h血糖 AUC正常对照组 6.62±0.42 8.90±0.61 7.74±0.86 16.37±0.95 6.18±0.23 8.15±0.56 7.64±0.64 15.39±0.80模型对照组 6.63±0.37 8.36±0.30 7.91±0.47 15.96±0.26 23.04±2.07* 31.98±1.34* 25.68±4.96* 56.99±4.63*普洱茶组 7.00±0.35 8.94±0.34 8.24±0.89 16.89±0.82 21.58±5.80 30.50±3.64 26.49±4.09 55.78±6.91低聚果糖组 6.78±0.36 8.43±0.77 7.53±0.62 15.78±1.20 22.23±7.72 25.11±9.31 22.76±8.22 47.75±16.71玉米须组 7.05±0.31 8.73±0.71 8.24±1.53 16.68±1.78 24.05±6.43 29.71±4.30 25.84±6.72 56.48±10.92低剂量复方组 6.80±0.30 9.09±0.99 7.48±0.85 16.41±1.15 19.78±8.42 25.68±7.09 22.71±7.90 49.11±14.14中剂量复方组 6.71±0.53 8.65±0.74 7.76±0.77 16.18±1.07 16.21±7.51 23.29±7.28# 20.71±7.29 42.88±12.94高剂量复方组 7.08±0.38 8.71±0.46 7.54±0.89 16.16±1.43 22.55±3.56 28.68±6.18 22.21±9.06 50.99±11.39
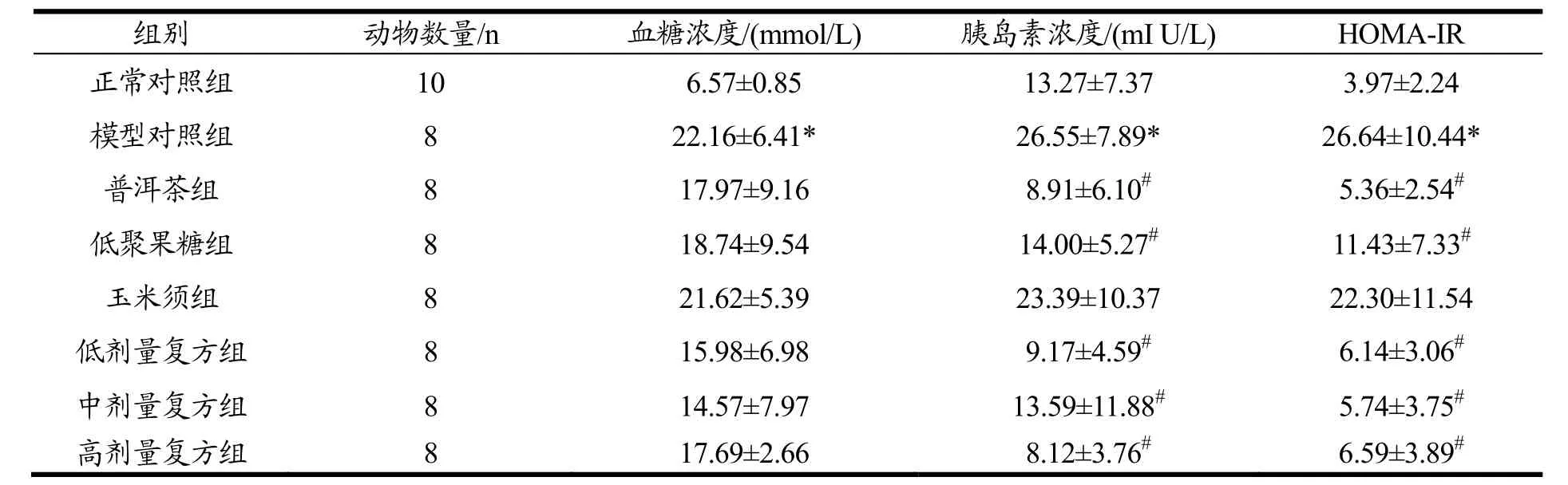
表4 受试物对大鼠胰岛素抵抗指数的影响Table 4 Effects of test substances on insulin resistance index in rats
2.4 受试物对血清及肝脏总胆固醇(TC)和甘油三酯(TG)的影响
实验结束时,各组大鼠血清及肝脏总胆固醇和甘油三酯水平见表 5。模型对照组血清及肝脏 TC、TG浓度显著高于正常对照组(p<0.05),可见脂代谢紊乱模型成立。经方差分析,与模型对照组相比:普洱茶组、低、中、高剂量复方组血清TG呈明显下降(p<0.05);普洱茶组以及中、高剂量复方组肝脏TC呈显著下降(p<0.05);普洱茶组、玉米须组及高剂量复方组肝脏TG呈显著下降(p<0.05)。

表5 受试物对大鼠血清及肝脏中总胆固醇和甘油三酯的影响Table 5 Effects of test substances on serum and liver total cholesterol, triglyceride in rats
3 结论
3.1 超重或肥胖是Ⅱ型糖尿病发生发展的一个危险因素[14]。研究发现,200 mg/(kg·bw)或 400 mg/(kg·bw)普洱茶提取物分别能够使db/db小鼠体重降低9.83%和14.89%[15],低聚果糖能够增加排便次数以及粪便脂肪含量,降低高碳水化合物高脂饲料喂养大鼠12.3%的体重[10],玉米须多糖则可能通过延长胃排空时间,降低食欲,加速肠蠕动,促进排便等作用降低体重[16]。本文观察到,普洱茶组和低、中、高剂量复方组大鼠体重均显著低于模型对照组,分别降低了 14.87%、9.62%、11.51%、21.22%,表明普洱茶提取物及复合配方能够有效减缓高脂喂养导致的大鼠超重或肥胖的发展。低聚果糖显著降低了大鼠腹壁脂肪重量及脏体比,但对大鼠体重的影响不明显,玉米须则对大鼠体重和脂肪含量均无显著影响。
3.2 研究发现,普洱茶水提物能够增加 HepG2细胞葡萄糖的摄取,抑制大鼠肠道蔗糖酶、麦芽糖酶和猪胰腺淀粉酶的活性,抑制db/db小鼠血清胰岛素和葡萄糖水平的升高,糖耐量试验中,400 mg/(kg·bw)普洱茶水提物能够使db/db小鼠1 h和3 h血糖升高值比对照组低46.39%和53.06%,有效改善小鼠糖耐量损伤和胰岛素敏感性[15]。低聚果糖是一种重要的益生元[17]。有研究发现,低聚果糖能够增加STZ诱导的2型糖尿病Wistar大鼠的糖耐量,增加胰岛素的分泌,有效降低空腹血糖水平[18],并且可提高β细胞的葡萄糖敏感性,降低餐后血糖[19]。玉米须多糖能够使糖尿病小鼠血糖降低46.47%,促进肝糖原合成[20]。玉米须皂苷也具有较好的降糖活性,能降低正常小鼠血糖水平,对肾上腺素、四氧嘧啶、链脲佐菌素所致的小鼠高血糖模型都有较好的降糖作用,但是玉米须水提物对小鼠血浆胰岛素水平没有产生影响[21]。本次研究的葡萄糖耐量试验中,中剂量复方组0.5 h血糖比模型对照组降低了27.17%。而普洱茶组、低聚果糖组及低、中、高剂量复方组大鼠胰岛素浓度比模型对照组分别降低了66.44%、47.27%、65.46%、48.81%和69.42%,胰岛素抵抗指数分别降低了79.88%、57.09%、76.95%、78.45%和75.26%,提示普洱茶粉、低聚果糖以及低、中、高剂量复方组可能具有降糖和改善胰岛素抵抗的作用,而玉米须单品没有表现出显著的影响。苗明三等人的研究中发现,玉米须皂苷能够显著降低STZ诱导的高糖模型小鼠血糖水平,中剂量组(0.2 g/(kg·bw))效果最佳,血糖下降率达39.64%[21],而本次实验并没有观察到玉米须提取物显著的降糖作用,可能是与受试物剂量和降糖活性成分含量有关。
3.3 普洱茶提取物可以显著下调固醇调节元件结合蛋白-1c等脂质合成相关基因的表达,使大鼠肾周脂肪和睾周脂肪组织的重量分别降低 48.23%和43.34%[22]。低聚果糖可以增加胃内容物的黏度,延长胃排空时间,有效降低Zucker Fa/Fa大鼠的自主进食和脂肪变性,使肝脏甘油三酯含量降低36.73%[23],低聚果糖还能够减少肝脏甘油三酯和胆固醇的合成,促进胆固醇转化为胆汁酸,饲料中添加 8%的低聚果糖可以使粪便胆汁酸的排泄增加56.25%[24]。玉米须水提物则能够通过降低胆固醇合成产生降血脂的功效[25]。本次实验中,与模型对照组相比,普洱茶组以及低、中、高剂量复方组血清 TG分别降低了 77.59%、67.67%、69.40%和 74.57%;普洱茶组以及中、高剂量复方组肝脏 TC分别降低了 40.18%、26.56%和38.25%;普洱茶组、玉米须组以及高剂量复方组肝脏TG分别降低了39.18%、36.06%和32.36%。普洱茶组、低聚果糖组、低、中、高剂量复方组腹壁脂肪重量分别降低了63.06%、30.99%、71.53%、52.79%和70.45%,脏体比分别降低了55.81%、29.46%、68.99%、46.51%和62.02%。提示普洱茶粉、低聚果糖、玉米须以及低、中、高剂量复方组均具有一定改善大鼠脂代谢紊乱的作用。
3.4 综上所述,本研究采用高脂联合小剂量 STZ建立糖/脂代谢紊乱、胰岛素抵抗模型,普洱茶提取物对该模型大鼠表现出显著的减重、降脂以及改善胰岛素抵抗的良好效果;低聚果糖则能够有效降低大鼠腹壁脂肪重量和脏体比,改善胰岛素抵抗状态;而玉米须在降低肝脂方面具有一定的功效。三种受试物的复合配方则能够显著降低大鼠体重、血脂、肝脂、腹壁脂肪含量和脏体比,并能有效改善大鼠葡萄糖耐量和胰岛素抵抗。本研究的结果为辅助降血糖和降血脂的保健食品开发提供了重要的理论依据。

