木瓜提取物对小鼠脂肪肝的保护作用
李聪,熊海容,彭晓蔓,魏承亮,段丽,佘慧宇,张长城,袁丁,3,刘朝奇
(1.肿瘤微环境与免疫治疗湖北省重点实验室,三峡大学,湖北宜昌 443002)(2.三峡大学医学院,湖北宜昌 443002)(3.三峡大学附属仁和医院,湖北宜昌 443002)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指除外酒精和其他明确的损肝因素所致的以肝细胞内脂肪过度沉积为主要特征的临床病理综合征。包括单纯性脂肪肝(Simple fatty liver,SFL)、非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)及其相关肝硬化[1~3]。近年来,NAFLD已成为发达国家和各地区最常见的慢性肝病,全球和我国大陆的 NAFLD患病率分别约为 25%和20%,且发病率呈不断上升趋势[4,5]。目前,NAFLD的治疗主要包括生活方式的干预、药物治疗、调节肠道微生态以及手术外科干预等几个方面[2,3,6,7],然而,目前尚无明确有效的治疗方式,因此寻求一种有效的干预NAFLD的发生发展药物显得极其重要。
c-Met,也被称为酪氨酸蛋白激酶或肝细胞生长因子受体(hepatocyte growth factor receptor,HGFR),具有酪氨酸激酶活性。肝细胞生长因子(Hepatocyte growth factor,HGF)与c-Met结合并启动细胞内多个酪氨酸残基的磷酸化,调节下游多个信号通路,介导细胞分化、增殖和血管生成等[8,9]。在肝组织中,HGF可能起保护免受肝损伤或加速再生过程的作用[10]。血管内皮生长因子a(Vascular endothelial growth factor a,VEGFa)作为一种关键的促血管生成因子,在诱导血管生成、血管发生和内皮细胞生长,促进细胞迁移和抑制细胞凋亡等方面具有重要的作用。MicroRNAs(miRNAs)作为一种重要的转录后调节因子,在肝脏的生成、分化及代谢过程中发挥着重要的调控作用。迄今为止,已经提出miRNA在脂质代谢中发挥重要作用,包括miR-122,miR-24,miR-370,miR-378,miR-335,miR-125a-5p和 miR-33等[11,12]。另有文献报道指出,miR199a-5p在NAFLD模型的小鼠肝脏组织中表达上调,调控肝脏中的脂质代谢,在 NAFLD发生发展中起着至关重要的作用[13]。
木瓜为蔷薇科植物贴梗海棠干燥近成熟果实,中医认为木瓜有舒筋、活络、健脾开胃、舒肝止痛、祛风除湿之功效,可用于预防和治疗风湿病、霍乱、痢疾、肠炎、脚气病及维生素C缺乏症等[14]。本课题组前期研究发现,木瓜提取物对小鼠肝纤维化有良好的干预作用[15],为进一步研究该木瓜提取物对小鼠肝脏脂质代谢的影响及其可能的机制,本课题组进行了相应的实验研究。
1 材料与方法
1.1 材料与仪器
1.1.1 实验动物
SPF级昆明雄性小鼠40只,周龄为4~6周,体重为 16~20 g,由湖北省三峡大学实验动物中心提供,动物生产许可证号((SCXK)(鄂)2011-0061)。
1.1.2 动物饲料
普通饲料由三峡大学实验动物中心提供。高脂高糖饲料是由普通饲料、猪油、果糖、胆酸钠、胆固醇、食盐等混合而成,按照普通饲料(53%)、胆固醇(5%)、猪油(20%)、胆酸钠(0.25%)、果糖(20%)、食盐(1%)的重量比混合固定成型。用药组饲料在高脂高糖饲料的基础上采用木瓜提取物低剂量(100 mg/kg)和高剂量(300 mg/kg)加入饲料中,混合固定成型,送到武汉农科院辐照灭菌备用。饲料营养成分见表1和表2:

表1 普通饲料营养成分表Table 1 Table of ordinary feed nutritional composition

表2 高脂饲料营养成分表(每kg饲料)Table 2 Table of High-fat diet nutrition composition
1.1.3 主要试剂
总RNA提取试剂盒,大连宝生物科技有限公司;胆固醇,国药集团化学试剂有限公司;逆转录试剂盒,大连宝生物科技有限公司;PCR引物,生工生物工程(上海)股份有限公司合成;兔单抗 Met(SP260)(sc-162-R),上海优宁维生物科技有限公司;Alexa Fluor 488 Donkey Anti-Rabbit lgG(H+L),上海优宁维生物科技有限公司。
1.1.4 主要仪器
实时定量PCR仪,德国Applied Biosysterms公司;Gene Genius凝胶分析系统,英国 SYNGNE公司;Gellogic 200凝胶成像分析系统,美国Kodak公司;激光共聚焦显微镜(尼康AIR+),日本尼康公司。
1.2 实验方法
1.2.1 木瓜提取物的制备
木瓜,蔷薇科木瓜属,木瓜提取物的制备方法为将1000 g资木瓜粉碎成粗粉后加70%乙醇3500 mL浸泡,100 ℃回流蒸馏过滤后收集,重复2次。合并提取物,65 ℃悬蒸去乙醇并浓缩至1000 mL,离心取上清加入大孔树脂内。分别用10%乙醇、30%乙醇、50%乙醇、70%乙醇各 11000 mL为流动相,流速为10 mL/min。洗脱液分段收集,浓缩干燥,用于后续实验研究。
其中10%乙醇洗脱组分的得率为6.6%,课题组将其命名为10%乙醇木瓜组分。前期,在细胞水平预试中10%乙醇木瓜组分显示出了良好的降脂活性,为进一步研究木瓜提取物的药理作用,课题组采用10%乙醇木瓜组分进行动物实验研究。
1.2.2 非酒精性脂肪肝小鼠模型的建立
SPF级昆明雄性小鼠40只,体重16~20 g,随机将其分成4组,每组10只。分组依次为正常对照组,高脂高糖组,木瓜提取物低剂量组,木瓜提取物高剂量组。正常对照组用普通饲料喂养,高脂组采用自制的高脂高糖饲料造模,用药组采用木瓜提取物低剂量(100 mg/kg)和高剂量(300 mg/kg)饲料喂养,按每只小鼠10 g/天给予,每两天记录1次体重,喂养1月后处死。
1.2.3 小鼠生化指标的检测
小鼠眼球取血后,将血液静置30 min,转速3000 r/min,离心10 min,离心后取上清即为血清,用试剂盒检测血清丙氨酸氨基转移酶(ALT)的水平;同样用试剂盒检测血清中胆固醇(TC)的水平。
1.2.4 肝脏组织HE染色
取10 mm×3 mm的新鲜肝脏大叶组织块放入包埋盒中,于中性福尔马林固定液固定,固定24 h后转入75%乙醇中,4 h后再经过常规脱水处理,石蜡进行包埋,然后切片(厚度4 μm),再进行常规HE染色,显微镜下观察肝组织病理变化情况。
1.2.5 RT-PCR检测小鼠肝组织中 HGF、VEGFa和c-Met的表达
称取冻存小鼠肝组织50 mg,采用TRIzol法提取小鼠肝脏组织的总RNA,1%琼脂糖凝胶电泳(100 V,100 mA,20 min)检测RNA的完整性。用微量核酸仪测定RNA的浓度,再经逆转录试剂盒逆转录得到cDNA。以GAPDH为内参,通过RT-PCR反应扩增目的基因。引物序列见表3。
RT-PCR的反应体系为25 μL体系,分别为灭菌双蒸水 10.5 μL,2×PCR Master mix 12.5 μL,HGF、VEGFa和c-Met引物1 μL(引物为原液稀释10倍),cDNA 1 μL。RT-PCR 实验反应条件:94 ℃、5 min;94 ℃、30 s;58 ℃、30 s;72 ℃、30 s;72 ℃、5 min;4 ℃,∞;RT-PCR反应结束后,取反应液10 μL于2%琼脂糖凝胶中电泳35 min,条件为100 V和100 mA,用凝胶成像系统检测,观察分析实验结果。

表3 PCR引物序列Table 3 Primer sequences used for PCR
1.2.6 实时荧光定量 PCR检测小鼠肝组织中miR-199a-5p的表达情况
称取冻存小鼠肝组织50 mg,采用TRIzol法提取小鼠肝脏组织的总RNA,1%琼脂糖凝胶电泳(100 V,100 mA,20 min)检测RNA的完整性。用微量核酸仪测定RNA的浓度,再经miR-199a-5p和U6特异性引物及逆转录试剂盒逆转录得到cDNA。以U6为内参,经qPCR反应扩增目的基因。反应总体系为10 μL,分别为 SYBER Green 5 μL;RNase-free water 2.4 μL;引物 0.4 μL(引物为原液稀释 10 倍);cDNA 2 μL(为原液稀释 10 倍);ROX 0.2 μL。
反应条件为:95 ℃ 5 min;95 ℃ 30 s;60 ℃ 30 s;72 ℃ 15 s;75 ℃ 1 s;cycles 40;72 ℃ 10 min;溶解曲线从56 ℃到98 ℃,每0.3 ℃读取一次;引物序列见表2;PCR反应结束后读取CT值,利用软件Opticon Monitor分析,计算2-ΔΔCT分析miR-199a-5p在各个样本中的表达情况。
1.2.7 激光共聚焦显微镜(Confocal)观察小鼠肝组织中c-Met表达情况
取10 mm×3 mm的新鲜肝脏大叶组织块放入包埋盒中,于中性福尔马林固定液固定,固定24 h后转入75%乙醇中,4 h后再经过常规脱水处理,石蜡进行包埋,然后切片(厚度4 μm)。
将石蜡切片置于60 ℃烤箱中,烤片1 h,脱腊,再进行高压修复抗原10 min,自然冷却至室温,PBS冲洗3遍,5 min/遍,5% BSA在27 ℃下封闭1 h;用PBS 配制一抗,抗体浓度1∶200,4 ℃孵育过夜(12~16 h),PBS冲洗3遍,5 min/遍;用PBS配制荧光二抗,抗体浓度1∶200,避光37 ℃孵育1 h,PBS冲洗3遍,10 min/遍;然后用DAPI复染核5 min,PBS冲洗3遍,5 min/遍,最后使用抗荧光淬灭剂进行封片,激光共聚焦显微镜显微镜下观察并取图。
1.2.8 统计学处理方法
根据所得的实验数据,采用SPSS 18.0软件来进行数据分析,RT-PCR的结果利用Image J软件分析,然后数据都用均数±标准差(¯x ± s)来表示;同时利用单因素方差分析组间数据,以p<0.05判定为有统计学意义。
2 结果与讨论
2.1 小鼠体重变化情况及生化指标检测结果
根据测量小鼠体重变化情况,我们发现,高脂饲料喂养的小鼠体重增长明显高于正常组,差异具有统计学意义,(p<0.01),药物干预之后,小鼠体重增长有所下降,与高脂组比较,差异具有统计学意义,(p<0.05)。结果见表 4。高脂饲料喂养小鼠诱导NAFLD模型,检测结果发现高脂组小鼠血清中TC为10.40±1.30,与正常组(4.79±0.60)相比较其含量明显升高,差异具有统计学意义(p<0.05)。检测 ALT结果显示,高脂组为 49.24±8.47,明显高于正常组(42.90±5.79),差异具有统计学意义(p<0.05),这一结果与文献报道结果一致,达到NAFLD诊断标准[16],提示高脂饮食诱导脂肪肝模型血清结果成立。和高脂组相比,通过药物干预之后小鼠血清中 TC、ALT的水平都是降低的,差异具有统计学意义(p<0.05)。说明木瓜提取物具有降低小鼠血脂、改善肝功能的作用。见图1。

图1 小鼠相关生化指标TC和ALT的检测比较Fig.1 Comparison of serum TC and ALT levels in mice

表4 小鼠体重变化情况Table 4 Changes in body weight of mouse
2.2 HE染色结果
经过组织切片HE染色结果发现,在正常组小鼠肝组织中,其肝细胞形态清晰,排列规则,紧密而均一,肝索以中央静脉为圆心,呈放射状排列。高脂组小鼠肝脏中,肝细胞肿胀,形态模糊,排列紊乱,肝索结构不清晰,并可见明显的脂肪空泡,符合NAFLD的组织病理学改变[17]。
通过正常组和高脂组肝组织情况对比,并结合血清学检测结果,提示非酒精性脂肪性肝病模型成立。另外,与高脂组相比,木瓜提取物低剂量组和高剂量组中可以观察到肝细胞形态较清晰,排列较紧密,脂肪空泡有一定的改善,说明小鼠脂肪肝病理变化有一定的缓解。提示木瓜提取物对小鼠脂肪肝能起到一定的干预作用。这一结果与文献报道结果一致[18]结果见图2。

表5 小鼠肝组织中miR-199a-5p的表达情况Table 5 Expression of miR-199a-5p in mouse hepatic tissues

图2 小鼠肝组织HE染色(200×)Fig.2 Hepatic tissues stained with HE from each group (200×)
2.3 实时荧光定量 PCR检测小鼠肝组织中miR-199a-5p的表达情况

图3 Quantitative Real-time PCR检测小鼠肝组织中miR-199a-5p的表达Fig.3 Expression of miR-199a-5p in mouse hepatic tissues by Quantitative Real-time PCR
miR199a-5p的过表达能够加剧游离脂肪酸(FA)的沉积,并且抑制ATP水平和线粒体DNA(mtDNA)含量,另外,抑制miR199a-5p能部分减轻FA的沉积并增加ATP水平和mtDNA含量,miR199a-5p在肝脏中的脂质代谢,线粒体活性和线粒体β-氧化中起着至关重要的作用[11]。我们通过设计miR-199a-5p的茎环引物经逆转录得到cDNA,以U6为内参,通过实时荧光定量PCR反应检测小鼠肝组织中miR-199a-5p的表达情况,以正常组为标准参照,所得结果见表4和图 3。与正常组相比较,高脂组小鼠肝组织中miR-199a-5p的表达显著上调,差异具有统计学意义(p<0.05),经过药物木瓜提取物的处理后,miR-199a-5p表达相较于高脂组其水平显著降低,差异具统计学意义(p<0.01),这一结果与文献报道结果一致,证实miR-199a-5p对小鼠NAFLD存在调控作用,且木瓜提取物能够降低小鼠肝组织中miR-199a-5p的表达水平,从而参与NAFLD的发生与发展。
2.4 RT-PCR检测小鼠肝组织中HGF、VEGFa和c-Met的表达

在肝损伤过程中,c-Met能够触发对于肝细胞恢复重要的存活信号,肝细胞中c-Met的缺失导致更多的肝细胞损伤和慢性胆汁淤积性肝损伤模型中的纤维化,这一作用是通过HGF/c-Met信号通路介导的[19]。

图4 RT-PCR检测基因HGF、VEGFa和c-Met的表达情况Fig.4 Expression of HGF, VEGFa and c-Met mRNA by RT-PCR
有文献报道称,miR-199a*可靶向 HGF/c-Met信号级联,可以用作HCC的潜在治疗靶标。[20]越来越多的研究表明,miR-199a-5p在NAFLD的发生和发展及肝细胞的再生等过程中存在调控作用。[21]而从我们的实验结果(图 4)中可以看出,与正常组相比,高脂组中HGF、VEGFa和c-Met基因的表达均呈下降趋势,且趋势明显,经过灰度分析结果显示其表达水平明显低于正常组,差异具有统计学意义(p<0.05);经过木瓜提取物干预之后,HGF、VEGFa和c-Met基因的表达与高脂组相比呈升高趋势,趋近于正常组的表达,差异具有统计学意义(p<0.01),这一结果与相关文献结果一致。综合前面结果,与正常组比较,在高脂模型中,小鼠肝组织中miR-199a-5p的表达升高,而HGF、VEGFa和c-Met基因的表达呈明显下降趋势,通过木瓜提取的干预之后,miR-199a-5p的表达下调,HGF、VEGFa和c-Met基因的表达恢复,趋近于正常组,,认为木瓜提取物可能通过 miR-199a-5p调节HGF/c-Met信号通路干预NAFLD的发生与发展。
2.5 激光共聚焦显微镜(confocal)观察小鼠肝组织中c-Met表达情况
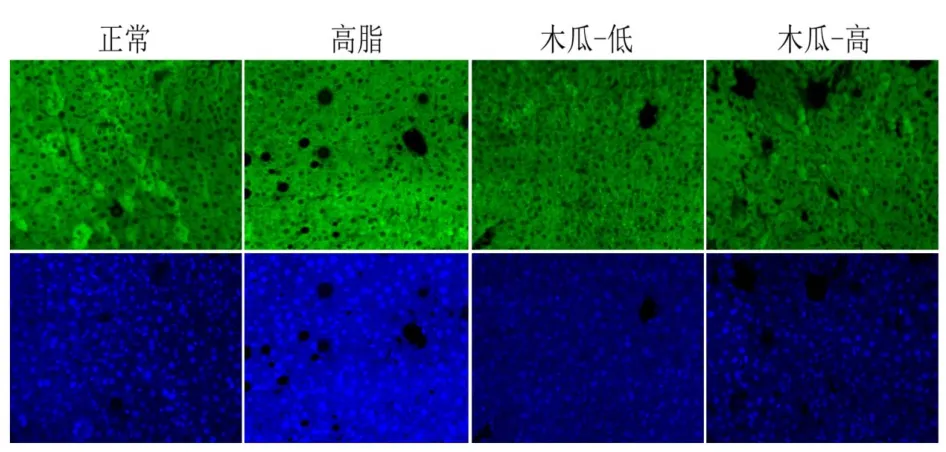
图5 激光共聚焦显微镜观察小鼠肝组织中c-Met蛋白的表达水平(×200)Fig.5 The expression of c-met in each group(×200)
如图5可看出,与正常组相比,高脂组中c-Met蛋白表达水平明显降低,经过药物木瓜提取物干预后c-Met的表达水平是升高的;这一结果与相关基因表达的结果一致,进一步从蛋白质水平显示在高脂模型中c-Met的表达是降低的,通过木瓜提取物的干预之后,c-Met的表达得到恢复,接近正常水平,说明木瓜提取物可能通过抑制 miR-199a-5p的表达来促进c-Met的表达,从而达到改善脂肪肝的作用。
3 结论
3.1 研究发现高脂组的小鼠血清ALT及TC均高于正常组,差异具有统计学意义(p<0.05),HE染色结果显示高脂组肝组织中表现为肝脂肪样变,脂质沉积明显,提示脂肪肝模型建立成功。RT-PCR、Quantitative Real-time PCR和激光共聚焦显微镜检测,与正常组比较,高脂组的miR-199a-5p的水平升高(p<0.05),HGF、c-Met及VEGFa的表达降低(p<0.05),c-Met蛋白表达水平也明显降低;经木瓜提取物的干预后肝脏组织病理学变化明显改善,脂质沉积减少,ALT、TC水平降低(p<0.05),miR-199a-5p的水平明显降低(p<0.01),HGF、c-Met及 VEGFa的表达恢复(p<0.01),接近正常组,c-Met蛋白表达水平也明显升高。
3.2 本研究的结果证实了在 NAFLD模型中,miR-199a-5p表达增加,抑制了HGF/c-Met-VEGFa信号通路,从而抑制肝细胞及血管的再生,造成肝功能的损害;经过木瓜提取物的作用之后,miR-199a-5p的水平降低,相应的HGF、c-Met及VEGFa基因的表达水平得到恢复,肝功能得到缓解。因此,我们认为miR-199a-5p-HGF/c-Met通路介导了脂肪肝的发生与发展,而药物木瓜提取物能够干预这一通路,通过降低miR-199a-5p的表达,使得HGF、c-Met及VEGFa表达增加,改善肝组织的脂质积累,缓解脂肪肝的进程,该实验为木瓜用于NAFLD的预防及治疗提供了一个新的证据。

