基于GC和GC-MS技术检测果酒中的脂肪酸
王儒珍,陆燕,曹建平,唐丽婷
(广东石油化工学院环境与生物工程学院,广东茂名 525000)
果酒中游离脂肪酸对于其风味具有非常重要的影响[1,2]。近年来,由于果酒越来越受到重视,有关果酒中香气成分的研究也较多,但是针对酒品中脂肪酸检测分析的研究较少[3~5]。目前,常用的脂肪酸提取方法有固相萃取和液-液萃取,其中液液萃取法因可通过改变pH环境来控制被萃取酸的去向被广泛应用[6,7]。
脂肪酸是热敏性物质,沸点高,在高温下易发生脱酸、裂解、聚合等副反应造成损失,需将其衍生为甲酯后进行检测。常用的甲酯化方法有碱处理法、酸处理法、重氮甲烷法、三氟化硼法、等方法[8]。其中硫酸-甲醇酯化法因甲酯化效果较好被广泛应用[9]。近年来,用于脂肪酸检测方法主要有气相色谱法(GC)[10]和气质联用法(GC-MS)[11]。气相色谱法有分离度好、检测灵敏度高、分析速度快等优点,但对相对分子质量大、不易挥发的脂肪酸分析存在局限性,且要购买昂贵的标准品对比分析,大大限制了其应用。GC-MS的优势在于有成熟的商品化标准谱图数据库,可对未知化合物进行快速检索和鉴定,但用于定量时步骤较为繁琐耗时。这两种测试方法各有利弊,根据需要选择GC-MS法定性,GC法定量分析,对果酒中脂肪酸含量进行测定[12]。
本研究采用有机溶剂液-液萃取法提取并富集果酒中的脂肪酸,用硫酸-甲醇甲酯化处理,采用GC-MS结合标准品对果酒中的脂肪酸联合定性,并用GC法分析脂肪酸含量。以期通过甲酯化处理,减少长碳链脂肪酸在GC色谱柱中高温裂解情况,从而更全面的检测出果酒中所含脂肪酸种类及含量,为果酒中脂肪酸含量检测方法的标准化提供参考依据。
1 主要材料与方法
1.1 主要试剂及仪器
己酸、庚酸、辛酸、壬酸、癸酸、月桂酸、肉豆蔻酸(色谱标准),上海国药;十五烷酸、软脂酸、十七烷酸、硬脂酸、十九酸、二十四烷酸(色谱标准),Fluka;甲醇、二氯甲烷、正己烷(色谱纯),美国天地;硫酸、盐酸、无水硫酸钠(优级纯),上海国药;桑椹酒、樱桃酒、蓝莓酒、青梅酒、枇杷酒、葡萄酒、荔枝酒、龙眼柠檬酒均为自酿。
GCMS-QPZ100 plus气相色谱质谱联用仪,日本岛津;Agilent 7890B气相色谱仪,美国Agilent;MX5电子天平,美国METTLER TOLEDO。
1.2 标准溶液的配制
1.2.1 工作曲线标液的配制
精确称取一定量的己酸(C6∶0)、庚酸(C7∶0)、辛酸(C8∶0)、壬酸(C9∶0)、癸酸(C10∶0)、月桂酸(C12∶0)、肉豆蔻酸(C14∶0)、十五烷酸(C15∶0)、软脂酸(C16∶0)、十七烷酸(C17∶0,内标)、硬脂酸(C18∶0)、十九酸(C19∶0)、二十四烷酸(C24∶0)于烧杯中,用正己烷溶解并定容至50 mL,配成0.2 mg/mL的混合酸标准溶液。分别移取0.05 mL、0.1 mL、0.2 mL、0.5 mL、1 mL、2 mL混合酸标准于圆底烧瓶,加入2 mL正己烷、2 mL甲醇、1 mL浓硫酸,恒温回流酯化。冷却后加入2 mL正己烷,转入试管并加入2 mL去离子水,振摇,静止分层后取上层有机相1 mL上机测试。
1.2.2 内标溶液的配制
精确称取一定量十七烷酸,用正己烷溶解并定容至50 mL,配成1.0 mg/mL的内标溶液。准确量取100 μL、1.0 mg/mL内标溶液入圆底烧瓶,加入2 mL正己烷、2 mL甲醇、1 mL浓硫酸,恒温回流酯化。冷却后加入2 mL正己烷,转入试管并加入2 mL去离子水,振摇,转移有机相,水相用2 mL正己烷萃取两次,合并有机相过无水硫酸钠,留过滤液,用氮吹仪浓缩,定容至2 mL。将上述溶液用正己烷依次稀释到2、4、8、20、100倍几个数量级,配制成不同梯度浓度的内标溶液上机测试。
1.3 样品处理
1.3.1 脂肪酸的提取
取 10 mL 酒样,加入 30 μL 1.0 mg/mL C17∶0内标溶液,振荡,用10%氢氧化钾溶液调pH值大于12,加入正己烷-二氯甲烷(2∶1)溶液6 mL,振荡5 min,超声辅助分层,弃去有机相,保留水相,重复萃取 3次。
水相用10%盐酸溶液调pH值小于2,再加入正己烷-二氯甲烷(2∶1)有机溶液6 mL萃取,振荡5 min,超声辅助分层,收集有机相,如此萃取3次,合并有机相。
1.3.2 脂肪酸的酯化
在上述收集的有机相中加入5 mL去离子水,反萃取2次,弃去水相,有机相过无水硫酸钠(500 ℃煅烧2 h)柱,转入圆底烧瓶(加沸石),加入2 mL甲醇、1 mL浓硫酸于水浴回流酯化处理一点时间后,取下烧瓶,冷却后转入50 mL分液漏斗,加入2 mL去离子水,振摇,弃水相,保留有机相,如此重复两次,有机相过无水硫酸钠柱后,用氮吹仪浓缩至 0.5 mL,备GC和GC-MS进样。
1.4 仪器分析条件
1.4.1 GC分析条件
色谱柱HP-5(30 m×0.32 mm×0.25 μm);进样口温度:280 ℃;检测器FID温度:310 ℃;起始柱温50 ℃(保持2 min),以10 ℃/min的速率升至200 ℃后;再以5 ℃/min升至290 ℃(保持5 min);载气:N2,流量1.0 mL/min;空气流量:400 mL/min;氢气流量:30 mL/min;尾吹流量:20 mL/min。
1.4.2 GC-MS条件
色谱柱 Rxi-5siLMS(30 m×0.25 μm×0.25 μm);无分流进样;无分流时间0.8 min;进样口温度280 ℃;起始柱温50 ℃,以10 ℃/min的速率升至200 ℃后;再以5 ℃/min升至290 ℃(保持5 min)。离子源温度200 ℃;接口温度250 ℃;溶剂切割时间2 min;EI电离源;能量70 eV;扫描方式Scan。
1.5 游离脂肪酸的测定
1.5.1 定性分析
在最佳仪器条件下,采用GC-MS测试经甲酯化处理后的脂肪酸标准品或果酒样品,根据脂肪酸标准的总离子流谱图,结合GC-MS谱库检索对测试酒样中的脂肪酸组分进行定性分析。
1.5.2 定量分析
在最佳仪器条件下,采用GC测试经甲酯化处理后的脂肪酸标准混合样品系列,绘制工作曲线。结合GC-MS定性分析结果,采用外标法结合内标法对果酒样品进行定量分析,利用工作曲线进行相应脂肪酸的含量计算。
1.6 数据统计分析
实验数据采用origin 8.0作图,Excel 2016处理分析。
2 结果与讨论
2.1 前处理条件的优化
2.1.1 甲酯化温度

图1 甲酯化温度对果酒中脂肪酸分析结果的影响Fig.1 Effect of methyl esterification temperature on the analysis of FAs in fruit wine
取混合酸标准溶液1 mL(共5份),在不同甲酯化温度条件下,按“1.3”进行样品前处理;在最佳仪器条件下,采用GC进行测试,考察甲酯化温度对检测结果的影响。结果见图1。
由图1可见,甲酯化温度在50~90 ℃变化时,C6∶0至 C12∶0检出的峰面积变化不大;而 C14∶0至 C24∶0的峰面积在甲酯化温度70~80 ℃之间明显增大。各个脂肪酸的峰面积都相对较大。这可能是由于脂肪酸的甲酯化反应是一个吸热的可逆反应过程[13]。升温有利于提高脂肪酸的甲酯化效率;当反应温度达到80 ℃时,甲酯化效率最好;此后继续提升反应温度,体系中脂肪酸的脱羧及其它副反应增强,致使正向反应速率降低,甚至发生逆反应。综合分析,选择脂肪酸甲酯化温度为80 ℃。
2.1.2 甲酯化时间
取混合酸标准溶液1 mL(共5份),在不同甲酯化反应时间条件下,按“1.3”进行样品前处理,甲酯化温度为80 ℃;在最佳仪器条件下,采用GC进行测试,考察甲酯化时间对检测结果的影响。结果见图2。

图2 甲酯化时间对对果酒中脂肪酸分析结果的影响Fig.2 Effect of methyl esterification time on the analysis of FAs in fruit wine
由图2可知,当甲酯化反应时间在10~60 min范围内变化时,C6∶0至C10∶0的脂肪酸的峰面积响应值变化不大,而C12∶0至C24∶0的脂肪酸的峰面积响应值在甲酯化反应时间为40 min内,上升幅度较大,此后延长反应时间,各物质的峰面积响应值上升趋势并不明显。这可能是由于反应时间对短碳链脂肪酸的甲酯化效率影响不大,反应时间较少时,C12∶0以上脂肪酸甲酯化不完全,因此,选择甲酯化时间为40 min。
2.1.3 前处理方法的优化
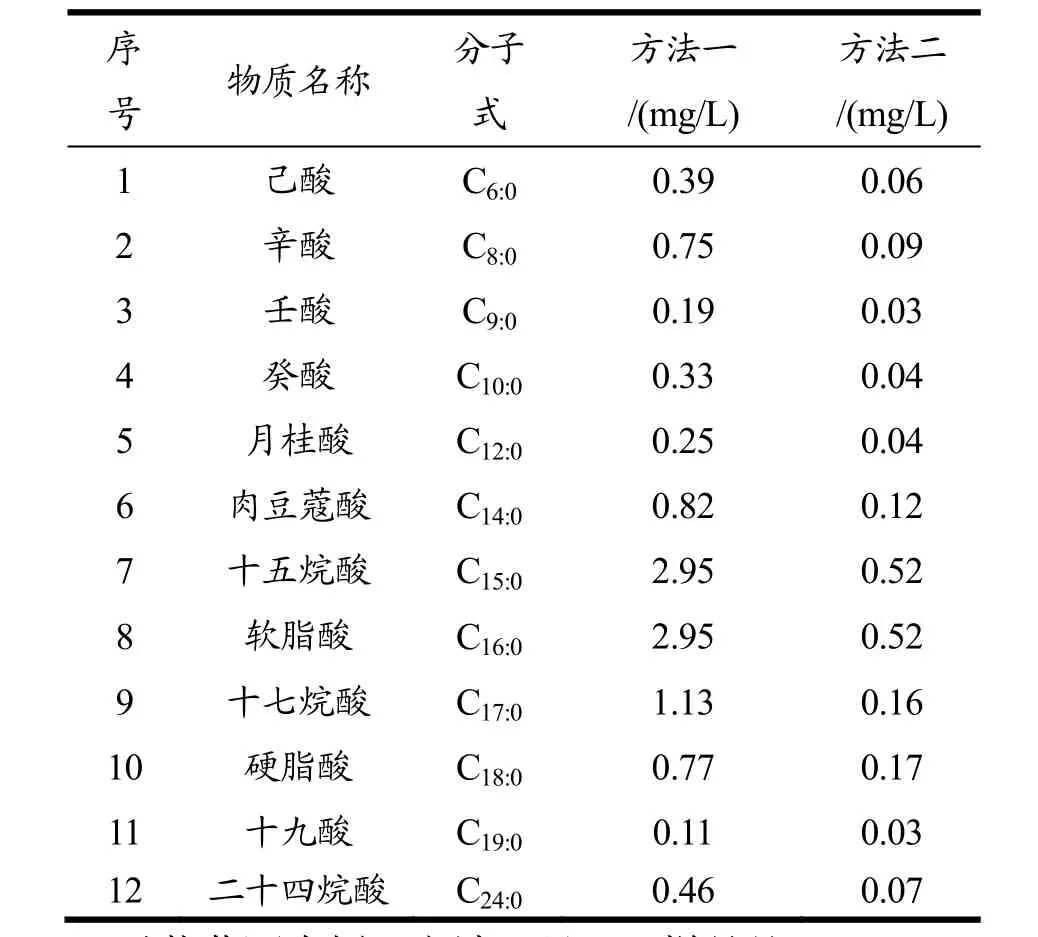
表1 前处理方法对果酒中脂肪酸分析结果的影响Table 1 Effect of pretreatment methods on FAs analysis in fruit wine
以蓝莓酒为例,方法一见“1.3样品处理”。
方法二:取4 mL酒样,加入10 μL 1.0 mg/mL内标溶液,混匀后用10%盐酸溶液调pH<2.0,用6 mL正己烷-二氯甲烷(2∶1)溶剂连续萃取3次,振荡5 min结合超声辅助分层,留有机相。水相用10%氢氧化钾溶液调pH>12.0后,用6 mL正己烷-二氯甲烷(2∶1)连续萃取三遍,超声辅助分层,水相用 10%盐酸调pH<2.0后,再用6 mL正己烷-二氯甲烷(2∶1)连续萃取3次,超声辅助分层后合并有机相。其余处理步骤同方法一。采用气相色谱仪检测,对比两种方法前处理后各脂肪酸的含量(此处仅取检出的几种脂肪酸进行比较),结果见表1。由表1可知,采用方法一萃取的果酒中脂肪酸含量测试结果远高于方法二。这可能是由于水相的pH值影响萃取平衡[14]。方法一先采用KOH碱性溶液萃取,使更多的脂肪酸呈解离态,以减缓后续衍生化反应的剧烈程度,避免剧烈反应放热对游离脂肪酸的破坏。
2.2 线性范围及检出限
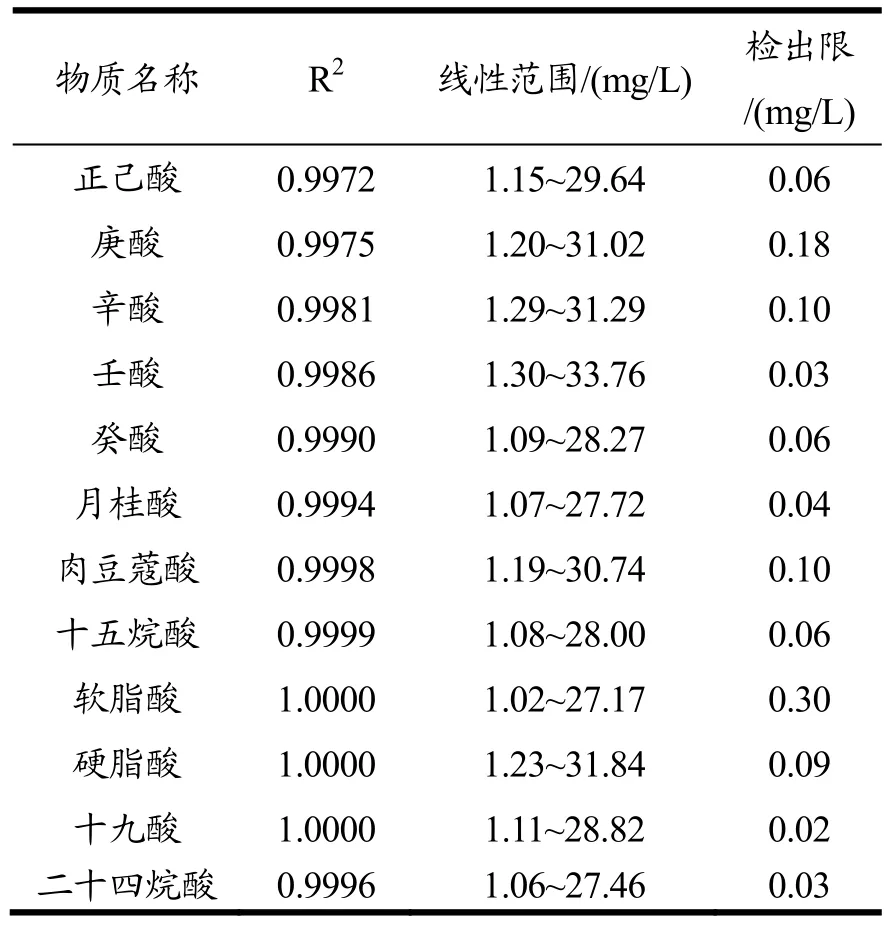
表2 果酒中脂肪酸的方法检出限及线性范围Table 2 Detection limit and linear range of FAs in fruit wine
在最佳仪器条件下,采用GC测试“1.2.1”节制备的标准工作溶液,绘制工作曲线,并取空白溶液,连续测定11次,根据LOD=3*σ/S计算检出限。结果见表2。
2.3 精密度与准确度
取10 mL果酒样品,按照方法一进行前处理,在最佳仪器条件下测试,以内标法结合外标法进行定量分析(加入内标的量为1.0 mg/L,加标量见表3),计算各脂肪酸含量,并计算相应的标准偏差及回收率。结果表明,该方法分析各脂肪酸含量的RSD均在5.0%以下,平均回收率均大于 87%(87.3%~110.6%),该方法有较好的准确度及精密度。详细结果见表3。
2.4 果酒中脂肪酸定性定量分析
取8种果酒样品,在最佳前处理条件下,经过萃取浓缩和甲酯化处理后,用GC-MS和GC结合内标法和外标法对其中的脂肪酸进行定性和定量分析(由于标准品昂贵,部分脂肪酸参照邻近脂肪酸的定量参数,采用内标法进行定量分析)。分析结果见表4。
由表4可知,8种果酒中共检出28种脂肪酸,各果酒中所含脂肪酸的种类相近,其中,软脂酸的含量相对较高,且其含量在各果酒脂肪酸总量中所占比例皆在25%左右。
8种果酒中桑椹酒中检出的脂肪酸总量最高,达78.21 mg/L。这可能是由于桑椹果中所含某些功能性成分的量较其他几种水果稍多。此外,采用原料不同以及酿造过程中,选用的酵母的微生物种群、生产工艺上的差异,也是导致各种果酒中脂肪酸含量差别较大的重要因素。
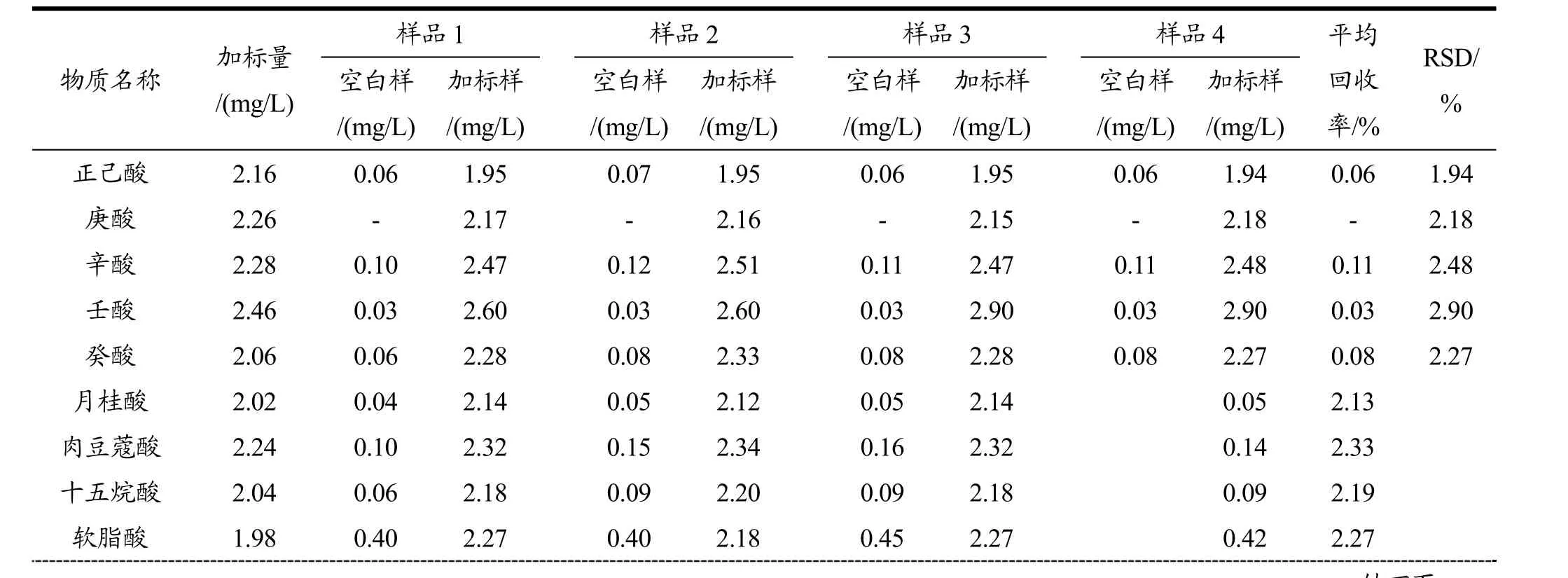
表3 果酒中脂肪酸的平行试验及回收率Table 3 Thereplicate measurements and recoveries of FAs in fruit wine

硬脂酸 2.32 0.09 2.45 0.11 2.42 0.11 2.45 0.10 2.44十九酸 2.10 0.02 2.24 0.02 2.24 0.03 2.24 0.03 2.31二十四烷酸 2.00 0.03 1.80 0.05 1.80 0.05 1.80 0.05 1.81
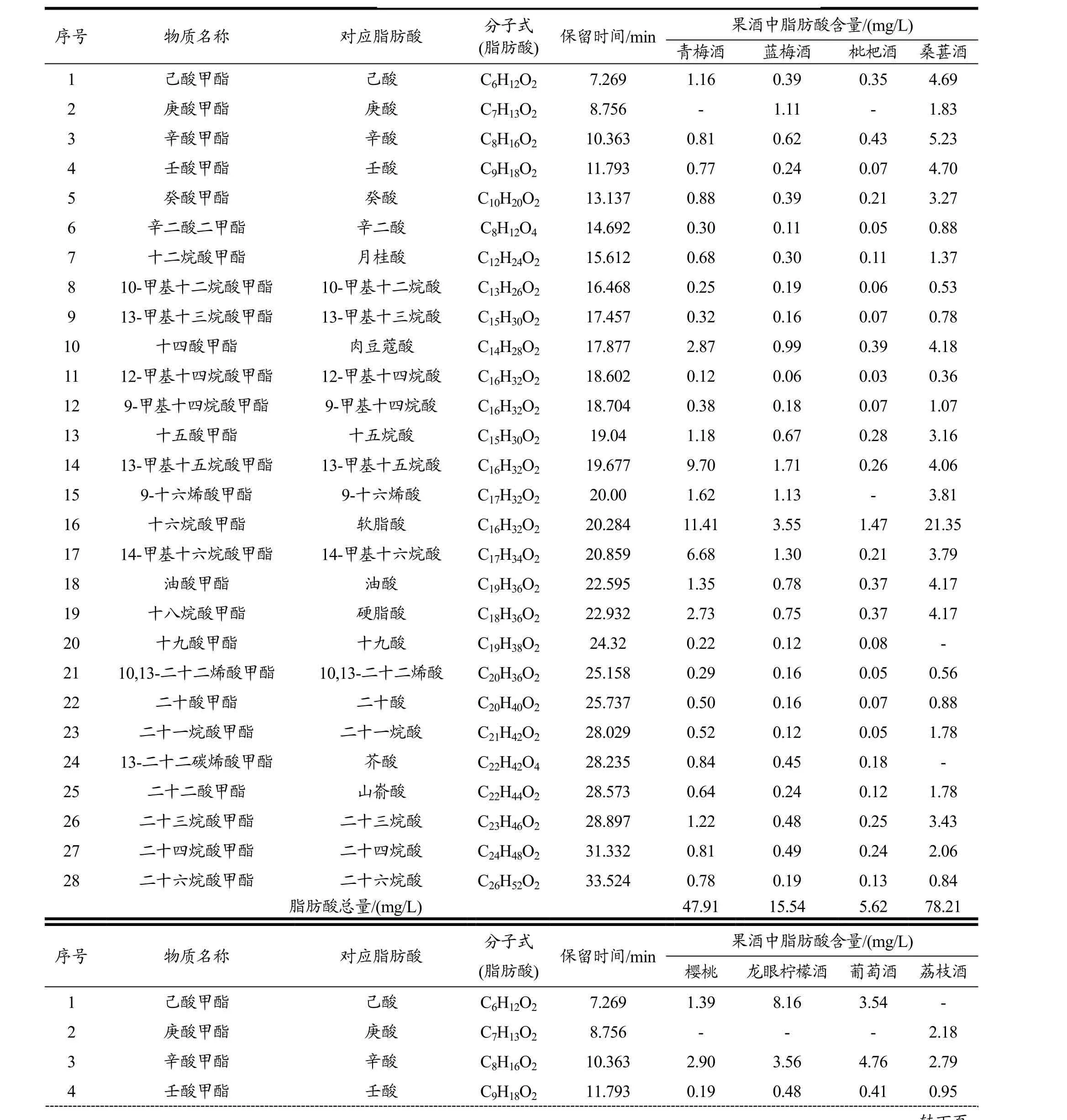
表4 8种果酒中脂肪酸含量分析结果统计Table 4 Statistical analysis of the results of FAs content in eight kinds of fruitwine
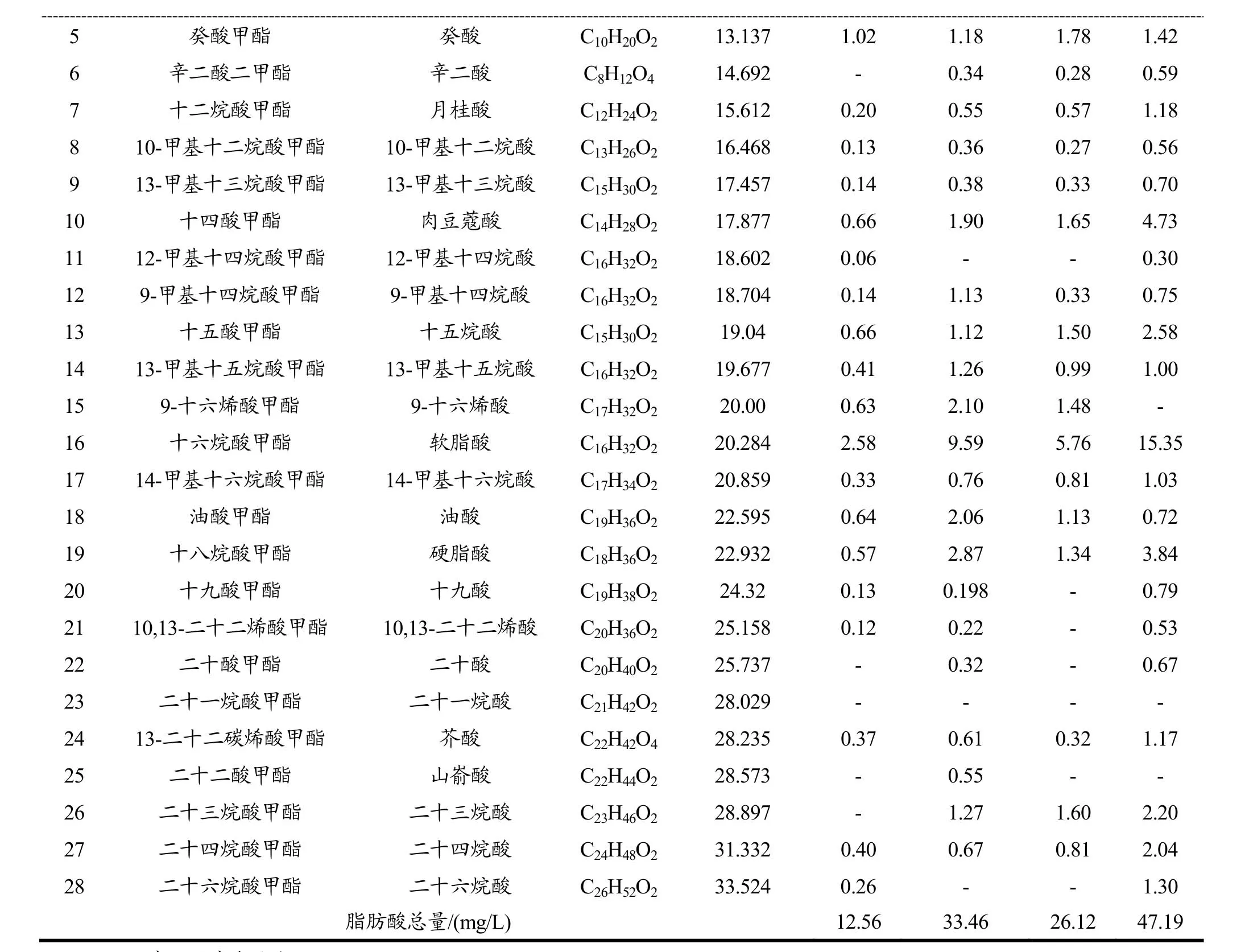
注:“-”表示没有未检出。
3 结论
采用有机溶剂液-液萃取方法提取和富集 8种果酒中的脂肪酸,并优化了萃取处理方法,用硫酸-甲醇法甲酯化处理。采用GC-MS结合部分脂肪酸标准品对8种果酒中的脂肪酸进行定性分析,用GC测量,内标法结合外标法进行定量分析。结果表明,该方法具有较好的准确与精密度,满足检测要求。此外,样品通过碱性条件萃取,经甲酯化处理后,有效减少了长碳链脂肪酸在高温下裂解的情况,能更全面的检测出果酒中脂肪酸的种类及含量。

