羊乳制品中牛乳成分的荧光定量PCR检测方法研究
宋宏新,刘建兰,徐丹,徐秦峰
(陕西科技大学 食品与生物工程学院,陕西 西安,710021)
与牛乳相比,羊乳风味独特,营养素组成更平衡,脂肪球小,更利于人体吸收[1]。羊乳价格远远高于牛乳,在经济利益的驱动下,不法分子会在羊乳产品中掺入牛乳,甚至用牛奶粉冒充羊奶粉。乳制品掺假的安全性检测是保障消费者权益的重要手段[2]。
目前关于羊乳中掺入牛乳源性成分的检测多是以乳中含量较高的脂肪和蛋白质为检测目标[3],常用方法有光谱检测技术[3]、色谱技术[5]、免疫学技术[6]、电泳技术[7]等。光谱技术几乎无需对样品预处理且容易操作,但需要建立复杂的模型,难以推广使用[8]。色谱技术依据牛羊乳脂肪差异成分的稳定性不足,需要进一步探究[9-10]。免疫学技术易发生假阳性且抗体不易保存[11],蛋白质电泳技术由于热加工引起的蛋白质变性损失较大,检验掺假成分的准确性难以保证[12]。由于DNA的种属特异性以及对食品加工具有更好的稳定性,基于DNA水平的PCR检测方法可以克服以上技术的不足,被越来越多地应用于乳制品的掺假鉴别检测中。已有的报道通常采用琼脂糖凝胶电泳[13-14]和实时荧光检测法[15]鉴定牛属PCR扩增产物是否存在,用于确定羊乳制品是否含有牛乳成分。相比于凝胶电泳检测,实时荧光法不仅操作简单快捷、样品通量高,还避免了开盖带来的污染,然而大多数实时荧光法采用的是探针法[1, 9, 16-17],需要对不同的靶序列合成不同的探针,原料成本较高。
本研究旨在利用经济实惠的DNA结合染料,建立基于染料的实时荧光PCR法用于羊乳制品中牛乳成分的掺假鉴别检测。通过磁珠法提取牛羊乳及其制品中的DNA,以牛羊的线粒体12S rRNA基因的保守序列为靶基因设计合成两对特异性引物进行实时扩增和检测,最后用熔解曲线来确认PCR扩增反应的特异性,具有快速、省时、成本低、灵敏度高的特点。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
鲜牛乳样品采自西安市未央区草滩奶牛场;鲜羊乳采自陕西省富平县金牛乳品公司;鲜乳于-20 ℃保存备用,以此作为通用性及特异性的检测。其他液态乳、全脂奶粉、脱脂奶粉及配方奶粉等市售奶类多个品牌的样品购自西安市不同的超市,用于验证方法的实际应用价值。
模拟掺假样品的制备:以鲜羊乳中分别掺入50%、10%、5%、2.5%、1%、0.5%和0.1%的新鲜牛乳的新鲜羊乳为模拟掺假样品。
1.1.2 主要仪器与试剂
仪器:实时荧光定量PCR仪(Qtower 2.2),德国耶拿公司;紫外可见分光光度计(Agilent Cary 5000),安捷伦科技有限公司;琼脂糖水平电泳仪(DYCP-31DN),北京六一生物科技有限公司;电泳图像分析系统(FR-980A),上海复日科技有限公司。
试剂:PCR引物,上海生工生物工程有限公司合成;2×Super Real Pre Mix PCR Mix Plus(含SYBR Green I染料)、磁珠法血液基因组DNA提取试剂盒均购自天根生化科技(北京)有限公司;DNA Marker,购自赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 脱脂样品的制备
采用黎颖等[14]对乳的除脂方法,并略有修改。取10.0 mL解冻混匀样品于Eppendorf管中(固体乳粉则称量40.0 mg,溶于10.0 mL蒸馏水中,混匀,静置24 h使其充分复原),在4 ℃ 5 000×g离心30 min,弃去上层乳脂后将乳混匀,10 000×g离心15 min,再次除去上层乳脂,如此重复2次,弃去上清液,保留最底部的沉淀,用2 mL的PBS缓冲液溶解悬浮,10 000×g离心10 min,如此重复3次。将最后所得沉淀溶于500 μL PBS缓冲液中悬浮(固体样品最终溶于200 μL PBS缓冲液中),备用。
1.2.2 DNA的提取及质量浓度的测定
取脱脂后的样品400 μL加至1.5 mL Eppendorf管中,首先加入40 μL Proteinase K和600 μL裂解液在65 ℃下反应15 min,用以消化蛋白、裂解细胞并灭活细胞内核酸酶;随后加入700 μL异丙醇以去除多糖和杂蛋白释放核酸,进而加入40 μL磁珠悬浮液特异性吸附核酸;磁分离后分别加入1.4 mL缓冲液和1.4 mL漂洗液充分清洗磁珠去除蛋白质等杂质和纯化核酸;最后用洗脱缓冲液60 μL将DNA从磁珠上洗脱,转移至一个新的离心管中,并于4 ℃保存。通过测定鲜牛乳、鲜羊乳DNA提取液在260 nm处的吸光度值,经计算可得模板DNA的质量浓度分别为0.963 μg/mL和0.872 μg/mL。
1.2.3 引物的设计
采用Primer Premier 6.0引物设计软件,经BLAST比对后选取保守区域设计不同牛羊源性引物。引物序列见表1。
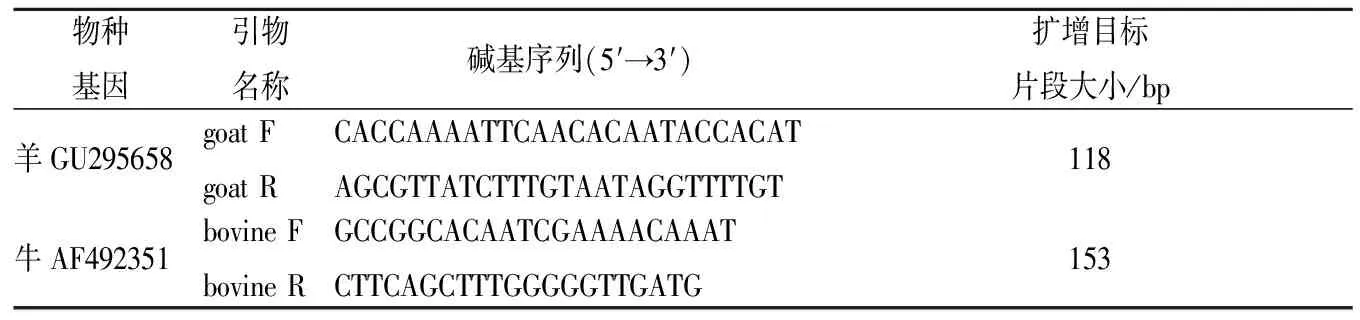
表1 本实验中PCR扩增引物序列Table 1 Oligonucleotides used as PCR primers
1.2.4 荧光定量PCR反应
对退火温度、引物浓度以及循环数等实验条件进行了优化,荧光定量PCR反应溶液确定为牛或羊的上下游引物各0.5 μL (10 μmol/L),10 μL 2×Super Real Pre Mix PCR Mix Plus,2 μL模板DNA,超纯水补至20 μL;PCR反应程序为,95 ℃预变性15 min,95 ℃变性30 s,59 ℃退火60 s,72 ℃延伸60 s,35个循环;72 ℃后延伸5 min。
1.2.5 琼脂糖凝胶电泳
取荧光定量PCR扩增后产物6 μL,加入0.5 μL SYBR Green染料(100×)和1 μL 6×上样缓冲液,混匀为待测样品。配制2.5%琼脂糖凝胶,调整电泳仪电压至100 V,电泳约60 min,置电泳图像分析系统观察结果。
2 结果与讨论
2.1 乳DNA中牛、羊源性成分的特异性检测
选取线粒体12S rRNA基因设计牛、羊的特异性引物,主要是因为线粒体DNA在物种间的变异大,并且其在细胞中的拷贝数多于核基因组DNA[18-19]。此外,考虑到乳品加工处理对DNA的降解,目的基因扩增片段均小于200 bp。以使用磁珠从牛、羊乳中提取的DNA作为模板,分别加入牛羊特异性引物,进行荧光定量PCR扩增实验(图1-a)。
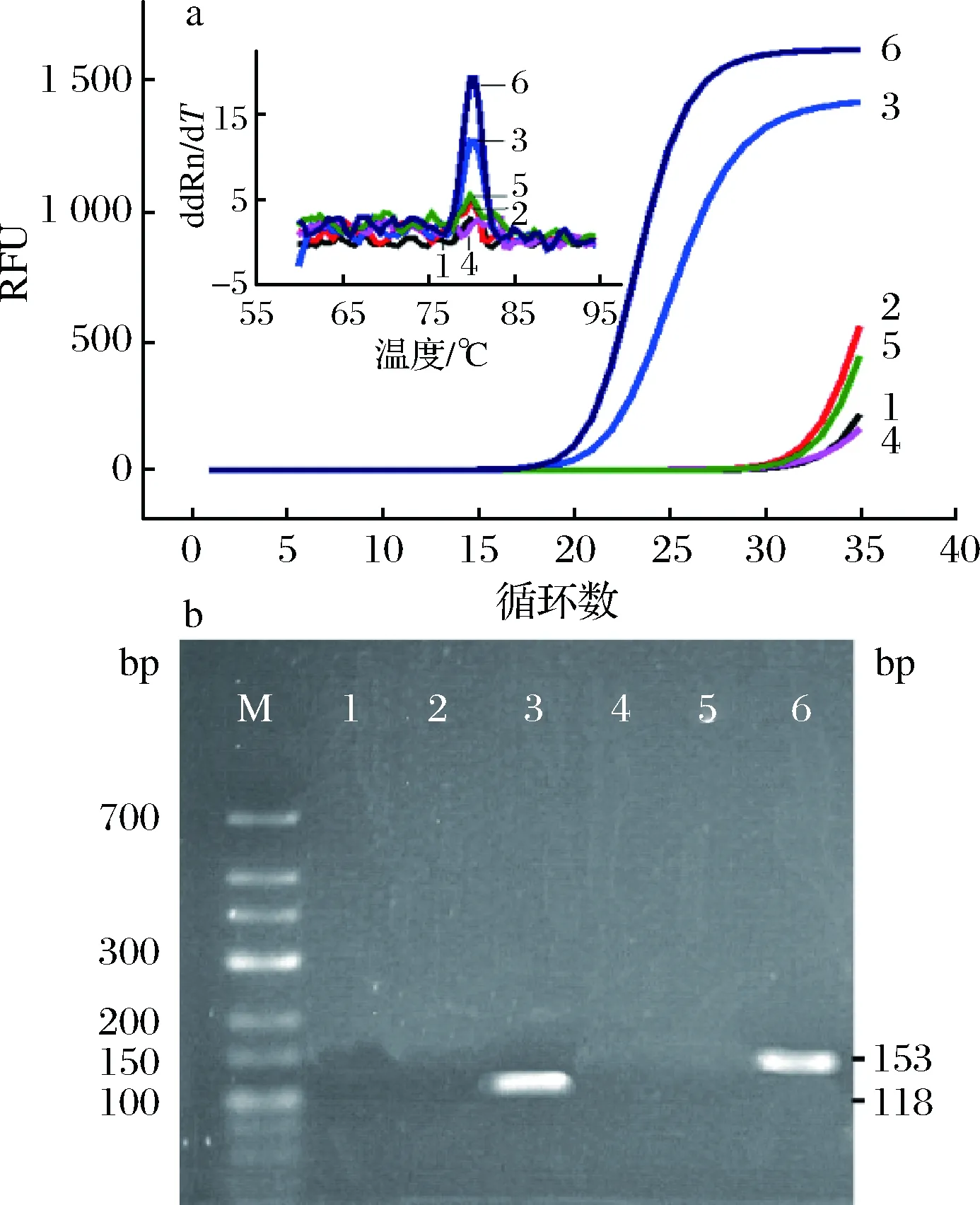
a-荧光定量PCR;b-琼脂糖电泳;1-羊引物;2-羊引物+牛乳DNA;3-羊引物+羊乳DNA;4-牛引物;5-牛引物+羊乳DNA;6-牛引物+牛乳DNA;M-DNA Marker图1 牛、羊引物特异性的验证Fig.1 Verification of specificity of bovine and goat primers using real time PCR (a) or gel electrophoresis (b)
实验结果表明,只有在牛引物中加入牛模板、羊引物中加入羊模板才能观察到明显的实时荧光PCR扩增曲线(曲线6和曲线3),而没有模板或者交叉加入模板时均无明显的扩增信号,具体到Ct数值上它们之间均相差10个以上(Ct值分别为30.59和31.21),说明设计的引物对于牛羊源性检测具有较好的特异性。根据DRUMMOND等[9]对乳制品掺假的研究,无模板DNA的Ct值在高于31时,判定为无交叉反应,即为阴性。对比该研究,图1中,可以发生交叉反应之前的Ct值可以作为掺假检测的判定方式,即Ct值小于30,为阳性结果,反之,则为阴性。由于DNA结合染料SYBR Green I能够结合所有的双链DNA,我们进行了熔链曲线分析,以确认扩增产物的特异性。实验结果表明,PCR扩增中并无引物二聚体以及其他非特异的反应产物(图1-a插图)。进一步的凝胶电泳结果显示,只有牛、羊乳DNA中分别加入牛、羊特异性引物才出现明显的扩增条带(图1-b 泳道6和3),与实时荧光PCR实验结果一致;并且牛羊PCR片段大小分别为153 bp和118 bp,与预期符合,从而验证PCR扩增出了特异性片段。此外,PCR扩增DNA序列的正确性也通过测序进行了验证(测序结果未给出)。初步的实验结果验证了牛、羊引物的特异性,因此所建立的基于DNA结合染料(SYBR Green I)的实时荧光定量PCR方法,可以用于乳DNA中牛、羊源性成分的特异性检测。
2.2 荧光定量PCR对牛、羊乳DNA检测的灵敏度
为了确定实时PCR方法能够检测到的牛、羊乳DNA最低含量,以及计算PCR扩增反应的效率,将提取出牛羊乳DNA稀释成一系列浓度梯度进行荧光PCR实验。实验结果如图2所示,牛、羊源性DNA成分检测分别能达到10-5和10-4模板稀释度,表明检测体系具有较高的检测灵敏度和较宽的动态范围。进一步计算可得牛、羊乳DNA检测体系PCR扩增效率分别为90.7%和103.9%,均在理想扩增效率90%~105%,且线性相关系数R2>0.98[20],表明PCR引物设计合理,实时PCR扩增实验在优化的反应条件下具有较好的重复性和适用性。
为了验证方法的应用性,将牛乳DNA分别以0.01%,0.05%,0.1%,1.0%,10%,50%的比例掺入到羊乳DNA中。当牛乳DNA含量低至0.05%时,实时荧光定量PCR体系仍有明显的特异性扩增信号(图3-a),说明本方法对牛乳DNA掺入羊乳DNA的掺假检测限为0.05%。
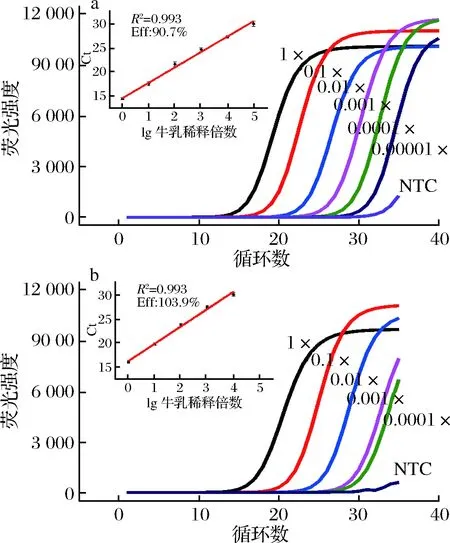
a-牛乳DNA;b-羊乳DNA图2 牛羊乳DNA检测的实时荧光PCR曲线和线性范围Fig.2 Quantitation profiles and linearity (inset) of the real-timePCR assays for bovine (a) and goat (b) DNA extracts
2.3 模拟羊乳样品中牛乳掺入比例检测
考虑羊乳制品掺假市面上多直接将牛乳掺入羊乳的情况,为了精确判定其检测的最低限值并确认该方法对产品的实际应用性,故羊乳预先以不同比例混入牛乳设定为实际模拟掺假样品。实验结果如图3-b所示,最低能检测出掺入2.5%牛乳的模拟掺假样品,明显低于牛羊乳DNA直接混合的检出限,这是因为乳体系的复杂性和乳体细胞分布的不均匀性,在乳直接混和及提取DNA时会有部分的损失。尽管最低检出限高于采用探针法的实时荧光定量PCR方法[14, 21],但是基于荧光染料的实时PCR方法检测成本更低,并且实际生产中从利润与风险的综合因素考虑,掺假牛乳比例一般高于5%才有可观的经济利益,因此本方法满足实际样品的检测需要。
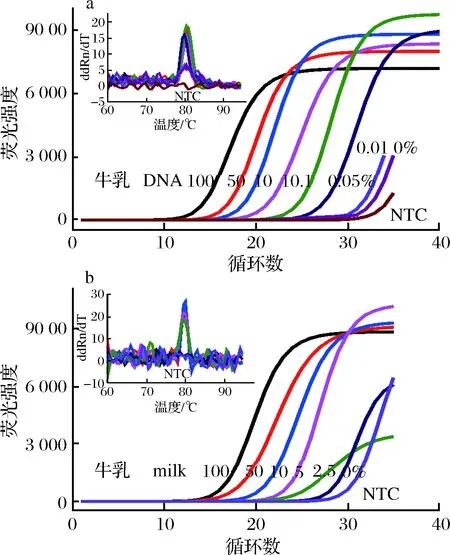
a-乳DNA混合样品;b-乳混合样品图3 羊乳中牛源性成分的荧光定量PCR检测Fig.3 Real-time PCR detection of ingredients derived from bovine in goat milk注:图a中牛羊乳DNA比例分别为100%,50%, 10%, 1.0%,0.1%,0.05%,0.01%和0%;图b中牛羊乳比例分别为100%,50%,10%,5%,2.5%和0%。
2.4 市售羊乳制品中羊、牛源性成分的同时鉴定
为了验证方法的实用价值,使用纯羊奶粉与纯牛奶粉分别作阳性和阴性对照,选取市售不同品牌的全脂奶粉、脱脂奶粉、淡奶粉及婴幼儿配方奶粉等11个羊奶粉样品,分别以牛、羊特异性引物对这些样品的羊、牛源性成分进行检测。由图1的判定结果结合图3的检出限以及表2的对照样品的Ct值,结果显示,8个纯羊乳样品中,仅样品2、5、8显示了与标签一致的纯羊乳;样品1、6、7则显示了几乎为纯牛乳,与标签不符;其余样品则显示了在羊乳中不同程度的掺入牛乳成分。尽管在配方奶粉中是允许加牛乳清粉,但是样品11则显示了几乎没有羊乳的片段扩增出来,与标识的主成分不相符。因此,所建立的实时荧光PCR方法可以检测出市售羊乳制品中牛乳源性掺假的商品。此外,从荧光定量PCR对于羊乳制品DNA的检测也可以看出,奶粉经过均质、巴氏杀菌、喷雾干燥等一系列的加工操作,说明DNA在高温高压处理下依然能够稳定存在[22-23],且由于选取DNA片段较小,不易受加工变化而造成损失[24],与之相比蛋白质标志物则有明显降解[25],因此以DNA差异作为羊乳掺假鉴别检测的基本依据,其准确性更高。
3 结论
本论文依据牛羊线粒体基因的差异设计了特异性引物,建立了快速鉴别羊乳掺假的实时荧光定量PCR方法,并成功的应用于市售羊乳制品的鉴别检测。以线粒体12S rRNA保守序列设计的引物PCR特异性好,避免了交叉反应及假阳性现象的发生,且扩增DNA片段较小不易受加工影响。以不同比例纯DNA混合掺比,最低可检测达0.05%的牛乳掺入比例,说明该方法的灵敏度高,可行性好。商业掺假从利润与风险的综合因素考虑,以5%掺假为阈值,本方法可以检测出掺入2.5%牛乳的羊乳比例,满足羊乳制品掺假检测的实际需要。与采用凝胶电泳检测扩增产物用于羊乳掺假检测的PCR方法相比,基于染料的荧光实时PCR方法减少开盖造成的PCR污染风险,并且操作简单、快速、样品通量高;与采用探针法的荧光实时PCR方法相比,DNA结合染料成本低,不需要为待检的靶序列设计合成昂贵的标记探针。通过对市售羊乳及其制品中掺假牛乳成分的检测,证明该方法可以适应鲜羊乳原料、加工液态乳及各种乳粉,方法的适用性好,可以食品质量监督检验部门对于羊乳掺假牛乳检测提供一定的技术参考。
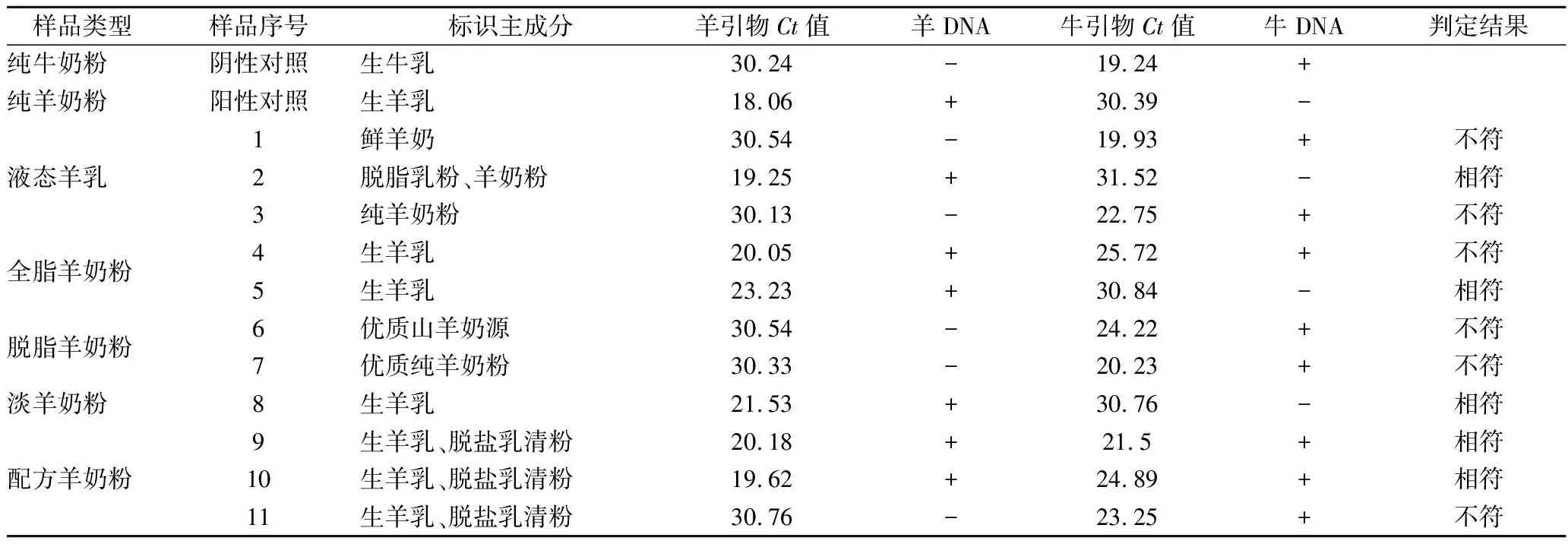
表2 市售羊乳制品中羊、牛乳成分的荧光定量PCR检测Table 2 Identification of goat and bovine milk components in goat dairy products using real-time PCR
注:以Ct=30作为判据,<30表示该DNA成分检出,记为+;>30表示该DNA成分未检出,记为-。

