微生物葡萄糖氧化酶的研究进展
廖兆民,蔡俊,林建国
(湖北工业大学 生物工程与食品学院,发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,工业微生物湖北省重点实验室,湖北 武汉,430068)
对葡萄糖氧化酶(glucose oxidase,E.C.1.1.3.4,GOD)的研究可追溯到1928年MULLER等人从黑曲霉和灰绿青霉的无细胞提取液中分离出一种脱氢酶,将其命名为葡萄糖氧化酶[1]。之后COULTHARD[2]、ROBERTS[3]、KOCHOLATY[4]等人均从青霉菌中分离出一种抗菌剂,仅在葡萄糖作用下才具有杀菌效果,1963年发现这些抗菌剂与MULLER发现的葡萄糖氧化酶是同一类酶[5]。葡萄糖氧化酶的应用十分广泛,特别是在饲料工业和食品工业上,20世纪末我国成立GOD研究协作组,对其展开了系统的研究,主要集中在产酶菌株的筛选、发酵条件的优化、酶的分离纯化及酶学特性等研究,由于国内研究工作起步较晚,目前我国生产的工业酶制剂纯度低、成本高且稳定性差,现阶段主要利用基因工程技术对产酶菌株进行改良。本文主要综述产GOD微生物来源,着重介绍了高产GOD工程菌选育的研究进展和微生物GOD的应用,以期为微生物氧化酶的开发和高效利用提供理论依据。
1 葡萄糖氧化酶概述
1.1 葡萄糖氧化酶的理化性质
葡萄糖氧化酶是一种黄素蛋白,是分子质量约为130~170 kDa的同型二聚体,含有两个黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)结合位点及约11%~13%的高甘露糖型糖基化部分。GOD属于葡萄糖/甲醇/胆碱氧化还原酶家族,与家族中其他成员具有相同的结构骨架[6]。高纯度的GOD为淡黄色粉末,易溶于水,不溶于甘油、氯仿、乙醚等[7]。GOD的吸收光谱最大值为278、382和452 nm,且在紫外光下无荧光。固体GOD酶制剂在低温下能长期保存,-15 ℃能保存8年。GOD溶液的稳定性取决其pH值,在pH值2以下及pH值8以上,催化活性迅速丧失,pH值在5.0左右最稳定[8]。GOD的作用温度为30~60 ℃,最适温度在55 ℃左右,30 ℃以下及60 ℃以上时,催化活性低于最适酶活的50%。非离子表面活性剂对GOD的影响很小,阴离子表面活性剂如十二烷基硫酸钠(sodium dodecyl sulfate,SDS)在低pH下使GOD失活,阳离子表面活性剂如十六烷基溴化铵在高pH下使GOD失活[9]。GOD抑制剂包括氯甲基苯甲酸酯,Ag+, Hg2+, Cu2+,羟胺,肼,苯肼,二甲酮和硫酸氢钠。GOD诱导剂包括葡萄糖、碳酸钙、巯基乙酸、葡萄酸、乙二胺四乙酸和一些金属离子如Zn2+、Fe2+、Mn2+、Co2+等[10]。NAKAMURA 和FUJIKI[11]对黑曲霉和青霉的GOD进行了比较研究,发现他们的分子质量分别为152 kDa和150 kDa。这两种菌株产生的GOD具有相似的碳水化合物成分,均主要由葡萄糖、甘露糖和氨基己糖构成。黑曲霉GOD比青霉GOD含有更多的甘露糖和氨基己糖,但葡萄糖却相对较少。黑曲霉GOD和青霉GOD中的总碳水化合物含量分别为16%和11%。两种酶的氨基酸含量表明黑曲霉含有更多的组氨酸、精氨酸和酪氨酸,青霉则含有更多的赖氨酸和苯丙氨酸。
1.2 葡萄糖氧化酶的作用机制
GOD利用分子氧作为电子受体,催化β-D-葡萄糖上的第1个羟基,氧化成D-葡萄糖酸-δ-内酯,同时产生H2O2,两种产物最终都会自发地催化分解。D-葡萄糖酸-δ-内酯随后会被内酯酶缓慢水解成D-葡萄糖酸(gluconic acid,GA),产生的H2O2会被过氧化氢酶(hydrogen peroxide,CAT)分解成O2和H2O。根据乒乓机制,GOD催化葡萄糖氧化的整个反应如下[12]:
GOD(FAD)+β-D-葡萄糖→GOD(FADH2)+D-葡萄糖酸-δ-内酯
GOD(FADH2)+ O2→GOD(FAD)+ H2O2
β-D-葡萄糖+ GOD(FAD)+ O2→GA + GOD(FADH2)+ H2O2
目前已知的氧化酶中GOD因高度特异性而出名,研究发现,GOD作用于D-葡萄糖的β-端基异构体时十分敏感,但底物为α-端基异构体如2-脱氧-D-葡萄糖,D-甘露糖和D-半乳糖时,GOD的催化作用将大大降低[13]。
2 产GOD的微生物来源
GOD可以从许多不同的来源获得,包括红藻、柑橘类水果、昆虫、细菌、植物、动物和真菌。真菌具有使用各种碳源的巨大能力并且能在应力条件下产生GOD,早在1950年真菌GOD就大规模应用于工业[14],目前生产GOD的最常见微生物是曲霉属(Aspergillus)、青霉属(Penicillium)和酵母属(Saccharomyces)(见表1)。

表1 GOD的微生物来源Table 1 Microbial sources of GOD
2.1 黑曲霉产GOD
在食品工业中,黑曲霉的使用符合美国食品药品监督管理局(Food and Drug Administration,FDA)的安全性指标(generally regarded as safe,GRAS)[15],大多数商业生产的GOD是从生产葡萄糖酸或葡萄糖酸盐的黑曲霉菌丝体中分离。未经遗传改造的天然黑曲霉能产生大量GOD,HAQ等人[16]从旁遮普各地土壤中分离出黑曲霉,GOD产量达到(145.22±0.034) U/mg。CLARKE等人[17]研究了GOD在黑曲霉的细胞外液、细胞壁、细胞质和黏液中的分布情况,其中细胞外液含有38%的酶活,其余62%与菌丝体有关,分别以34%、12%、16%的比例分布在细胞壁、细胞质和粘液之间。BANKAR等人[18]研究了影响黑曲霉产GOD的最佳营养因子,蔗糖、蛋白胨、NaNO3和CaCO3作为培养成分时,酶活显著增加了28.93倍,其中CaCO3作为一种强诱导剂诱导GOD的产生。DIEGO等人[19]发现葡萄糖氧化酶产生在指数生长期。多变量实验表明,pH值和搅拌参数对GOD的产率影响最大,产酶最佳碳源是葡萄糖而不是蔗糖,这一点与BANKAR等人报道的有所差异。HATZINIKOLAOU和MACRIS曾报道过葡萄糖(纯的或作为蔗糖水解转化酶的产物)是GOD基因转录的主要诱导剂,但某些情况下蔗糖却是最佳碳源,关于最佳碳源的选择还有待进一步的研究。EL-HARIRI等人[20]用两种改良的基础液体培养基筛选了产GOD黑曲霉,在沃格尔肉汤培养基上显示产GOD阴性,但在察氏培养基上GOD酶活达7.28 U/mL,GOD的产生可能受3种可控因素的影响:基础培养基成分、培养时间和菌株对培养基成分的适应性。其中,在接种黑曲霉9 d后GOD产量最高,这与BANKAR和PETRUCCIOLI等人[21]报道的接种后第3天达到最大酶活不一致。虽然黑曲霉是目前商业应用最广泛的产GOD菌株,但由于大部分酶活存在于细胞内,常用的超声破壁法和酶解法操作繁琐且破壁效率低,一种高破壁率且简便的GOD分离方法还有待深入研究。
2.2 青霉属产GOD
目前在生物传感器和生物燃料领域,GOD的应用十分广泛。黑曲霉和青霉的总碳水化合物含量分别为16%和11%,黑曲霉GOD的糖基化程度高于青霉GOD,较高的糖基化程度限制了传感器中电子从电极迁移到GOD的速率,从而降低了生物传感器的灵敏度。 KALISZ等人[22]研究了青霉菌中去糖基化GOD的酶学特性,发现去糖基化不影响GOD最适温度和最适pH值的动力学,也不增加GOD对蛋白质降解的敏感性,但表现出酶的pH值稳定性和温度稳定性的降低。通过与黑曲霉GOD对比,发现青霉GOD具有更好的底物亲和力和催化效率,应用在生物传感器上具有更好的优势。KIESS等人[23]通过埃德曼降解和质谱分析确定了来自青霉菌的GOD完整氨基酸序列,每个单体的完整序列包含587个氨基酸残基,含有3个半胱氨基酸残基和7个潜在的N-糖基化位点,研究表明青霉GOD和黑曲霉GOD具有高度的同一性(66%)和相似性(79%)。KONISHI等人[24]报告了黄青霉的葡萄糖氧化酶制剂的安全性。对大鼠进行了90天重复剂量口服毒性研究,在高达15 600 U/(kg·d)的黄青霉GOD剂量下(相当于193 mg总有机固体/(kg·d)),大鼠体内没有发现相关的化合物副作用。另外,黄青霉GOD在一系列遗传毒性测试中显示出非遗传毒性,具体测试包括细菌回复突变试验、体外哺乳动物染色体畸变试验、体内哺乳动物红细胞微核试验和彗星试验,研究表明黄青霉GOD同样可用于食品行业,并且具有十分可靠的安全性。
尽管天然GOD在各个方面表现出它的巨大潜力,但在工业化生产上却存在明显的缺陷。一方面,大部分天然GOD来源于霉菌,霉菌在发酵过程中形成的菌丝体会使发酵液的黏度增高,从而影响搅拌和供氧的速度,菌丝体的存在也导致发酵液中营养成分的不均匀混合,最终导致产品的回收率低。另一方面,天然GOD的分子结构复杂,导致酶的稳定性差。在食品加工、饲料生产、纺织漂白等方面,酶的耐热性、耐酸性及耐氧化性远远达不到工业化生产的要求。因此,目前工业生产GOD的微生物均优选于经过基因工程改造的酵母菌属。
3 高产GOD工程菌的选育
天然GOD的大规模生产受发酵能力低、纯化工艺复杂,酶活性低等因素制约,且传统过程中往往伴随其他杂质的产生,包括CAT、纤维素酶和淀粉酶,同时GOD可以被H2O2灭活,因此构建工程菌生产GOD成为主要研究方向。过去十几年,利用汉氏酵母和酿酒酵母异源表达GOD进行工业化生产被认为具有很大的前景[25],但是重组酶的高糖基化限制了其在生物传感器上的使用[22]。有研究人员在大肠杆菌中表达出非糖基化的GOD,但是重组酶以不溶性包涵体的方式存在,仅仅40%左右的蛋白质存在活性[26]。毕赤酵母作为仅次于大肠杆菌的第二大表达系统,具有进行许多真核转录翻译修饰的能力,如信号序列的处理、糖基化及二硫键形成等,可作为GOD表达的良好表达系统。CROGNALE等人[27]在毕赤酵母X33中表达了可变青霉P16的GOD基因,3 L发酵罐中未优化发酵15 d,其酶活达到50 U/mL。重组酶比天然酶的糖基化程度略高,分别是17%、14%,酶学特性相似。GUO等[28]在蛋白酶缺陷性毕赤酵母中表达了黑曲霉Z-25GOD,摇瓶优化后酶活达到400 U/mL,观察到重组酶的Km和Kcat值比天然酶的略低,尽管较低的Km值有助于提高酶对β-D-葡萄糖的亲和力,但较低的Kcat值则代表了重组酶较慢的催化速度。郜赵伟等人[29]通过密码子优化实现重组GOD的高水平表达,突变了涉及228个残基的272个核苷酸并调整了G+C含量,高密度发酵后酶活达到615 U/mL,使GOD的产率提高到原来的410%,实现面包焙烤工业的低成本替代。顾磊等人[30]对比了黑曲霉GOD和青霉GOD的基因序列,对其酶活性保守区域内的差异氨基酸位点进行突变,复合突变体的Kcat/KmA提高至rGOD的2.4倍,将CAT中区域B和D分别与GOD的N端与C端融合,突变体的温度稳定性和耐氧化性均有所增强,然后证实了共表达HAC1基因对于蛋白折叠机制的正向作用,研究了各模块基因改造对GOD产量的影响并进行组合优化,GOD酶活达到1 972.9 U/mL。近几年来,葡萄糖氧化酶和辣根过氧化物酶的交联结合酶聚体广泛用于食品和制药工业的各个领域,用于催化级联反应[31-32]。但GOD的利用通常受限于极端温度、pH值或表面活性剂存在的高温条件,高稳定性的GOD将大大提高其利用价值。牟庆璇等人[33]通过整合分子伴侣二硫键异构酶和透明颤菌的血红蛋白使酶活提高了150%,利用计算机软件辅助突变了S16K、Q243H和H477Y三个氨基酸位点使热稳定性达到63 ℃。JIANG等人[10]通过设计突变体,用计算机CDOCKER算法辅助进行同源性建模,将亮氨酸替换成甲硫氨酸,从而提高了GOD对H2O2(竞争性抑制剂)的抗氧化能力。 获得的结果与计算机辅助分析的结果一致,表明这种方法对酶结构优化的有效性。ROUPAIN等人[34]采用随机突变和理性设计的方法分离出无特征突变的黑曲霉葡萄糖氧化酶,改进了其性质,发现两种突变能显著提高酶的热稳定性。其中突变体T554M引入一个硫-π作用,突变体Q90R/Y509E在二聚体蛋白结构界面附近引入一个新的盐桥。另一种双取代突变体Q124R/L569E的稳定性没有显著提高,但酶的比活性增加两倍,结果显示了蛋白质结构对酶整体稳定性的影响。
GOD在工业上的适用性依赖于它的高催化活性、底物亲和力以及高稳定性。来源真菌的GOD具有广谱应用的特点,为了产生更高的经济效益,它必须在更极端的温度和更长的时间内保持稳定,如在面包焙烤的高温条件下、食品和药品低温生产条件下及在传感器中长期使用条件下均能保持良好的稳定性。GOD的优化可以利用现代分子技术与生物工艺工程技术相结合,实现经济可行的酶生产系统,将高效重组微生物技术和蛋白质工程技术相结合,提高GOD稳定性的同时可以进一步提升其工业价值。尽管已经有许多成功的研究通过使用遗传修饰和其他方法来改善和优化真菌GOD的产生,但是不同真菌积累GOD的机制尚没有权威的报道,这一点仍然是目前研究的突破口。
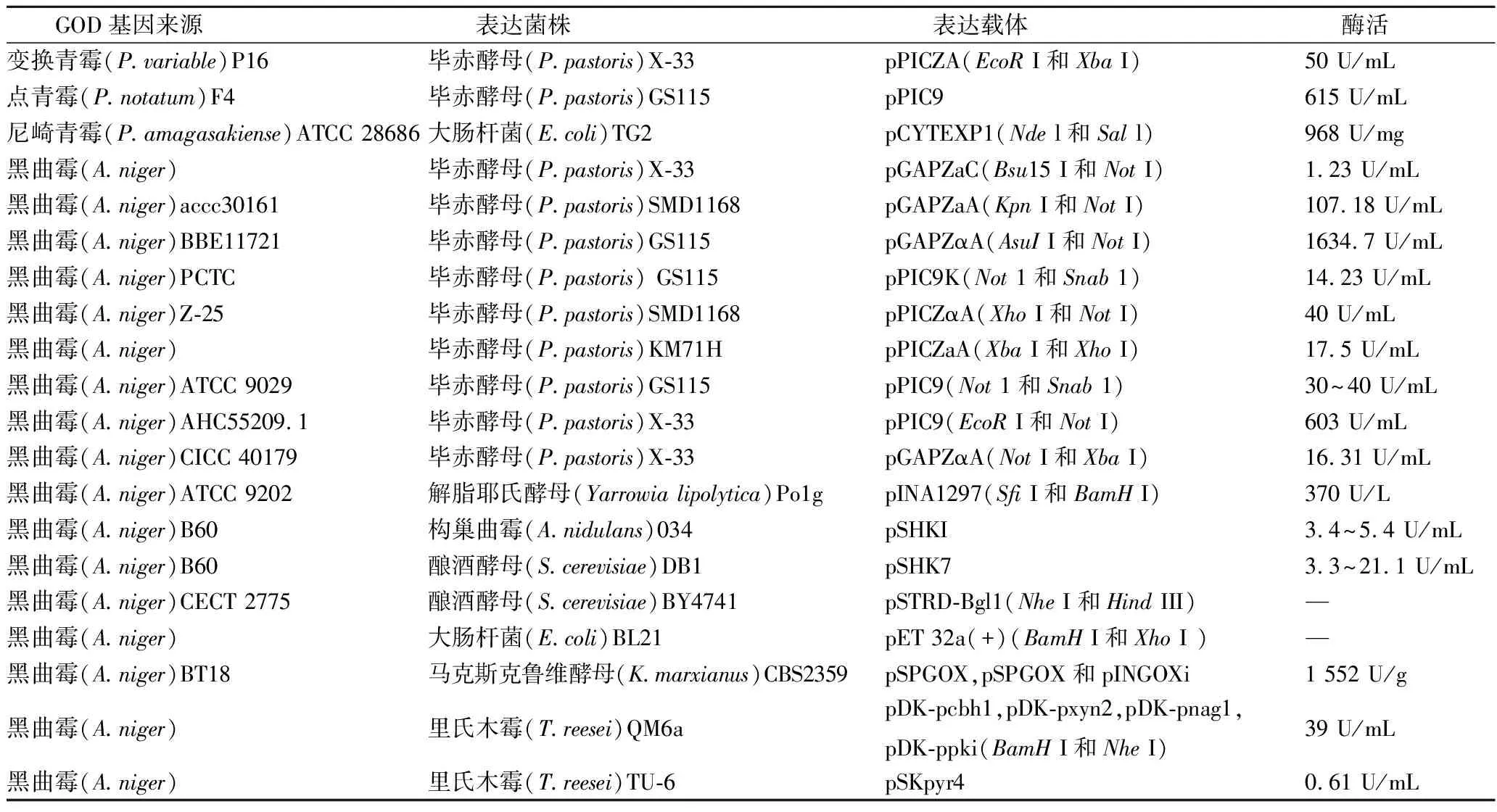
表2 GOD基因工程菌株Table 2 Genetically engineered strain of glucose oxidase
注:表中“—”表示文献中未提到
4 微生物GOD的应用
4.1 食品领域的应用
在烘焙行业中,GOD作为一种高效的氧化剂,可以提高面包的质量,增大面包的体积,由GOD产生的H2O2能提高面团的弹性和黏性[35],但GOD添加过量会引起不良的反应[36]。研究发现,GOD和其他添加剂共加入会产生协同作用,如GOD和脂肪酶共同添加可以提高面包的质量和保质期;在小麦粉中添加基础添加剂及32%抗坏血酸、4.2%α-淀粉酶和63.8%GOD能降低面包的硬度和咀嚼性并改善其粘弹性和体积[37]。AITLNEL等人[38]发现了淀粉葡萄苷酶、GOD和半纤维素酶的组合利用对面团流变学特性的协同效应。APRODU和BANU等人研究了车前子、豌豆纤维、燕麦麸皮、水和GOD对无谷蛋白玉米面包的流变学性质和烘烤性能的影响,表明GOD能显著的改善所有纤维类型的面包体积[39]。
在饮料制造中,GOD通过消除残留的葡萄糖从而减少葡萄酒中的低度酒精物质[40],目前通过将GOD固定在尼龙纤维膜上研发出一种新型葡萄糖电化学传感器,能够分析商业饮料中葡萄糖含量和监测啤酒的酿造过程[41]。
GOD还有一个主要的应用是生产GA及其衍生盐,GA可通过生物化学、电化学、生物电化学和微生物发酵过程来生产,但发酵法是GA生产的首选方法,其他方法价格昂贵且生产效率低[42]。葡萄糖转化为GA的催化效率高度依赖于GOD的稳定性,最近,已经证明在无机载体SiO2体系上修饰过的葡萄糖与酶交联的稳定系统使GA产率达到目前最高85%[43]。GA在面包、饲料和饮料等领域被用作色素稳定剂、酸化剂、抗氧化剂和螯合剂等。在乳品工业中,GA用于促进乳酪凝乳的形成、提高牛奶的热稳定性、铝罐的清洗及防止奶石的形成[43]。GA衍生盐如葡萄糖钠具有螯合金属离子的巨大潜力,并且可用于去除食品中的苦味[44]。
GOD还可用作食品抗菌剂,对不同的食源性病原体具有抗菌活性,包括产气荚膜梭菌、沙门氏菌、李斯特菌、金黄色葡萄球菌、空肠弯曲杆菌、大肠杆菌和蜡状芽孢杆菌等[45]。GOD及其产物H2O2和GA对幼虫芽孢杆菌ATCC9545具有体外抗菌活性,已应用于食用抗菌薄膜,通过在食品表面释放足够数量的抗菌物质来提高食品的保质期[46]。
4.2 医药行业的应用
葡萄糖生物传感器用于快速、准确监测糖尿病患者血糖浓度,目前已经开发出了更先进的技术如连续葡萄糖监测仪[47],葡萄糖生物传感器的缺点和局限性可通过电极、膜、酶固定化和纳米复合膜修饰电极等先进方法消除。GOD的固定化能加快催化反应速率、增强GOD的稳定性、提高生产率以及降低操作成本,是研制高稳定、具有长期使用寿命葡萄糖生物传感器的关键因素。将GOD结合到生物传感器的方法包括吸收、共价吸附、交联和微囊化,HONG[48]等人通过酶吸附、沉淀、交联组合混合制备方法,开发了基于GOD固定在氧化石墨烯上的生物传感器,以交联沉淀形式存在的GOD聚集体提高了酶的装载量和系统的稳定性。
4.3 其他领域的应用
在纺织工业中,GOD产生的H2O2是一种有效的工业漂白剂,是应用最广泛的商业H2O2替代品。ABER等人[49]利用生物芬顿法通过GOD产生的对染料溶液进行脱色,他们将GOD固定在磁体矿纳米粒子Fe3O4上并研究了最佳脱色条件,该系统可有效地用于葡萄糖的氧化和原位生成H2O2去除酸性黄12。FAROOQ等人[50]对比了传统漂白和GOD催化漂白对针织棉织物的漂白效果,发现酶漂白剂能提高织物的白度和力学性能,如抗拉强度和撕裂强度。近几年,研究发现以酶为生物催化剂的生物燃料电池系统是未来可植入设备的优良替代品[51],人们开发了可植入微型化膜/无室装置,如人造胰腺和起搏器中的胰岛素泵和葡萄糖传感器。CHRISTWARDANA等人[52]将GOD-CAT共固定化增强了无膜生物燃料电池的发电效率,该系统存在协同作用机制,如CAT分解了不利于电池发电的H2O2同时激活了GOD的氧化反应。GOD还大量用于饲料工业,据研究,日粮中添加GOD可以增强仔猪的生长能力、提高体内生长发育相关激素水平和改善仔猪的粪便微生物群落[53],每吨日粮中添加100 g GOD可以有效改善仔猪肠道健康和血清中相关生长激素含量[54]。
5 结语
GOD在食品、饲料、医药、纺织和新能源等领域的应用十分广泛,特别是在食品和饲料工程领域,我国作为农业大国,GOD的产量及稳定性远远达不到市场要求。我国对GOD的研究起步较晚,目前国内的研究主要在于高产GOD菌株的选育和酶学特性研究。尽管有多种微生物能产生GOD,但实际应用于商业的微生物种类仅占小部分,开发新的GOD来源和具有成本效益的发酵工艺应被高度重视。近年来,酶固定化技术被开发为大规模生产GOD的新方法。然而,酶固定化后的扩散限制和酶活性下降等问题限制了固定化GOD的应用,该方面的研究还需深入突破。利用现代生物技术如蛋白质设计、定点诱变等可实现GOD在各领域的大规模高效利用,将GOD在具有潜力的微生物中重组表达确实大大提高了GOD的产量,但GOD稳定性的提高有待于进一步研究以满足未来的市场需求。

