心肌梗死后不同移植部位对移植后骨髓间充质干细胞的影响
金培峰,王业焕,姜盛,张浩,孙成超
(1.温州医科大学附属第一医院 心胸外科,浙江 温州 325015;2.岳阳市第一人民医院 急诊科,湖南岳阳 414000;3.中国医学科学院阜外心血管病医院 心外科,北京 100037)
研究表明在心肌梗死(myocardial infarction,MI)后移植骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)能够有效改善心功能[1-2]。将BMSCs直接注射入MI区域被认为是效果最佳的移植途径之一,但MI的不同部位对移植的BMSCs有着不同的影响,MI的中央区(即瘢痕区域)虽然不利于移植细胞的存活,但该部位却是最需要心肌的再生;而MI的边缘区域由于拥有较丰富的血液供应,有助于移植细胞的存活,但较多的血运会使移植的细胞发生心外逃逸现象,从而影响移植效果[3-4]。
本研究将BMSCs通过注射的方式分别移植入MI的中央区和边缘区,并检测其存活情况、促进血管新生以及在改善心功能方面的差别,从而为BMSCs在临床应用中提供指导。
1 材料和方法
1.1 材料
1.1.1 实验动物:60只雌性Lewis大鼠(体质量200~220 g)用来制作MI模型;5只雄性Lewis大鼠(体质量60~80 g)用来培养BMSCs。实验动物均由温州医科大学动物实验中心提供,实验动物使用许可证号:SCXY(浙)2015-0001。
1.1.2 主要试剂:DMEM培养基(美国Gibco公司),胎牛血清(美国Gibco公司),5-溴尿嘧啶(Brdu)(美国Sigma公司),胰酶(美国Sigma公司),Von Willebrand factor抗体(美国Santa Cruz公司),DAB显色液(北京中杉金桥公司),所有引物由大连TaKaRa公司设计合成。
1.2 方法
1.2.1 细胞的培养和标记:无菌条件下分离大鼠的股骨和胫骨,以全骨髓贴壁法分离并培养BMSCs,待状态良好的第3代细胞生长达到50%~60%汇合时,用含10 μmol/L Brdu的DMEM(含10%胎牛血清)培养基替换原有培养基后,继续培养36 h[5-6]。
1.2.2 MI模型的制作:雌性Lewis大鼠在小型动物呼吸机和水合氯醛麻醉下,左进胸结扎左冠状动脉前降支[7]。术后3周心脏超声检查,只有出现明显左室前壁变薄以及同时满足左室射血分数(left ventricular ejection fraction,LVEF)<60%和左室缩短分数(left ventricular fractional shortening,LVFS)<30%的动物才予以进入下轮实验。存活的合格大鼠随机分为4组,每组12只,即MI边缘区细胞移植组(BZC组)、MI中央区细胞移植组(CZC组)、MI边缘区PBS组(BZP组)和MI中央区PBS组(CZP组),并为下一步移植实验做准备。
1.2.3 细胞移植:MI 3周后将大鼠麻醉后在左胸第5肋间开胸,用胰岛素针抽取含有3×106个Brdu标记BMSCs的PBS悬混液50 μL。在BZC组将细胞悬液注射入MI边缘区,在CZC组将相同体积的细胞悬液注射于MI中央区。作为对照,BZP组和CZP组分别于边缘区和中央区注射50 μL的PBS,见图1A-B。
1.2.4 Real-time PCR检测:分别在细胞移植后的24 h和4周处死动物,取心脏作移植细胞的定量检测。DNA利用Wizard Genomic DNA Purification Kit提取,提取后的DNA用100 μL试剂盒中的DNA再溶解液溶解,用分光光度测定法测定DNA的总量。实验采用SYBR-Green I荧光染料技术。应用7300 Real-time PCR System(美国ABI公司)对外源雄性动物的BMSCs进行定量。目的基因位于雄性大鼠Y染色体性别决定区(sex determining region of Y chromosome,SRY)上一段特定的序列。2对引物(10 μmol/L)分别为5’-CATCGAAGGGTTAAAGTGCCA-3’和5’-ATAGTGTGTAGGTTGTTGTCC-3’,环境条件是:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min。所取材中的雄细胞总数=Real-time PCR检测所得SRY的平均数×被检DNA的稀释倍数×原取材重量(mg)/用来提取DNA的标本重量(mg)。
1.2.5 心功能评价:细胞移植后第4周,再次心脏超声检查,记录LVEF和LVFS值。心脏超声检测完毕后处死动物,取心脏做组织学检测。
1.2.6 组织学观察:①毛细血管密度的检测:用VI I I因子染色后在200倍显微镜下在瘢痕区内计数,血管数目=血管数/0.2 mm2。②干细胞失踪的检测:主要通过免疫组织化学法,标识Brdu预染的干细胞。两者主要方法为切片脱蜡后使用胃蛋白酶修复抗原,并添加抗体置于湿盒内过夜,之后使用通用的标准方法染色。
1.2.7 MI后左室重塑的检测:心脏横截面的石蜡切片用HE染色,Olympus DP70拍摄后用Image-Pro Plus 5.0软件分析,其主要检测的指标为心脏的膨胀系数:①室间隔和MI中央区的瘢痕厚度;②左室腔的面积和整个左心室的面积。膨胀系数=(左室腔面积/整个左室面积)×(室间隔厚度/瘢痕厚度)。
1.3 统计学处理方法 采用SPSS21.0统计学软件进行分析。计量资料用±s表示。各组间数据比较使用单因素方差分析,两两比较用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs的标识和存活率检测 细胞移植后Brdu标记的BMSCs确定是分别局限于原来的注射区域(边缘区或中央区),很少发现移植的细胞向其他部位迁移的现象,见图1C-D。Real-time PCR显示BZC组移植细胞在24 h和4周的存活率分别为15.74%±4.13%和5.57%±1.13%,所检测到的存活量均显著高于同一时间点的CZC组(8.2%±2.63%和1.72%±0.41%),差异均有统计学意义(P<0.01)。见图2。

图1 BMSCs细胞在移植部位的示踪

图2 BMSCs移植后24 h和4周Reali-time PCR所检测到的细胞存活率
2.2 心功能和心室重塑的评价 细胞移植前4组大鼠心功能LVEF、LVFS以及心脏大小、体质量等指标差异均无统计学意义(P<0.05)。细胞移植治疗后4周,与CZC组、CZP组和BZP组相比,BZC组LVEF和LVFS均显著提高,差异有统计学意义(P<0.05)。而CZC、CZP和BZP 3组间差异无统计学意义(P>0.05),见表1。
2.3 新生血管检测 与其他3组比,BZC组的细胞移植局部区域毛细血管生成数量明显增加,差异有统计学意义(P<0.01),见图3-4。
2.4 心脏形态学的评价 细胞移植均能有效增加边缘区和中央区瘢痕厚度,与BZP组和CZP组比,BZC组和CZC组瘢痕厚度均有显著增加,差异有统计学意义(P<0.01)。膨胀系数检测结果显示,BZC组明显低于CZC组、BZP组和CZP组,差异有统计学意义(P<0.01)。见图5。
3 讨论
细胞移植后细胞在MI部位的存活量是影响疗效的一个重要因素,这也是本研究首要的检测指标。本研究通过检测SRY基因的方法来对移植的雄性干细胞进行定量检测。随着时间的延长,在BZC组和CZC组移植细胞均在逐步降低,但BZC组的细胞存活量显著多于CZC组,在移植后第1天是CZC组的2倍,4周时是CZC组的3倍。移植细胞心内滞留和存活量的减少可能与经MI区残存的血管逃逸和MI部位的炎症、缺氧及机械原因所导致的细胞丢失有关[3,8]。虽然MI边缘区残存的毛细血管量明显多于MI中央区,从而可能加重细胞向心外脏器迁移,但相对丰富的血液供应对移植细胞的存活起着关键作用。所以总体而言,BZC组的细胞存活显著高于CZC组。但无论选择何种部位移植,4周后存活的细胞数均锐减,所以需要通过其他一些手段如转染抗缺氧的基因等进一步提高细胞的远期存活率。
表1 细胞移植4周后心功能和心室重塑指标的变化(n=12, ±s)
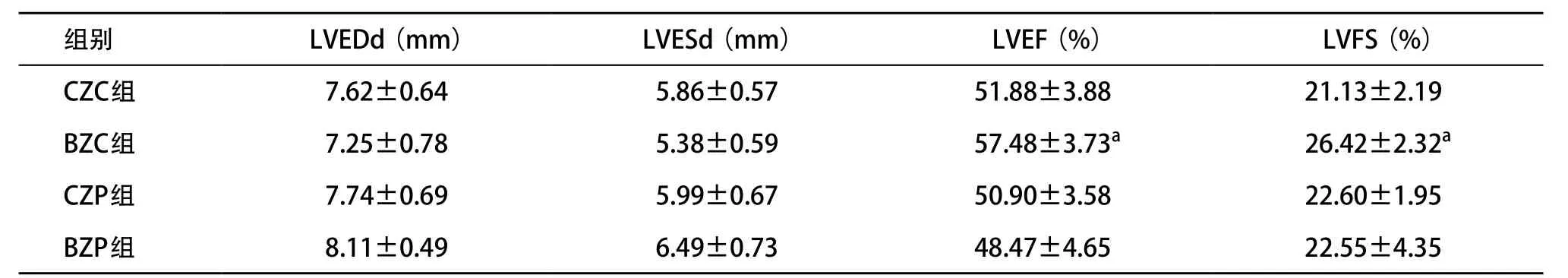
表1 细胞移植4周后心功能和心室重塑指标的变化(n=12, ±s)
与其他3组比:aP<0.05;LVEDd为左室舒张期末内径,LVESd为左室收缩期末内径
组别 LVEDd(mm) LVESd(mm) LVEF(%) LVFS(%)CZC组 7.62±0.64 5.86±0.57 51.88±3.88 21.13±2.19 BZC组 7.25±0.78 5.38±0.59 57.48±3.73a 26.42±2.32a CZP组 7.74±0.69 5.99±0.67 50.90±3.58 22.60±1.95 BZP组 8.11±0.49 6.49±0.73 48.47±4.65 22.55±4.35

图3 细胞移植促进移植部位的新生血管生成(免疫组织化学法)

图4 各组毛细血管数量(VI I I因子染色)
在BMSCs移植后促进移植部位及周边部位的血管新生是促进心功能改善的一个重要因素[9],BMSCs所分泌的各种细胞因子(如血管内皮细胞生长因子等)对血管的新生起着非常重要的作用。因此移植后细胞存活量直接影响着促血管新生的细胞因子的产生。在本研究中,虽然中央区移植也可以促进局部血管新生,但其密度远低于边缘区。毛细血管的增多改善了MI部位的微环境,而微环境的改善反过来促进了后期移植细胞的增殖。而移植细胞在MI中央区的低存活量限制了其促血管新生的作用。
Hochman-Choo膨胀系数对于MI后心脏膨胀度能起到较好的量化作用[10]。细胞经边缘区注射能更有效地促进瘢痕面积的缩小和降低MI心脏的膨胀系数。表明对MI后进行BMSCs的移植能够抑制心脏的形态学进一步扩张,对心脏起到类似于组织绷带的作用,能够有效地降低心脏的矛盾运动,从而使心功能的继续恶化得到有效抑制。研究也表明,边缘区移植能更有效地通过调整局部金属基质酶等的表达,从而促进心室的逆向重构[11]。
虽然在MI后移植细胞能够明确有效地改善心功能,但在MI的边缘区用注射的方法移植能够更有利于移植细胞的存活,并更有效地促进新生血管的形成,改善心脏形态的重构和提高心功能的作用。在将来的开胸条件下进行直视细胞移植的研究中,如果移植细胞的数量有限,应该优先考虑对MI的边缘区进行移植。但在移植细胞数量充足的条件下,MI中央区也不应被忽略,因为其也能在一定程度上有效地促进血管新生和重塑瘢痕的作用。

图5 BMSCs移植后改善MI后的心肌重塑情况
[1] 胡盛寿, 刘盛, 宋云虎, 等. 冠状动脉旁路移植术同期经旁路血管移植自体干细胞治疗缺血性心衰[J]. 中华胸心血管外科杂志, 2009, 25(5): 321-323.
[2] 张林, 高长青. 心脏外科术中干细胞移植治疗心肌梗死[J].中华胸心血管外科杂志, 2013, 29(9): 567-568.
[3] DOW J, SIMKHOVICH B Z, KEDES L, et al. Washout of transplanted cells from the heart: a potential new hurdle for cell transplantation therapy[J]. Cardiovasc Res, 2005, 67(2):301-307.
[4] ZHAO Q, SUN Y, XIA L, et al. Randomized study of mononuclear bone marrow cell transplantation in patients with coronary surgery[J]. Ann Thorac Surg, 2008, 86(6): 1833-1840.
[5] 陈棉, 王珏, 耿志敏, 等. 骨髓间充质干细胞条件膜微粒对心脏成纤维细胞的影响[J]. 温州医科大学学报, 2016, 46(9): 625-628.
[6] 金培峰, 张浩, 陆地, 等. 雪旺细胞移植改善心肌梗死后副交感/交感神经重塑[J]. 温州医科大学学报, 2016, 46(1):13-18.
[7] ZHANG H, HOU J F, SHEN Y, et al. Low level laser irradiation precondition to create friendly milieu of infarcted myocardium and enhance early survival of transplanted bone marrow cells[J]. J Cell Mol Med, 2009, 14(7): 1975-1987.
[8] BARBASH I M, CHOURAQUI P, BARON J, et al. Systemic delivery of bone marrow-derived mesenchymal stem cells to the infarcted myocardium: feasibility, cell migration, and body distribution[J]. Circulation, 2003, 108(7): 863-868.
[9] HOU L, KIM J J, WOO Y J, et al. Stem cell-based therapies to promote angiogenesis in ischemic cardiovascular disease[J]. Am J Physiol Heart Circ Physiol, 2016, 310(4): H455-H465.
[10] TANG J, XIE Q, PAN G, et al. Mesenchymal stem cells participate in angiogenesis and improve heart function in rat model of myocardial ischemia with reperfusion[J]. Eur J Cardiothorac Surg, 2006, 30(2): 353-361.
[11] MAO Q, LIN C, GAO J, et al. Mesenchymal stem cells overexpressing integrin-linked kinase attenuate left ventricular remodeling and improve cardiac function after myocardial infarction[J]. Mol Cell Biochem, 2014, 397(1-2): 203-214.

