大鼠骨髓树突状细胞的分离培养及HMGB1/TLR4信号通路的调控作用
王涵磊,薛继阳,葛捍伟,夏杰,林炜,赵琦峰
(温州医科大学附属第二医院育英儿童医院 心胸外科 儿童心脏中心,浙江 温州 325027)
炎症反应过程在缺血再灌注损伤(ischemia/reperfusion injury,IRI)中扮演着重要角色,而炎症反应主要通过各种炎症细胞发挥作用,除了中性粒细胞、巨噬细胞,近年来,研究者逐步重视树突状细胞(dendritic cells,DCs)在IRI中发挥的作[1-2]。Toll样受体(Toll-like receptors,TLR)是一类进化保守的模式识别受体,研究发现TLRs尤其是TLR4参与了IRI[3]。高迁移率族蛋白B1(high
mobility group protein box-1,HMGB1)作为炎症的早期启动者和晚期促进者,扮演着细胞因子、趋化因子、生长因子等角色,同样在IRI中作用突出[4]。HMGB1是TLR4的特异性配体,可在细胞坏死或损伤后,释放到细胞外或血清中产生广泛的细胞生物学效应;而TLR4主要在巨噬细胞、DCs等细胞上表达。近年来,HMGB1/TLR4信号通路在IRI中的作用研究较多[5-6],而HMGB1是否通过DCs上的TLR4调控DCs的功能,从而影响DCs在IRI中的作用尚未明确。本研究在分离、培养、纯化骨髓DCs(mDCs)的基础上,通过添加HMGB1、HMGB1特异性中和抗体、TLR4拮抗剂在细胞水平探讨HMGB1/TLR4信号通路对mDCs下游分子、细胞因子及共刺激分子的影响,探讨其对mDCs活化、成熟、炎症介质分泌的调控作用,为进一步阐述HMGB1/TLR4信号通路介导DCs在IRI发病中的作用奠定基础,为IRI的防治提供新的思路和治疗依据。
1 材料和方法
1.1 实验动物 成年健康雄性SD大鼠,体质量200~250 g,平均(226±14)g,由温州医科大学实验动物中心提供,动物许可证号:SYXK(浙)2015-0009。
1.2 主要试剂 HMGB1抗体(Ab215008)购自英国Abcam公司,HMGB1特异性中和抗体(ST326052233)、对照抗体IgG(ST326058471)购自日本Shino-Test公司,TLR4受体拮抗剂(TAK-242,A3850)购自美国ApexBio公司,CD80抗体(SC-58911)、D86抗体(FITC标记,SC-28347)、CD11c抗体(PE标记,SC-398708 PE)、MyD88抗体(SC-74532)购自美国Santa Cruz公司,NF-κB P65抗体(10745-1-AP)、山羊抗大鼠IgG抗体(FITC标记,SA00003-11)购自美国Proteintech公司,抗大鼠DCs OX62微球(130-090-663)、Midi-MACS磁珠分离器(130-042-302)购自德国Milt-enyi Biotec公司,IL-6(E0079r)、IL-8(Ml037351)、IL-12(E0059r)、TNF-α(E0133r)浓度测试试剂盒购自武汉伊艾博科技有限公司,RNA抽提试剂盒Ultrapure RNA Kit(CW0581)购自北京康为世纪生物科技有限公司、反转录试剂盒ReverTra Ace-α-(FSK-100)购自上海TOYOBO公司,荧光定量PCR试剂盒SYBR Permix Ex TaqTMI I(DRR081S)购自日本TaKaRa公司。
1.3 主要仪器 麻醉机(R540增强型,深圳瑞沃德生命科技有限公司),小动物呼吸机(北京泰盟科技有限公司),生物安全柜(BSC-1500 I I A2-X,济南博科生物有限公司),电动移液器、台式离心机(美国Thermo Scientific公司),高速离心机、冷冻离心机(德国Eppendorf公司),荧光倒置显微镜(日本Nikon公司),流式细胞仪(美国Beckman Coulter公司),全自动多功能酶标仪(M200 PRO,瑞士Tecan公司),低温冰箱(MDF-382E,日本SANYO公司),荧光定量RT-PCR仪器(美国Bio-Rad公司)。
1.4 大鼠mDCs的分离、培养、纯化与鉴定
1.4.1 mDCs的分离、培养:成年SD大鼠处死后浸入75%乙醇消毒5 min,无菌状态下取后肢股骨和胫骨,剔除骨表面组织后剪开两端,用PBS液冲洗出骨髓内含物;清洗的悬液转入15 mL离心管中,用移液器吹打使冲洗出的内容物充分分散,之后1500 r/min离心5 min,离心完成后,弃去上清,用4 mL PBS重悬细胞;接着用大鼠淋巴细胞分离液分离单个核细胞;然后用含GM-CSF和IL-4的DCs完全培养基培养分离的细胞,6 h后换液去除未贴壁细胞,之后继续培养,从第3天开始收集悬浮起来的细胞至第9天,将收集的细胞进行后续纯化操作。
1.4.2 mDCs的纯化:得到的细胞悬液用一定量的PBS重悬后,充分混匀后,过200目无菌尼龙网筛后,计数细胞数量,计数完成后300×g离心10 min,弃去上清,按107细胞数用80 μL分选缓冲液的比例重悬管底的细胞。将收集好的细胞用抗大鼠Anti-DC(OX62)的磁珠孵育后过磁场,利用MACS磁珠分离原理阳性筛选出mDCs。之后分别用CD11c做免疫荧光染色及PE标记的CD11c做流式检测,鉴定纯化后mDCs的纯度。
1.4.3 mDCs的免疫荧光鉴定:利用DCs特异蛋白CD11c进行检测,一抗用兔抗大鼠CD11c抗体,二抗使用Alexa Fluor 594(红色荧光)标记的羊抗兔IgG,同时使用DAPI染核以确定视野中的细胞数量。显微镜下观察胞浆呈红色,代表mDCs的CD11c的表达呈阳性。阴性对照组用5% BSA代替一抗进行孵育。
1.4.4 mDCs的流式鉴定:纯化完成后细胞进行流式样本处理,先用无抗体孵育的细胞上流式细胞仪检测,划定荧光的阴性区域;再用PE标记的CD11c抗体4 ℃孵育20 min后上机检测,确定迁移入阳性区域细胞的百分比,以确定mDCs的纯度。
1.5 分组 mDCs随机分成5组,每组各设24、48、72 h 3个时间点,各组设3个复孔。①C组:对照组,mDCs加于RPMI l640完全培养基中;②H组:含有mDCs的完全培养基中加入HMGB1(1 μg/mL);③H-Ab组:加入HMGB1(1 μg/mL)后30 min,再加入HMGB1特异性中和抗体(终浓度为1 μg/mL),其余同H组;④TLR4-A组:加入HMGB1(1 μg/mL)后30 min,再加入TLR4拮抗剂(终浓度为2 μg/mL),其余同H组;⑤IgG组:加入HMGB1(1 μg/mL)后30 min,再加入对照IgG抗体(终浓度为1 μg/mL),其余同H组。
1.6 指标检测
1.6.1 MyD88、NF-κB P65蛋白的表达:通过Western blot法检测。将培养加药完成的细胞用0.25%胰蛋白酶消化,用完全培养基中和胰酶后,细胞裂解液裂解得到细胞蛋白。BCA法蛋白浓度测定,SDS-PAGE电泳分离总蛋白,电泳结束后取出分离胶,通过转膜转移到PVDF膜。将PVDF膜放入5%脱脂奶粉封闭过夜,将封闭完成的膜用TBST清洗1次,孵育袋中加入封闭液稀释的一抗MyD88(1∶300)、NF-κB P65(1∶300)和β-actin(1∶5000),4 ℃孵育过夜。TBST洗3次,HRP标记的二抗室温孵育2 h。最后用ECL法进行曝光、显影和定影。
1.6.2 MyD88、NF-κB P65基因的表达:通过RT-qPCR法检测,用Trizol试剂按说明书提取总RNA,用无RNA酶水溶解后用核酸蛋白测定仪检测RNA溶液的OD260/OD280及OD260/OD230和RNA浓度,取等量的RNA溶液进行反转录反应;反转录完成后用RT-qPCR反应体系:SYBR Permix Ex TaqTMI I(2×)10 μL,上下游引物各0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL依次加入八连管并混匀,按3000 r/min离心1 min。按CFX96 Touch Real-Time PCR程序,以95 ℃预变性20 s,然后95 ℃ 15 s、59 ℃30 s、72 ℃ 30 s进行40个循环扩增。MyD88、NF-κB P65引物见序列表1。每个样品设置3个复孔,结果以GAPDH为内参进行校正,按2-△△CT法计算相对表达量。

表1 RT-qPCR引物序列
1.6.3 细胞因子的表达:刺激结束后留取上清液,采用双抗体夹心ELISA法,应用ALISEI全自动酶标仪测量上清液中IL-6、IL-8、IL-12、TNF-α的浓度。1.6.4 mDCs共刺激分子的表达:纯度高于90%的mDCs行流式样本处理后,用抗大鼠CD80抗体4 ℃孵育20 min,加PBS离心清洗细胞2次,添加FITC标记的山羊抗大鼠IgG 4 ℃孵育30 min,上流式细胞仪检测CD80信号强度。纯度高于90%的mDCs行流式样本处理后,用FITC标记的抗大鼠CD86抗体4 ℃孵育20 min后,上流式细胞仪检测CD86信号强度。CD80、CD86信号强度用几何平均荧光值表示。
1.7 统计学处理方法 采用GraphPad Prism 7软件进行统计学分析。计量数据用±s表示,组间比较采用单因素方差分析,组内比较采用配对样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养及鉴定 通过大鼠后肢股骨和胫骨骨髓内含物分离的细胞,用含GM-CSF和IL-4的DCs完全培养基培养,第3天开始收集悬浮起来的细胞至第9天。早期可见培养板底部有半贴壁细胞,少量细胞集落形成,簇状生长,细胞体积小,圆形,细胞无明显突起;之后细胞体积变大,培养液中有更多的悬浮细胞,细胞集落散在其中,形态趋于mDCs。收集到第5天的mDCs在相差显微镜下观察结果见图1A。收集完mDCs进行纯化后相差显微镜下观察结果见图1B,纯化后贴壁细胞中长梭状的成纤维样细胞减少,悬浮细胞中可看到带小突出的细胞(mDCs)比例有所增加。每只SD大鼠经纯化后至少能获得4×106个mDCs。免疫荧光鉴定可见mDCs的胞浆呈红色(见图1C),代表mDCs的CD11c的表达呈阳性,阴性对照组未见胞浆红色表达,只见DAPI的蓝色染核(见图1D)。mDCs的流式鉴定可见纯化mDCs用PE标记的抗大鼠CD11c抗体孵育后,上流式检测纯度高于90%(见图1E),阴性对照mDCs的纯度极低(见图1F)。2.2 HMGB1/TLR4信号通路对mDCs MyD88、NF-κB P65蛋白表达的影响 24 h、48 h、72 h,与C组比,各组MyD88、NF-κB P65蛋白表达均明显升高(P<0.01);与H组比,H-Ab组、TLR4-A组MyD88、NF-κB P65蛋白表达均明显下降(P<0.01)。见图2。

图1 大鼠mDCs的培养、纯化与鉴定
2.3 HMGB1/TLR4信号通路对mDCs MyD88、NF-κB P65 mRNA表达的影响 24 h、48 h,与C组相比,H组、IgG组MyD88、NF-κB P65 mRNA表达明显升高;与H组比,H-Ab组、TLR4-A组MyD88、NF-κB P65 mRNA表达明显下降(P<0.01)。72 h,与C组比,各组MyD88、NF-κB P65 mRNA表达均明显升高(P<0.01);与H组比,H-Ab组、TLR4-A组MyD88、NF-κB P65 mRNA表达均明显下降(P<0.01)。见图3。
2.4 HMGB1/TLR4信号通路对mDCs细胞因子表达的影响 24 h、48 h、72 h,H-Ab、TLR4-A、IgG组与C组相比,各组上清液中IL-6、IL-8、IL-12、TNF-α的浓度明显升高;H-Ab、TLR4-A、IgG组与H组相比,H-Ab、TLR4-A组这4种细胞因子表达明显下降(P<0.01)。见图4。
2.5 HMGB1/TLR4信号通路对mDCs共刺激分子表达的影响 24 h、48 h、72 h,与C组比,各组mDCs共刺激分子CD80、CD86表达明显升高;与H组比,H-Ab组、TLR4-A组共刺激分子表达明显下降(P<0.01)。见图5。

图2 各组大鼠mDCs中MyD88、NF-κB P65蛋白的表达
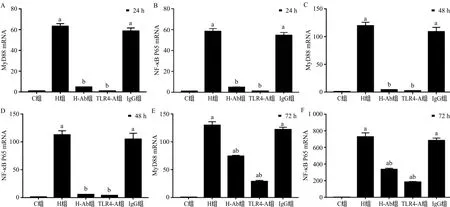
图3 各组大鼠mDCs中MyD88、NF-κB P65 mRNA的表达
3 讨论
脏器IRI是临床上常见的疾病,已成为阻碍各脏器相关疾病治疗效果的主要难题。IRI的发病机制复杂、涉及多种因素,其中局部和全身的炎症反应是其最重要的特征,各种炎症细胞包括巨噬细胞、中性粒细胞等参与其中,近年来DCs在器官IRI中作用的研究逐渐增多,是影响IRI发生发展的关键致炎细胞之一,有望作为药理学干预的靶点[7],但其发挥作用的具体机制尚不完全清楚。
DCs是体内功能最强的抗原提呈细胞,未成熟DCs活动性很强,能有效摄取和加工抗原,活化后可募集巨噬细胞、中性粒细胞、自然杀伤细胞和非成熟淋巴细胞至炎症部位发挥作用;DCs通过不同的特异性信号转导机制使未成熟DCs成为成熟DCs,成熟DCs则不再摄取抗原,而是表达高水平的MHC I I和共刺激分子,分泌TNF-α和IL-12等[8],DCs不仅参与缺血后的炎症反应,而且影响IRI的愈合反应[9],在连接天然免疫和获得性免疫中发挥重要作用;而且DCs调控免疫功能的作用与其成熟、活化程度以及数量密切相关[10]。

图4 各组大鼠mDCs上清液细胞因子的浓度变化
有研究表明,DCs是早期IRI先天性免疫和获得性免疫的核心,改变DCs功能的方法可提供新的治疗机会与选择[11-12]。然而,DCs的活化、成熟、炎症介质分泌的调控作用受很多因素影响,BATAL等[13]认为DCs在IRI期间有激活炎症级联反应的作用,并提出了通过氧化应激激活DCs的新见解,为靶向治疗IRI提供了理论依据;ZHANG等[14]的研究表明肝固有DCs与血源性DCs有着不同的作用,并指出了局部微环境在肝IRI中决定DCs功能的重要性;此外IRI时,损伤相关分子模式可刺激DCs通过模式识别受体来启动免疫应答,经复杂的细胞内信号转导的炎症信号网络调节免疫细胞活化和细胞死亡[15]。损伤相关分子模式是指机体自身因素发生改变(如应激或/损伤)的细胞产生可识别的危险信号,包括HMGB1、防御素等[16];TLR,特别是TLR4是模式识别的必要受体[17];HMGB1可通过TLR4信号通路促进炎症反应和免疫应答加剧脏器IRI[6,18]。
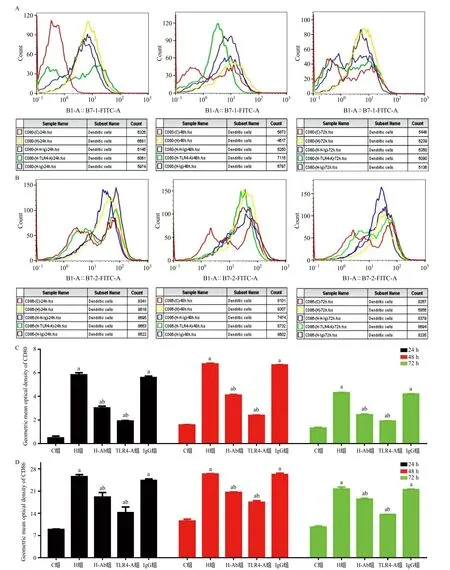
图5 各组大鼠mDCs共刺激分子的表达
本研究在分离、培养、纯化mDCs的基础上,使用HMGB1(1 μg/mL)刺激mDCs后,MyD88、NF-κB P65基因与蛋白的表达水平增高,细胞因子IL-6、IL-8、IL-12、TNF-α分泌增多,表面共刺激分子CD80、CD86表达上调。在使用HMGB1特异性中和抗体、TLR4拮抗剂后,HMGB1/TLR4信号通路的下游分子MyD88、NF-κB P65,细胞因子及共刺激分子的表达显著下降,其中TLR4-A组的下降程度比H-Ab组更大。研究证实mDCs表面共刺激分子(CD80、CD86等)和细胞因子(IL-12、TNF-α等)的表达可以分析、鉴定DCs成熟和活化[19]。根据研究结果初步推断HMGB1通过mDCs的TLR4发挥作用,可介导mDCs成熟、活化,调控炎症介质的分泌。因此,本研究为HMGB1/TLR4通路与DCs建立起一个新的功能(机制)联系,初步证实了此信号通路对DCs具有正向调控的作用,拮抗HMGB1,阻断TLR4具有负调控,为探讨HMGB1/TLR4信号通路介导DCs在IRI发病中的作用提供了重要的理论依据。
HMGB1的积累对IRI后的脏器是有害的[20],阻断HMGB1是治疗IRI的一种新策略[21]。然而,HMGB1不同浓度、不同刺激时间对DCs的调节作用具有双重性[19]。此外,许多在体实验也表明HMGB1作用机制的复杂性,有学者认为IRI前予以静脉注射HMGB1,具有脏器保护作用[22];OOZAWA等[23]发现心肌IRI后HMGB1表达增多,使用HMGB1处理损伤加重。大多数研究表明使用HMGB1抗体能减轻脏器IRI[24-25];也有报道称使用HMGB1单克隆抗体处理,会使IRI加重[21]。研究结果的不同,可能与实验条件、药物使用时间、剂量及模型所处疾病状态等有关,具体机制有待进一步探讨。因此,本研究结果是在特定条件下的细胞实验,与设计条件不同的在体实验可能缺乏一致性。
[1] FUNKEN D, ISHIKAWA-ANKERHOLD H, UHL B, et al.In situ targeting of dendritic cells sets tolerogenic environment and ameliorates CD4+T-cell response in the postischemic liver[J]. FASEB J, 2017, 31(11): 4796-4808.
[2] SNELGROVE S L, LO C, HALL P, et al. Activated renal dendritic cells cross present intrarenal antigens after ischemia-reperfusion injury[J]. Transplantation, 2017, 101(5):1013-1024.
[3] ZHAO H, CHEN Z, XIE L J, et al. Suppression of TLR4/NF-κB P65 signaling pathway improves cerebral ischemiareperfusion injury in rats[J]. Mol Neurobiol, 2018, 55(5):4311-4319.
[4] ZHAO G, FU C, WANG L, et al. Down-regulation of nuclear HMGB1 reduces ischemia- induced HMGB1 translocation and release and protects against liver ischemia-reperfusion injury[J]. Sci Rep, 2017, 7: 46272.
[5] SUN N, WANG H, WANG L. Protective effects of ghrelin against oxidative stress, inducible nitric oxide synthase and inf l ammation in a mouse model of myocardial ischemia/reperfusion injury via the HMGB1 and TLR4/NF-κB P65 pathway[J]. Mol Med Rep, 2016, 14(3): 2764-2770.
[6] CHEN C B, LIU L S, ZHOU J, et al. Up-regulation of HMGB1 exacerbates renal ischemia-reperfusion injury by stimulating inflammatory and immune responses through the tlr4 signaling pathway in mice[J]. Cell Physiol Biochem,2017, 41(6): 2447-2460.
[7] OKUSA M D, LI L. Dendritic cells in acute kidney injury:cues from the microenvironment[J]. Trans Am Clin Climatol Assoc, 2012, 123: 54-62.
[8] SHEN W, LADISCH S. Ganglioside GD1a impedes lipopolysaccharide-induced maturation of human dendritic cells[J]. Cell Immunol, 2002, 220(2): 125-133.
[9] KEZIĆ A, STAJIC N, THAISS F. Innate immune response in kidney ischemia/reperfusion injury: potential target for therapy[J]. J Immunol Res, 2017, 2017: 6305439.
[10] ADAMS S, O’NEILL D W, BHARDWAJ N. Recent advances in dendritic cell biology[J]. J Clin Immunol, 2005,25(3): 177-188.
[11] BAJWA A, HUANG L, YE H, et al. Dendritic cell sphingosine 1-phosphate receptor-3 regulates Th1-Th2 polarity in kidney ischemia-reperfusion injury[J]. J Immunol, 2012,189(5): 2584-2596.
[12] PONTICELLI C. Ischaemia-reperfusion injury: a major protagonist in kidney transplantation[J]. Nephrol Dial Transplant, 2014, 29(6): 1134-1140.
[13] BATAL I, AZZI J, MOUNAYAR M, et al. The mechanisms of up-regulation of dendritic cell activity by oxidative stress[J]. J Leukoc Biol, 2014, 96(2): 283-293.
[14] ZHANG M, UEKI S, KIMURA S, et al. Roles of dendritic cells in murine hepatic warm and liver transplantationinduced cold ischemia/reperfusion injury[J]. Hepatology,2013, 57(4): 1585-1596.
[15] LU L, ZHOU H, NI M, et al. Innate immune regulations and liver ischemia-reperfusion injury[J]. Transplantation, 2016,100(12): 2601-2610.
[16] ROMERO R, CHAIWORAPONGSA T, ALPAY SAVASAN Z, et al. Damage-associated molecular patterns (DAMPs) in preterm labor with intact membranes and preterm PROM:A study of the alarmin HMGB1[J]. J Matern Fetal Neonatal Med, 2011, 24(12): 1444-1455.
[17] NACE G W, HUANG H, KLUNE J R, et al. Cellular-specif i c role of toll-like receptor 4 in hepatic ischemia- reperfusion injury in mice[J]. Hepatology, 2013, 58(1): 374-387.
[18] DING H S, YANG J, CHEN P, et al. The HMGB1-TLR4 axis contributes to myocardial ischemia/reperfusion injury via regulation of cardiomyocyte apoptosis[J]. Gene, 2013, 527(1): 389-393.
[19] ZHU X M, YAO Y M, LIANG H P, et al. The effect of high mobility group box-1 protein on splenic dendritic cell maturation in rats[J]. J Interferon Cytokine Res, 2009, 29(10):677-686.
[20] LIN Y, CHEN L, LI W, et al. Role of high-mobility group box-1 in myocardial ischemia/reperfusion injury and the effect of ethyl pyruvate[J]. Exp Ther Med, 2015, 9(4): 1537-1541.
[21] ANDRASSY M, VOLZ H C, IGWE J C, et al. High-mobility group box-1 in ischemia-reperfusion injury of the heart[J].Circulation, 2008, 117(25): 3216-3226.
[22] ZHOU Y H, HAN Q F, WANG L H, et al. High mobility group box 1 protein attenuates myocardial ischemia reperfusion injury via inhibition of the p38 mitogen-activated protein kinase signaling pathway[J]. Exp Ther Med, 2017, 14(2):1582-1588.
[23] OOZAWA S, MORI S, KANKE T, et al. Effects of HMGB1 on ischemia-reperfusion injury in the rat heart[J]. Circ J,2008, 72(7): 1178-1184.
[24] SUGIHARA M, SADAMORI H, NISHIBORI M, et al. Anti-high mobility group box 1 monoclonal antibody improves ischemia/reperfusion injury and mode of liver regeneration after partial hepatectomy[J]. Am J Surg, 2016, 211(1): 179-188.
[25] MIURA K, SAHARA H, SEKIJIMA M, et al. Protective effect of neutralization of the extracellular high-mobility group box 1 on renal ischemia-reperfusion injury in miniature swine[J]. Transplantation, 2014, 98(9): 937-943.

