丹参酮IIA对慢性肾功能衰竭大鼠认知障碍的神经保护作用及其机制
朱鸣,王小同,闵晶晶,陈琪,王霄一
(1.湖州市第一人民医院 肾内科,浙江 湖州 313000;2.温州医科大学附属第二医院 康复科,浙江温州 325027;3.湖州市第一人民医院 神经内科,浙江 湖州 313000)
慢性肾功能衰竭(chronic renal failure,CRF)是指各种原发性肾脏疾病或继发于其他相关疾病引起的肾功能受损及恶化,是全球老年患者最普遍的公共健康问题之一。近年来我国的一项大型研究显示慢性肾脏疾病(chronic kidney disease,CKD)的患病率为10.8%,这意味着我国大约有1.2亿患者[1],这些患者可能最终都会进入CRF阶段。越来越多的研究开始关注到CRF患者的认知障碍问题,通常表现为注意力不集中、暂时性和延迟性记忆障碍、定向障碍、执行功能下降和思维迟缓、失眠、冷漠、烦躁易怒等症状,甚者可出现幻听、幻视、偏执和妄想等精神障碍,并且会随肾功能水平下降而恶化,严重影响了患者对治疗计划的依从性以及生活质量。约1/3的CKD患者和终末期肾病患者都存在不同程度的认知功能障碍[2]。透析治疗虽然是治疗终末期肾脏病并从体内去除累积毒素的首选方法,但仍无法阻止CRF患者认知障碍的发生与进展,有研究表明在接受透析的CRF患者中约70%存在中度或重度认知障碍[3]。
内质网是细胞内专门从事蛋白质合成、折叠、装配和修饰的细胞器。当内质网中的未折叠蛋白聚集负荷超过了内质网的正常折叠能力时,将诱发内质网应激(endoplasmic reticulum stress,ERS)。其中GRP78是内质网的关键分子伴侣之一,在ERS的激活中起重要作用。ERS不仅可以启动有保护作用的未折叠蛋白反应和内质网相关降解,持续过度的ERS还可以触发ERS相关凋亡,这其中包括ERS诱导的CHOP/GADD153表达、JNK的活化和Caspase-12蛋白水解酶的活化等[4-5]。氧化应激是指人体受到有害刺激时由活性氧自由基ROS引起的病理反应。研究表明,氧化应激与认知障碍的发生和发展密切相关。过度的ROS可能破坏细胞结构,诱导凋亡甚至坏死[6]。
丹参酮I IA(tanshinone I IA,Tan I IA)是丹参中含量最高的二萜醌类化合物,具有抗炎、抗凋亡、抗氧化及抗动脉粥样硬化等作用[7-9]。有研究证明Tan I IA可以改善ERS诱导的心肌细胞凋亡[10],还可逆转血管性痴呆大鼠的学习和记忆缺陷,主要机制可能与其抗自由基损伤、调节谷氨酸和γ-氨基丁酸等神经递质含量有关[11]。但目前关于Tan I IA是否能保护CRF诱导的认知功能障碍及其与ERS相关凋亡的关系尚未明确。本研究旨在评估Tan I IA对CRF相关认知功能障碍大鼠的神经保护作用及是否与调控ERS相关凋亡、氧化应激有关。
1 材料和方法
1.1 材料
1.1.1 主要试剂和药物:Tan I IA磺酸钠注射液(诺新康)(2 mL∶10 mg)购自杭州华东医药股份有限公司,由上海第一生化药业有限公司生产。ERS激活剂衣霉素(tunicamycin,TM,美国Sigma-Aldrich公司),小鼠抗大鼠多克隆GRP78抗体(1∶1000)、小鼠抗大鼠多克隆CHOP抗体(1∶1000)、兔抗大鼠多克隆GAPDH抗体(1∶1000)均购买自美国Santa Cruz公司,兔抗大鼠Caspase-12抗体(1∶2000)购买自美国Abcam公司。Tunel试剂盒购买自瑞士罗氏公司。丙二醛(malonaldehyde,MDA)测定试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒均购自南京建成生物工程研究所。
1.1.2 主要仪器和设备:医用微波炉(广东格兰仕公司),DK-S12型电热恒温水浴锅(上海森信实验仪器有限公司),显微镜(日本Nikon公司),STP12脱水机、HM335E切片机、AP280-2包埋机(德国Microm公司),LEICA彩色病理图像分析系统(德国LEICA公司),超低温冰箱(日本Sanyo公司),Morris水迷宫(北京硕林苑科技有限公司)。
1.2 方法
1.2.1 分组与造模:SD雄性大鼠60只,初始体质量150~180 g,购于上海西普尔必凯实验动物有限公司,实验动物许可证号:SYXK(浙)2013-0184。随机分为5组,每组12只,分别为:对照组、模型组、TM组、TM+Tan I IA组和Tan I IA组。模型组、TM组、TM+Tan I IA组和Tan I IA组大鼠用10%水合氯醛麻醉,呈俯卧位固定于操作台上,从距右侧脊肋骨1.5 cm处斜向外方切口,暴露出右侧肾脏,将整个右肾切除。1周后再次用10%水合氯醛麻醉后,俯卧位固定于操作台上,从距左脊肋骨1.5 cm处斜向外方切口,暴露左侧肾脏,分离肾周围脂肪囊后将肾的上下极各1/3切除,明胶海绵压迫切面止血,复位肾脏,缝合,2次手术共切除5/6肾脏。4周时检测血肌酐、尿素氮水平,若均大于对照组20%,证实造模成功。造模4周后开始至12周,TM组和TM+Tan I IA组腹腔注射TM,剂量为4.5 mg/kg,2次/周;TM+Tan I IA组和Tan I IA组各给予Tan I IA 15 mg/kg,1次/d,腹腔注射,对照组注射等量0.9%氯化钠溶液。
1.2.2 Morris水迷宫实验:采用Morris水迷宫检测大鼠的学习记忆能力。造模12周后进行训练测试,将大鼠头朝池壁放入水中,取东、南、西、北4个象限任选1个放入水中,水迷宫上方挂有自动摄像系统用以记录实验大鼠寻找平台的路线,逃避潜伏期。若60 s后仍不能找到平台,则系统自动默认潜伏期为60 s,在第1、第2天若未找到则将其引导至平台适应10 s,第3天开始不再引导。每只大鼠训练5 d,每天训练3次。第6天进行平台搜索实验,将平台撤去,任选一个象限将大鼠放入水中,其后4组大鼠均从同一个象限入水,观察并记录60 s内大鼠穿越平台的次数。
1.2.3 取材:水迷宫实验结束后,将大鼠经6%水合氯醛腹腔麻醉,0.9%氯化钠溶液快速心脏灌注将血液冲净后,置于冰盘上取脑,快速分离海马-80 ℃冰箱保存。HE染色、Tunel染色海马标本置于4%多聚甲醛固定。
这样,如果司法机关严格执行宽严相济刑事政策,判处死刑的案件就会增加。这种增加显然不符合刑罚轻缓化的世界潮流。在刑罚轻缓化思潮与宽严相济刑事政策之间冲突的协调中,对严重刑事案件判处死刑但缓期二年执行是一条走得通的道路。这种死刑缓期两年执行的判决,一方面满足了从严办理严重刑事案件的政策要求,另一方面又不至于使刑罚整体上呈现出过分偏重于重刑而完全有悖于刑罚轻缓化趋势的情况。
1.3 统计学处理方法 采用SPSS17.0统计软件进行统计学处理。所有数据均进行正态性、方差齐性检验,以±s表示,水迷宫逃避潜伏期采用重复测量资料的方差分析,其他数据组间比较均采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 Morris水迷宫检测大鼠学习记忆能力 图1显示了各组搜索平台的路线图,模型组、TM组搜索平台路线较对照组明显延长,加入Tan I IA后路线距离明显缩短。各组之间,训练前2 d逃避潜伏期差异无统计学意义(P>0.05);与对照组比,模型组、TM组大鼠从第3天开始逃避潜伏期明显延长(P<0.05),且TM组较模型组逃避潜伏期更长(P<0.05)。
1.2.4 海马组织、血清中MDA和SOD含量测定:取海马组织匀浆液和血清各0.1 mL,采用TBA比色法,比色波长532 nm,按照试剂盒说明检测MDA含量。使用冷的0.9%氯化钠溶液作为匀浆介质,海马匀浆液3000 r/min离心10 min,取40 μL上清液,取血清20 μL,采用黄嘌呤氧化酶法,比色波长550 nm,按照试剂盒说明书检测SOD含量。
1.2.5 HE染色:取经过4%多聚甲醛固定的海马,在0.01 mol/L的PBS中浸泡过夜,按照常规梯度乙醇脱水,石蜡包埋,切片,经二甲苯脱蜡及梯度乙醇复水后,行HE染色,再使用梯度乙醇脱水,滴加中性树胶封片,显微镜拍照观察。
1.2.6 Tunel染色:经4%多聚甲醛固定的海马石蜡切片用蒸馏水洗涤后,在37 ℃下与蛋白质消化酶一起温育20 min,然后,使用Tunel凋亡试剂盒按照说明书进行分析。
1.2.7 Western blot检测:取60 mg海马组织使用RIPA裂解液充分裂解后抽提总蛋白,离心后取上清液。依照BCA蛋白定量试剂盒的使用方法检测上清中蛋白浓度。根据蛋白浓度加入相应体积的总蛋白与5×SDS-PAGE加样缓冲液混合煮沸5~10 min后加入加样孔,进行SDS-PAGE电泳。用湿转法将分离胶上的蛋白转移到PVDF膜上,用5%脱脂奶粉封闭,分别加入CHOP(1∶1000)、GRP78(1∶1000)和Caspase-12一抗(1∶2000)稀释液,以及内参GAPDH抗体(1∶1000)稀释液,4 ℃摇床孵育过夜,TBST洗膜后用稀释好的二抗(HRP标记山羊抗鼠/抗兔二抗1∶5000)室温下孵育2 h,洗膜,显影后定影,自动成像系统成像并分析。TM组在使用Tan I IA干预后水迷宫训练的第3天开始逃避潜伏期较TM组明显缩短(P<0.05),造模后单纯使用Tan I IA干预的大鼠第3天逃避潜伏期缩短更明显,第5天时接近正常水平(P<0.05),见图2。水迷宫实验第6天的空间探索实验中,与对照组比,模型组穿越平台次数明显减少(P<0.05),TM组减少更加明显(P<0.05),而TM组在使用Tan I IA干预后穿越平台次数增加(P<0.05),单纯使用Tan I IA干预组大鼠穿越平台次数接近对照组,见图3。

图1 各组搜索平台的路线图
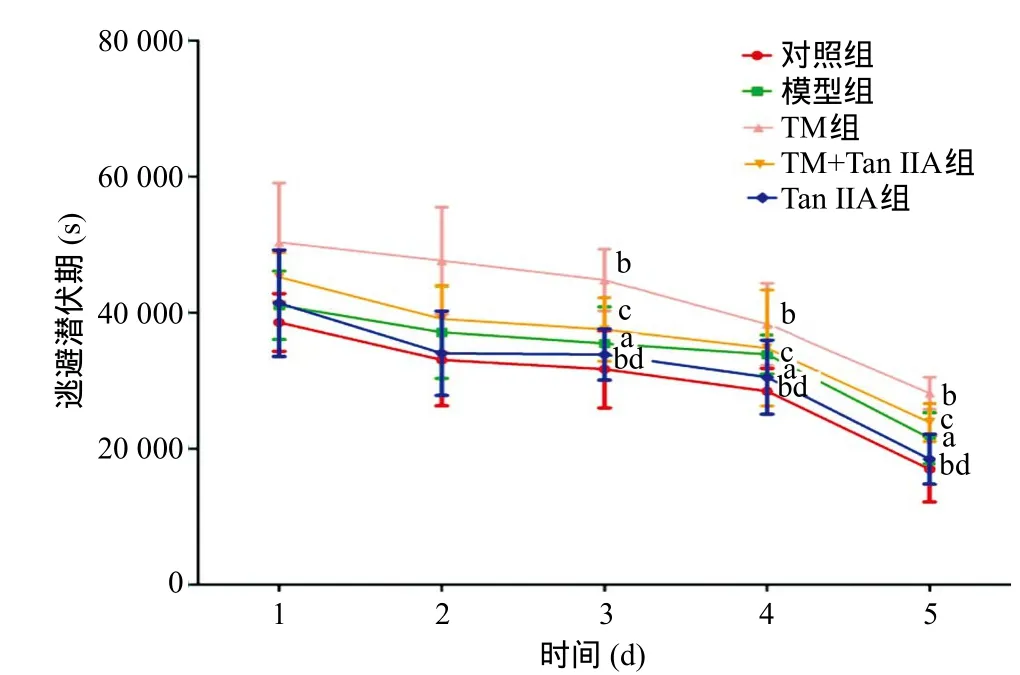
图2 各组逃避潜伏期
2.2 大鼠血清和海马MDA、SOD含量比较 模型组血清、海马组织中MDA含量较对照组明显升高(P<0.05),加入TM干预后进一步升高(P<0.05),而模型组和TM组在各自加入Tan I IA干预后MDA含量明显下降(P<0.05),造模后单纯加入Tan I IA较TM+Tan I IA组大鼠大鼠血清、海马MDA含量下降更明显(P<0.05)。模型组血清、海马组织中SOD含量较对照组明显下降(P<0.05),加入TM干预后进一步下降(P<0.01),而模型组和TM组在分别加入Tan I IA干预后SOD含量明显升高(P<0.05),单纯加入Tan I IA的较TM+Tan I IA组大鼠血清、海马SOD含量升高更明显(P<0.01)。见表1。

图3 穿越平台次数
表1 各组大鼠血清和海马MDA含量及SOD活力比较(n=12, ±s)

表1 各组大鼠血清和海马MDA含量及SOD活力比较(n=12, ±s)
与对照组比:aP<0.05;与模型组比:bP<0.05,cP<0.01;与TM组比:dP<0.05;与TM+Tan I IA组比:eP<0.05,fP<0.01
SOD血清(μmol/L) 海马(μmol/g) 血清(kU/L) 海马(kU/g)对照组 6.18±1.03 31.53± 7.47 236.56± 7.33 421.67±21.41模型组 10.21±1.55a 43.72±12.59a 188.62±17.49a 278.73±43.52a TM组 13.46±1.78b 58.59±15.36b 105.76±12.85b 163.58±32.75c TM+Tan IIA组 9.73±1.14d 45.84± 8.55d 169.83±10.48d 252.24±28.46d Tan IIA组 7.12±1.34be 37.82±10.24be 210.73±20.56be 378.53±36.64cf组别 MDA
2.4 各组大鼠12周时海马凋亡情况比较 与对照组比,模型组凋亡细胞百分比明显增高(P<0.05);与模型组比,TM组凋亡细胞百分比更进一步升高,使用Tan I IA干预后可明显降低模型组和TM组的凋亡率(P<0.05),造模大鼠单纯使用Tan I IA干预较TM+Tan I IA组凋亡百分比降低更明显(P<0.01)。见图5。
2.5 Western blot检测各组海马组织GRP78、CHOP、Caspase-12蛋白表达 Western blot结果显示模型组大鼠海马GRP78、CHOP、Caspase-12蛋白水平较对照组比明显增加(P<0.05),TM组上述蛋白表达更进一步升高(P<0.05),加入Tan I IA干预后上述蛋白表达明显下降(P<0.05),单纯加入Tan I IA干预较TM+Tan I IA组GRP78、CHOP、Caspase-12蛋白表达下降更明显(P<0.05)。见图6。
3 讨论
ERS在细胞应激过程中起着重要作用,作为ERS的重要信号通路之一,未折叠蛋白反应(unfolded protein reaction,UPR)主要是通过改善内质网中蛋白质负载和折叠能力之间的平衡,以及营养因子和(或)生长因子的分泌,进而减轻ERS并促使细胞存活[12-14]。严重而持续的ERS超过内质网所能承受的范围时,则会对细胞造成损伤或触发细胞凋亡信号途径引起细胞死亡,这被称为ERS相关的细胞凋亡[4,12-14]。GRP78是内质网的关键分子伴侣之一,在ERS的激活中起重要作用。GRP78表达的上调是ERS活化的标志。ERS诱导的凋亡与CHOP和Caspase-12表达密切相关。CHOP是转录因子家族C/EBP的成员,在正常生理条件下其表达水平非常低,当内质网受到应激时,CHOP被显著诱导并参与下游凋亡相关基因的表达[4,12-14]。Caspase-12是内质网膜蛋白,通过ERS诱导的降解诱导细胞凋亡。因此,Caspase-12是内质网凋亡信号通路中的关键分子[4,12-14]。

图4 各组大鼠海马12周病理形态学改变(HE,×200)
许多神经退行性疾病的发病机制与ERS及其相关凋亡密切相关。阿尔茨海默病(Alzheimer’s disease,AD)是最常见的神经退行性疾病,其特征在于渐进性认知功能减退和神经元退行性改变。AD的主要病理改变是错误折叠的Aβ蛋白,以及作为神经原纤维缠结成分的老年斑和tau蛋白的形成[15-16]。人脑中的早老素1蛋白(presenilin 1,PS-1)随着年龄的增长而增加并且影响老年人的记忆。编码这种蛋白质的PS-1基因的突变被认为与AD的发病密切相关。有研究发现,PS-1突变细胞可提高ERS的敏感性,使GRP78/Bip mRNA的表达受到明显抑制,进而使神经元更易受到过度应激引起损伤[17]。与此不同,在AD大鼠模型中,敲除Caspase-12可明显抑制ERS诱导的细胞凋亡[17]。在持续光照诱导空间认知障碍的大鼠模型中发现tau蛋白存在多个位点磷酸化且GRP78/Bip及CHOP表达增加,从而证明AD样分子病理损伤也涉及ERS[18]。帕金森氏病(Parkinson’s disease,PD)被认为是一种以α-突触核蛋白为主要成分的聚集体在胞浆内聚积,进而引起黑质多巴胺能神经元细胞选择性死亡的神经退行性病变。有研究表明,ERS诱导剂,如毒胡萝卜素(thapsigargin,TG)和布雷菲德菌素A(brefeldin A,BFA),能引起大量多巴胺能神经元的死亡,并且发现人神经母细胞瘤SH-SY5Y在经过多巴胺处理以后出现了CHOP等一些与ERS相关的凋亡蛋白表达的增加及细胞的死亡[19-20]。本研究观察到CRF大鼠中存在着一定程度的学习记忆障碍以及海马神经元结构的破坏,同时伴随有GRP78、CHOP及Cas-pase-12表达的增加,而ERS诱导剂TM更进一步加重了上述改变,说明CRF大鼠的认知障碍与ERS诱导的细胞凋亡密切相关。

图5 各组大鼠12周海马凋亡图(A-E,Tunel染色,×200)及细胞凋亡率比较(F)

图6 各组海马组织GRP78、CHOP、Caspase-12蛋白Western blot检测(A)及统计图(B)
Tan IIA是丹参中含量最高的活性成分,具有清除自由基、抗氧化、降低血液黏度、抑制血液凝固、促进纤维蛋白溶解、抑制血小板聚集、促进血栓溶解的作用。最近的研究证实Tan I IA具有神经保护作用[7-9]。研究表明Tan I IA可以通过维持锥体细胞在海马CA1区域的兴奋性和突触可塑性来改善慢性缺氧大鼠的认知缺陷[21]。Tan I IA也可以通过减少海马长时程增强抑制来改善癫痫大鼠的认知功能障碍[22]。它可以通过抗氧化应激、增加海马谷氨酸和γ-氨基丁酸含量,在血管性痴呆大鼠中起到神经保护作用[11]。
MDA是脂质过氧化物的最终产物,可反映氧自由基的产生,SOD是人体内重要的氧化自由基清除剂,可以消除氧化自由基对体内脂质和碳水化合物代谢的影响及其对细胞的损伤,从而保护身体免受损伤。本研究表明,Tan I IA可以降低大鼠血清、海马组织MDA活性,增加SOD水平,表明Tan I IA具有抗氧化应激的作用并且可以抑制脂质过氧化。在抗凋亡研究方面,有学者发现Tan I IA能显著抑制H2O2诱导的心肌细胞凋亡,增加心肌细胞中Bcl-2/Bax蛋白比率,减少Tunel阳性细胞和Caspase-3的激活[23]。也有研究发现Tan I IA可通过激活PI3K/Akt和磷酸化GSK3/β抑制Aβ25-35诱导的凋亡[24]。此外,还有研究发现Tan I IA能通过调控Bcl-2家族蛋白中抗凋亡蛋白和线粒体膜超极化、抑制cytC释放和Caspase-3活性,从而靶向抑制线粒体凋亡途径来抑制慢性低氧诱导的H9C2细胞凋亡[25]。本研究发现Tan I IA可以改善CRF模型组大鼠记忆障碍,下调GRP78、CHOP及Caspase-12蛋白表达,减少凋亡细胞,改善海马神经元结构,在加入ERS激活剂TM干预后,造模大鼠的ERS相关凋亡情况、海马神经元破坏较模型组更明显,认知障碍更为突出,但加入Tan I IA后可以得到明显改善,说明Tan I IA可能通过抑制ERS相关凋亡、抗氧化应激发挥神经保护作用。
综上所述,在本研究中,通过Morris水迷宫训练发现模型组大鼠学习记忆能力较对照组明显下降,使用TM干预后下降更为明显,在加入Tan I IA干预后模型大鼠在搜索平台试验和穿越平台次数试验中表现都明显改善。造模12周以后模型组大鼠ERS相关凋亡水平显著上升,GRP78、CHOP、Caspase-12蛋白表达水平和凋亡细胞百分比增加,MDA水平增加,SOD水平降低,细胞结构破坏明显,使用TM后ERS相关凋亡水平,氧化应激水平进一步上升,细胞结构破坏较模型组更明显,而Tan I IA干预后ERS凋亡水平显著下降,抗氧化应激能力显著提高,细胞结构得到明显改善。说明在CRF相关的认知障碍中Tan I IA可能可以通过抑制ERS相关凋亡、抗氧化应激来发挥神经保护、改善认知作用。
[1] ZHANG L, WANG F, WANG L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet,2012, 379(9818): 815-822.
[2] WANG J, LI X B, HUANG P, et al. Change of peripheral blood Treg/Thl7 in cognitive impairment with chronic renal failure patients[J]. Cell Physiol Biochem, 2018, 45(1): 281-290.
[3] MURRAY A M, TUPPER D E, KNOPMAN D S, et al. Cognitive impairment in hemodialysis patients is common[J].Neurology, 2006, 67(2): 216-223.
[4] KIM I, XU W, REED J C. Cell death and endoplasmic reticulum stress: disease relevance and therapeutic opportunities[J]. Nat Rev Drug Discov, 2008, 7(12): 1013-1030.
[5] 项冰倩, 高慧, 陈锡文, 等. 内质网过度应激介导低氧高二氧化碳肺动脉高压大鼠的脑损伤[J]. 生理学报, 2017,69(4): 413-421.
[6] KOVALČÍKOVÁ A, GYURÁSZOVÁ M, VAVRINCOVÁYAGHI D, et al. Oxidative stress in the brain caused by acute kidney injury[J]. Metab Brain Dis, 2018, 33(3): 961-967
[7] FENG J, LI S, CHEN H. Tanshinone IIA inhibits myocardial remodeling induced by pressure overload via suppressing oxidative stress and inf l ammation:Possible role of silent information regulator 1[J]. Eur J Pharmacol, 2016, 791: 632-639.
[8] ZHANG Z, LI Y, SHENG C, et al. Tanshinone IIA inhibits apoptosis in the myocardium by inducing microRNA-152-3p expression and thereby downregulating PTEN[J].Am J Transl Res, 2016, 8(7): 3124-3132.
[9] WENG Y S, WANG H F, PAI P Y, et al. Tanshinone IIA prevents Leu27 IGF-II-induced cardiomyocyte hypertrophy mediated by estrogen receptor and subsequent akt activation[J].Am J Chin Med, 2015, 43(8): 1567-1591
[10] FENG J, LI S, CHEN H. Tanshinone IIA ameliorates apoptosis of cardiomyocytes induced by endoplasmic reticulum stress[J]. Exp Biol Med (Maywood), 2016, 241(18): 2042-2048.
[11] 何治, 潘志红, 鲁文红. 丹参酮I I A对血管性痴呆大鼠的神经保护作用机制[J]. 中国中药杂志, 2010, 35(14): 1883-1886.
[12] XIANG C, WANG Y, ZHANG H, et al. The role of endoplasmic reticulum stress in neurodegenerative disease[J].Apoptosis, 2017, 22(1): 1-26.
[13] HOTAMISLIGIL G S. Endoplasmic reticulum stress and atherosclerosis[J]. Nat Med, 2010, 16(4): 396-399.
[14] BÁNHEGYI G, BAUMEISTER P, BENEDETTI A, et al.Endoplasmic reticulum stress[J]. Ann N Y Acad Sci, 2010,1113: 58-71.
[15] HARDY J, SELKOE D J. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics[J]. Science, 2002, 297(5580): 353-356.
[16] 吴彬彬, 董张雷, 连庆泉. 线粒体功能障碍与阿尔茨海默病[J]. 温州医科大学学报, 2014, 44(7): 543-546.
[17] SIMAN R, FLOOD D G, THINAKARAN G, et al. Endoplasmic reticulum stress-induced cysteine protease activation in cortical neurons: effect of an Alzheimer’s disease-linked presenilin-1 knock-in mutation[J]. J Biol Chem,2001, 276(48): 44736-44743.
[18] LING Z Q, TIAN Q, WANG L, et al. Constant illumination induces Alzheimer-like damages with endoplasmic reticulum involvement and the protection of melatonin[J]. J Alzheimers Dis, 2009, 16(2): 287-300.
[19] RYU E J, HARDING H P, ANGELASTRO J M, et al. Endoplasmic reticulum stress and the unfolded protein response in cellular models of Parkinson’s disease[J]. J Neurosci,2002, 22(24): 10690-10698.
[20] GÓMEZ-SANTOS C, BARRACHINA M, GIMÉNEZXAVIER P, et al. Induction of C/EBPβ and GADD153 expression by dopamine in human neuroblastoma cells: Relationship with α-synuclein increase and cell damage[J]. Brain Res Bull, 2005, 65(1): 87-95.
[21] 魏敏, 闫志强, 董明清, 等. 丹参酮I I A预防慢性缺氧大鼠认知功能障碍的电生理机制[J]. 现代生物医学进展, 2012,12(11): 2057-2060.
[22] 姜珊, 陆西萍, 高华, 等. 丹参酮I I A对癫痫大鼠认知功能障碍的治疗作用[J]. 神经解剖学杂志, 2014, 30(4): 452-456.
[23] FU J, HUANG H, LIU J, et al. Tanshinone IIA protects cardiac myocytes against oxidative stress-triggered damage and apoptosis[J]. Eur J Pharmacol, 2007, 568(1-3): 213-221.
[24] DONG H, MAO S, WEI J, et al. Tanshinone IIA protects PC12 cells from β-amyloid (25-35)-induced apoptosis via PI3K/Akt signaling pathway[J]. Mol Biol Rep, 2012, 39(6):6495-6503.
[25] JIN H J, XIE X L, YE J M, et al. Tanshinone IIA and cryptotanshinone protect against hypoxia-induced mitochondrial apoptosis in H9c2 cells[J]. PLoS One, 2013, 8(1): e51720.

