Wnt通路基因启动子甲基化在非小细胞肺癌诊断中的作用
程光嘉,刘顺林,朱国良,王金志
(1.奉化区人民医院 老年科,浙江 宁波 315500;2.苏州大学附属第一医院 呼吸与危重症医学科,江苏 苏州 215600;3.湖州市第一人民医院 病理科,浙江 湖州 313000;4.苏州大学 基础医学与生命科学学院,江苏 苏州 215007)
肺癌在中国是最常见的癌症,也是中国癌症死亡的主要原因。肺癌可分为非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),其中,NSCLC包括腺癌、鳞癌和大细胞肺癌。尽管近年来对肺癌的诊断和治疗不断发展,但其5年生存率仍然很低。因此,我们急需一种或多种对肺癌诊断和判断预后有效的分子标志物。
DNA甲基化是一种常见的表观遗传修饰方法。CpG岛的异常DNA甲基化可能导致肺癌抑癌基因的失活,从而引起肺癌发生。由于DNA甲基化可能是肺癌最早期和最频繁的改变,因此,越来越多的研究旨在评估某些基因启动子程度,以发现早期癌症。Wnt信号通路组件与NSCLC的启动和发展有显著关联,分泌型卷曲相关蛋白(secreted frizzledrelated protein,SFRP)家族(SFRP1-SFRP5)和Wnt分子抑制因子-1(Wnt inhibitory factor1,WIF1)可通过直接与Wnt分子结合而抑制Wnt通路信号。SFRP1启动子甲基化已经在包括肺癌在内的许多肿瘤中被报道,而SFRP2和WIF1启动子甲基化也曾被报道通过Wnt信号通路在肺癌的发生发展中起重要作用[1]。蛋白质激酶C-B(protein kinase C-B,PRKCB)属于蛋白质激酶家族成员,其主要功能是参与各种信号转导途径包括Wnt信号通路的蛋白质磷酸化。据报道,PRKCB在肺腺癌发展的早期阶段即已发生甲基化,这表明其在肺腺癌的发生发展中起着一定作用[2]。
考虑到Wnt抑制剂在癌症进展和预后的重要作用,我们评估在Wnt信号通路中4种肿瘤抑制基因SFRP1、SFRP2、WIF1、PRKCB启动子甲基化与NSCLC发生风险的相互关系,同时,研究其与NSCLC临床病理因素之间的关系,以及结合这4种基因启动子甲基化水平检测能否为早期诊断NSCLC提供帮助。
1 对象和方法
1.1 对象 收集2010年8月至2013年10月在湖州市第一人民医院病理科存档的111例肺癌组织标本及相对应的癌旁组织标本(腺癌69例,鳞癌42例),其中男73例,女38例,平均年龄(63.1±10.2)岁。肿瘤的分期根据国际癌症联盟2009年TNM分期。所有患者术前均未进行化疗与放疗。所有参与患者均知情同意,并获得本院伦理委员会批准通过。
1.2 石蜡包埋组织DNA的提取 挑选保存完好的石蜡切片,按照石蜡包埋组织DNA提取试剂盒说明书进行全基因组DNA的提取。再通过NanoDrop2000超微量分光光度计检测DNA的浓度,检测提取的DNA样品。1.3 亚硫酸氢盐转化 对于质量达标的基因组DNA采用甲基化转化试剂盒进行亚硫酸氢盐转化实验。此过程严格按照说明书进行操作。
1.4 荧光定量甲基化特异性聚合酶链式反应(qua
ntitative methylation-specific PCR,qMSP) 甲基化引物分别与DNA甲基化、水、SYBR Green I染料混匀进行荧光定量PCR扩增。每个基因的PCR反应都有各自的反应条件,为得到满意的特异性的溶解曲线,需分别对每个基因的PCR反应条件优化。每例标本设3个复孔,并设置阳性、阴性对照确保实验的可靠性和准确性。荧光定量PCR过程在Roche LightCycler 480荧光定量PCR仪中操作,甲基化水平用甲基化百分比参数(percentage of methylated reference,PMR)表示。
1.5 统计学处理方法 采用SPSS18.0统计学软件进行统计分析。采用两样本率的χ2检验以及Fisher确切概率法,配对样本甲基化率用配对样本t检验或Wilcoxon秩和检验。以癌旁组织为对照绘制ROC曲线,并计算曲线下面积(area under curve,AUC)。判断标准:AUC<0.5时无诊断价值;AUC为0.5~0.7时准确性较低;AUC为0.7~0.9时准确性较高;AUC>0.9时准确性最高。P<0.05为差异有统计学意义。
2 结果
2.14种基因在NSCLC中甲基化水平SFRP1、SFRP2、
PRKCB和WIF1基因在肺癌组织中PMR分别为(11.23±4.67)%, (36.78±15.69)%, (24.57±6.89)%和(76.05±22.21)%,在相对应的癌旁组织则分别为(3.47±1.12)%, (16.76±6.87)%, (15.17±6.75)%和(58.76±18.75)%。结果显示4种基因甲基化水平在肺癌组织明显高于癌旁组织(见图1)。临床资料统计发现,SFRP1、SFRP2在男性NSCLC患者中甲基化水平升高,而PRKCB和WIF1与年龄、性别、分化程度及有无吸烟等临床特征无关(见表1)。
2.24种基因甲基化水平在NSCLC中的诊断价值 以癌旁组织为对照绘制ROC曲线,并计算AUC,SFRP1的AUC(95%CI)为0.711(0.642~0.780),诊断NSCLC的敏感性为62.2%,特异性为77.5%;SFRP2的AUC(95%CI)为0.631(0.577~0.704),诊断NSCLC的敏感性为47.7%,特异性为80.2%;PRKCB的AUC(95%CI)为0.650(0.578~0.721),其诊断NSCLC的敏感性为59.5%,特异性为68.5%;WIF1的AUC(95%CI)为0.573(0.498~0.648),特异性和敏感性均较低。但联合这4种基因甲基化水平诊断NSCLC,AUC(95%CI)为0.747(0.683~0.811),诊断的敏感性为83.3%,特异性为96.0%;联合这4种基因甲基化水平诊断肺腺癌,其AUC(95%CI)为0.798(0.724~0.871),其诊断的敏感性为88.4%,特异性为96.7%;联合这4种基因甲基化水平诊断肺鳞癌,其AUC(95%CI)为0.728(0.620~0.837),其诊断的敏感性为90.6%,特异性为93.0%。见图2。
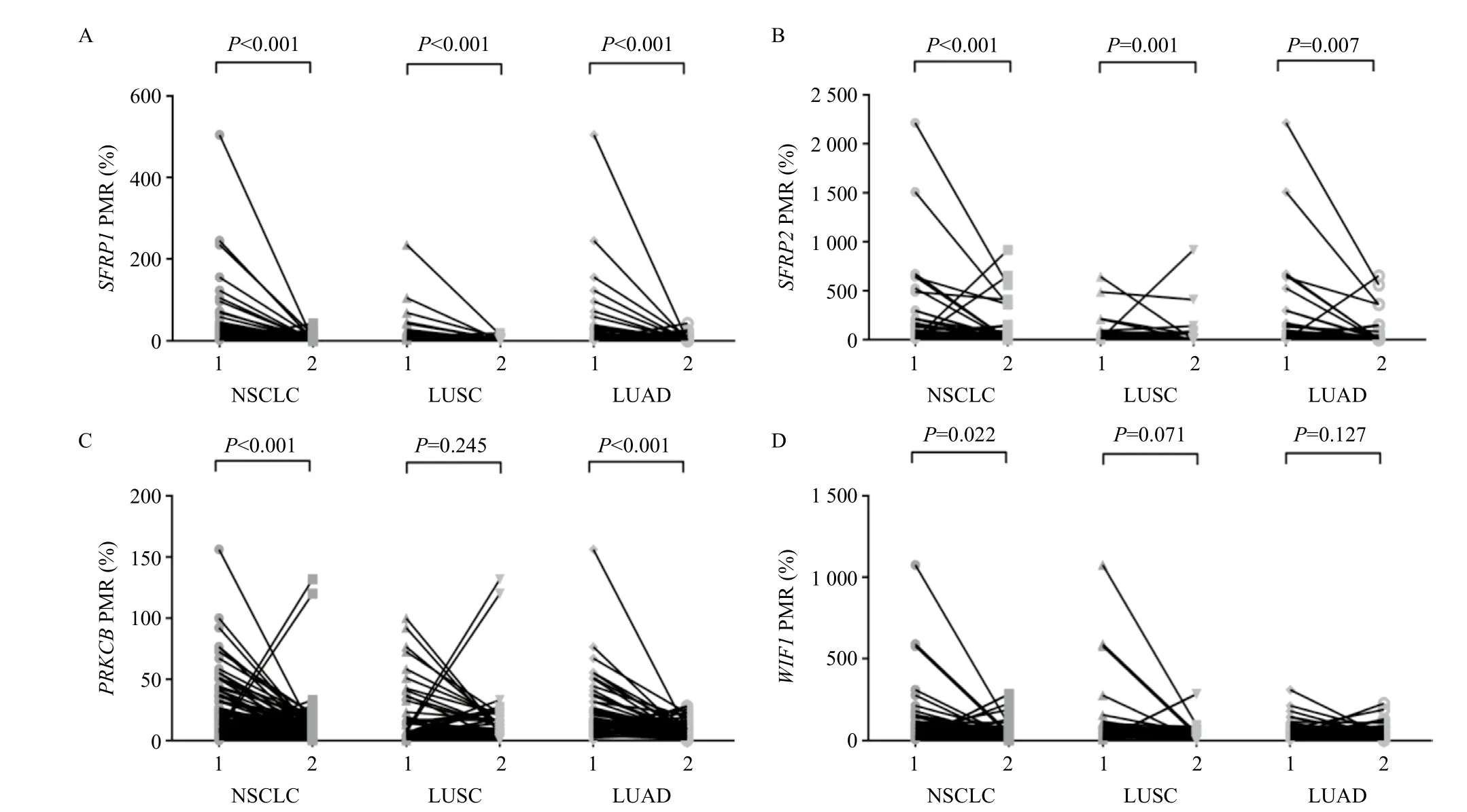
图1 SFRP1(A)、SFRP2(B)、PRKCB(C)、WIF1(D)在肺癌组织和相对应癌旁组织中甲基化水平的比较

表1 联合4种基因甲基化在肺癌中的诊断及其与临床病理特征的关系[ M(P25,P75),%]
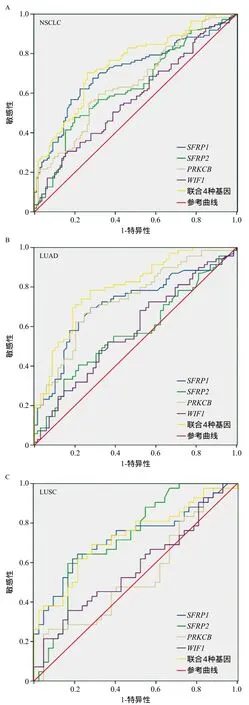
图2 以癌旁组织为对照绘制ROC曲线
3 讨论
当前,对肺癌的诊断主要结合临床症状、影像学表现以及组织病理学检查[3]。然而,大多数患者的临床表现出现较迟,一旦出现典型的临床表现时,大多数患者预后往往不佳。表观遗传学的价值主要在于能够早期发现肿瘤并对治愈肿瘤提供帮助。而异常甲基化在肺癌的早期阶段即已发生作用,为早期诊断肺癌提供帮助[4]。表观遗传学生物标志物可用作为早期肺癌诊断的有效工具,而且具有非侵入性、高灵敏度和高特异性[5]。目前,传统的血浆蛋白,例如细胞角蛋白19片段(cyfra211)、癌胚抗原(CEA)、特异性神经元烯醇化酶(NSE)作为肿瘤标志物均缺乏足够的灵敏度,诊断效率低[6]。
许多研究已经在甲基化测试中进行常规的MSP试验,然而,qMSP较传统的MSP更为敏感,甲基化的改变在肿瘤的发生中是多样化的。迄今为止,尚未发现在每一个NSCLC标本中存在单一基因的甲基化。此外,大多数研究发现,通过使用单个基因来研究甲基化水平,敏感性通常很低。因此,联合研究一组基因的甲基化水平可以提高诊断NSCLC的敏感性。
Wnt信号通路的失调与肺癌的发生密切相关[7]。Wnt信号通路中抑制剂的超甲基化可以沉默抑癌基因从而参与肿瘤的发生发展[8]。因此,本研究检测4种候选基因的甲基化来预测肿瘤的发生风险。
为了能够评估这4种候选基因的诊断效率,本研究收集110例NSCLC组织标本及其配对的癌旁组织标本,检测SFRP1、SFRP2、WIF1、PRKCB这4种基因甲基化水平。研究发现这4种基因在肺癌组织中表达较其相对的癌旁组织高;另外,从TCGA数据库中817例NSCLC标本和29例正常组织标本的甲基化水平中发现,SFRP1、SFRP2、WIF1、PRKCB的AUC值分别是0.705、0.317、0.959和0.857,其中SFRP2的表达较低。DNA甲基化主要调节基因表达而且在肿瘤发生的早期阶段,而单一的基因甲基化灵敏度相对较低,因此,结合多种基因甲基化水平可增加诊断肺癌的效率。
相关研究表明,SFRP1甲基化诊断皮肤鳞状上皮癌[9]和食管鳞状上皮细胞癌[10]具有一定价值,SFRP2甲基化诊断急性髓细胞白血病[11]、肝癌[12]、肺癌[1]具有一定价值。SFRP2甲基化之前报道主要 发生在女性、非吸烟的NSCLC患者[13],这表明SFRP2甲基化在基因表达上具有性别效应。但本研究表明SFRP1和SFRP2甲基化更常见于男性NSCLC患者。这种差异可能是由于不同的患病群体暴露于多重环境因素所致,因此NSCLC是一种多种性激素同时参与通路调节的异质性疾病[14]。WIF1是Wnt信号通路中参与肿瘤发生的负调控因子[15],早期研究显示,WIF1甲基化参与了NSCLC的发生发展[16],本研究结果也提示了这一作用。PRKCB在人类乳腺癌中通过上调细胞周期蛋白D1影响细胞增殖和细胞周期来调节肿瘤细胞的发生发展[17],其过表达也发生在慢性淋巴细胞白血病中[18]。本研究表明,PRKCB启动子甲基化在肺癌组织中的表达较相对应的癌旁组织高,这说明PRKCB甲基化水平对诊断NSCLC具有一定作用。
本研究的局限性主要包括缺乏在体液中发现甲基化以及不能预测甲基化状态与基因表达之间是否存在联系。然而,Wnt通路抑制剂基因的甲基化状态可能是预测NSCLC风险的一个有价值的生物标志物。
总的来说,启动子甲基化,对于一组Wnt信号通路基因(SFRP1、SFRP2、WIF1、PRKCB),有可能被用作NSCLC早期诊断的生物标志物。
[1] XIE J, ZHANG Y, HU X, et al. Norcantharidin inhibits Wnt signal pathway via promoter demethylation of WIF-1 in human non-small cell lung cancer[J]. Med Oncol, 2015, 32(5):145.
[2] LEE S H, CHEN T, ZHOU J, et al. Protein kinase C-beta gene variants, pathway activation, and enzastaurin activity in lung cancer[J]. Clin Lung Cancer, 2010, 11(3): 169-175.
[3] ANGLIM P P, ALONZO T A, LAIRD-OFFRINGA I A.DNA methylation-based biomarkers for early detection of non-small cell lung cancer: An update[J]. Mol Cancer, 2008,7: 81.
[4] DI P A, DEL R M, PETRINI I, et al. Recent advances in epigenomics in NSCLC: real-time detection and therapeutic implications[J]. Epigenomics, 2016, 8(8): 1151-1167.
[5] MEHTA A, DOBERSCH S, ROMERO-OLMEDO A J, et al.Epigenetics in lung cancer diagnosis and therapy[J]. Cancer Metastasis Rev, 2015, 34(2): 229-241.
[6] SCHNEIDER J, PHILIPP M, VELCOVSKY H G, et al. Progastrin-releasing peptide (ProGRP), neuron specif i c enolase(NSE), carcinoembryonic antigen (CEA) and cytokeratin 19-fragments (CYFRA 21-1) in patients with lung cancer in comparison to other lung diseases[J]. Anticancer Res, 2003,23(2A): 885-893.
[7] REYA T, CLEVERS H. Wnt signalling in stem cells and cancer[J]. Nature, 2005, 434(7035): 843-850.
[8] YU J, TAO Q, CHENG Y Y, et al. Promoter methylation of the Wnt/beta-catenin signaling antagonist Dkk-3 is associated with poor survival in gastric cancer[J]. Cancer, 2009, 115(7): 49-60.
[9] LIANG J, KANG X, HALIFU Y, et al. Secreted frizzled-related protein promotors are hypermethylated in cutaneous squamous carcinoma compared with normal epidermis[J].BMC Cancer, 2015, 15: 641.
[10] LIU J B, QIANG F L, DONG J, et al. Plasma DNA methylation of Wnt antagonists predicts recurrence of esophageal squamous cell carcinoma[J]. World J Gastroenterol, 2011,17(44): 4917-4921.
[11] GHASEMI A, ROSTAMI S, CHAHARDOULI B, et al.Study of SFRP1 and SFRP2 methylation status in patients with de novo acute myeloblastic leukemia[J]. Int J Hematol Oncol Stem Cell Res, 2015, 9(1): 15-21.
[12] KOHNO H, AMATYA V J, TAKESHIMA Y, et al. Aberrant promoter methylation of WIF-1 and SFRP1, 2, 4 genes in mesothelioma[J]. Oncol Rep, 2010, 24(2): 423-431.
[13] SUZUKI M, SHIGEMATSU H, NAKAJIMA T, et al. Synchronous alterations of Wnt and epidermal growth factor receptor signaling pathways through aberrant methylation and mutation in non small cell lung cancer[J]. Clin Cancer Res,2007, 13(20): 6087-6092.
[14] BERARDI R, MORGESE F, SANTINELLI A, et al. Hormonal receptors in lung adenocarcinoma: expression and difference in outcome by sex[J]. Oncotarget, 2016, 7(50):82648-82657.
[15] LEE S M, PARK J Y, KIM D S. Wif1 hypermethylation as unfavorable prognosis of non-small cell lung cancers with EGFR mutation[J]. Mol Cells, 2013, 36(1): 69-73.
[16] HUANG T, CHEN X, HONG Q, et al. Meta-analyses of gene methylation and smoking behavior in non-small cell lung cancer patients[J]. Sci Rep, 2015, 5: 8897.
[17] LI H, WEINSTEIN I B. Protein kinase C beta enhances growth and expression of cyclin D1 in human breast cancer cells[J]. Cancer Res, 2006, 66(23): 11399-11408.
[18] ABRAMS S T, LAKUM T, LIN K, et al. B-cell receptor signaling in chronic lymphocytic leukemia cells is regulated by overexpressed active protein kinase CbetaII[J]. Blood, 2007,109(3): 1193-1201.

