镉对体外培养小鼠肝细胞的毒性效应
杜 娟, 张莉莉,王 晶,商 旋,常世民
(廊坊师范学院,河北 廊坊 065000)
【研究意义】镉是常见的金属污染物,也是环境中毒性最强的5种(汞、铅、镉、砷、铬)元素之一[1],是动植物体的非必需元素,在冶金、塑料和电子等行业应用广泛。【前人研究进展】近年来,工生产、农业活动和直接或间接排放镉的人为活动,是造成土壤镉污染主要原因[2],如工业废气中的镉沉降[3]、长期施用含镉肥料[4]和农用塑料薄膜[5]、使用工矿企业排放的污水灌溉、污泥施肥[6]以及金属矿山酸性废水污染[2]等。土壤中的镉有多种存在形态,如水溶态、可交换态或碳酸盐态,其中,前两种镉可被植物或农作物吸收,并通过食物链富集与人体内,严重危害人体健康[6-7]。目前,国内对镉的毒性研究主要集中于神经组织[8-9]、肾[10]、皮肤[11]和肺[12]等领域。【本研究切入点】本实验利用小鼠肝细胞的体外培养体系,研究氯化镉对肝细胞的存活及凋亡的影响,进而推测镉的对肝细胞生长和存活的短期影响作用。【拟解决的关键问题】本实验利用组织块法启动了小鼠肝细胞的体外培养,利用其体外培养体系,研究不同浓度氯化镉处理对其存活的影响作用。
1 材料与方法
1.1 材料与试剂
BALB/C小鼠(雌雄数量比为3∶1)购自中国医学科学院实验动物研究所;Hoechst 33342和DNA Ladder抽提试剂盒购自上海碧云天生物技术有限公司;胰蛋白酶和四甲基偶氮唑蓝购自美国Amresco公司;DMEM/F12培养基和胎牛血清购自美国Gibco公司;实验所用其他试剂均为分析纯。
1.2 方法
1.2.1 小鼠肝细胞的原代培养 参考王晶等方法启动原代培养[11 ]。将怀孕15 d的雌鼠颈部脱臼处死后,70 %医用乙酒精浸泡处理1~2min,重复1次,无菌取出胚胎,酒精处理1~2 min,磷酸盐缓冲溶液漂洗2~3次后,用含5 % FBS的DMEM/F12培养液()漂洗1次,无菌取出胚胎肝脏,烧杯中剪碎(约1 mm3)至,离心后去上清,组织块或细胞沉淀用DMEM/F12培养液(含5 % FBS)悬浮后均匀铺在培养瓶底部,翻转倒置,37 ℃培养箱中培养6 h后,补加含20 % FBS 的DMEM/F12培养液至5 mL/瓶,置37 ℃培养箱中正置培养。
1.2.2 小鼠肝细胞的传代培养 参考王晶等方法,采用酶消化法进行传代培养[11 ]。待细胞汇合率达90 %时,吸弃旧培养液,D-Hanks漂洗1次,0.25 %(质量体积比)胰蛋白酶溶液处理30 s~1 min,吹下细胞,用含20 % FBS的DMEM/F12培养液重悬,接种至2个底面积为25 cm2的细胞培养瓶中,37 ℃培养箱中静置培养。
1.2.3 小鼠肝细胞的冻存 选择5~6瓶汇合率达80 %~ 90 %的肝细胞,按上述传代方法制备细胞悬液,转入离心管中,1000 r/min离心10 min后弃上层液体,加入1 mL细胞冻存液,悬浮细胞转入无菌细胞冻存管中。4 ℃冰箱中放置30 min,-20 ℃冰箱中放置1 h,-80 ℃冰箱中过夜后转入液氮罐中长期保存。
1.2.4 细胞接种和氯化镉处理 按传代方法制备细胞悬液,并接种至24孔细胞培养板中,细胞密度约1×105个/mL,待细胞贴瓶后,添加终浓度分别为0、5、10、20、40、80和160 μmol/mL的氯化镉,每个浓度设置3个重复。37 ℃、5 % CO2培养箱中继续培养,显微镜观察并拍照。
1.2.5 细胞存活率测定 采用MTT法[11]。氯化镉处理一定时间后,弃上层培养液,D-Hanks漂洗后,每孔加入180 μl DMEM/F12培养液(含10 %FBS)和20 μl的5 mg/mL MTT溶液,37 ℃、5 % CO2培养箱中继续培养4 h后,弃上层液体, D-Hanks漂洗1次,每孔加入150 μl二甲基亚砜,酶标仪测定490 nm光吸收值,计算氯化镉对肝细胞的抑制率和半致死浓度(IC50)[11],抑制率=(1-实验组平均光吸收值/对照组平均光吸收值)×100 %。
1.2.6 Hoechst 33342染色 将无菌盖玻片放于培养皿中,制备细胞悬液并接种,细胞密度约2×103个/cm2,补加一定量含10 % FBS DMEM/F12培养液, 24 h后,添加氯化镉处理一定时间,弃上层培养液,D-Hanks漂洗2~3次,多聚甲醛低温固定,D-Hanks漂洗,Hoechst33342染液标记30 min,D-Hanks漂洗后,荧光显微镜观察、拍照。
1.2.7 DNA琼脂糖凝胶电泳 按上述方法制备细胞悬液并接种,静置培养24 h后,氯化镉分别处理24~96 h。参考DNA Ladder抽提试剂盒说明[11],收集细胞,离心,弃上层液体,PBS重悬,加入RNaseA处理3~5 min,蛋白酶K 70 ℃孵育10 min后,添加样品裂解液B,混匀并转入DNA纯化柱内,6500 r/min离心,收集管内液体,加洗涤液I,6500 r/min离心;收集管内液体,加洗涤液II,18 000 r/min离心后,收集管内液体,重复离心1次。将洗脱液加入DNA纯化柱中,,室温放置3 min,12 000 r/min离心,得纯化总DNA。取适量DNA进行琼脂糖凝胶电泳,EB染色,凝胶成像系统观察、拍照。
1.2.8 数据处理 实验结果用SPSS 20.0软件进行统计分析,组间差异性比较采用单因素ANOVA,P<0.05,表示差异显著,P<0.01,表示差异极显著。
2 结果与分析
2.1 小鼠肝细胞的体外培养
原代启动后第3天,有较多细胞从肝组织块边缘迁出,细胞贴附于培养瓶底部,呈扁平不规则多角形(图1A),生长分裂旺盛。原代培养启动后第8~10天,组织块周围的细胞汇合成单层(图1B),说明培养条件适合肝细胞的迁出和增殖。
采用胰蛋白酶消化法传代后第2天,绝大多数细胞能贴瓶生长,且多为不规则形,透光性较好,一周左右可再次长满单层(图1C),说明胰酶消化法比较适合小鼠肝细胞的传代培养。
2.2 氯化镉对小鼠肝细胞形态的影响
光学显微镜观察小鼠肝细胞的结果显示, 5~20 μmol/L 氯化镉处理24 h对小鼠肝细胞的形态无显著性影响(图2B~D),40~160 μmol/L氯化镉处理24 h,可不同程度引起细胞变圆或脱离培养瓶底部(图2E~G),且随着处理浓度的增加,变圆脱落的细胞数量逐渐增加(图2 E ~G)。5~160 μmol/L 氯化镉处理48 h,则均可不同程度引起小鼠皮肤细胞变圆脱落,具有浓度依赖性(图3B~G)。
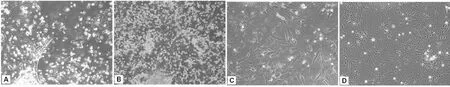
A. 原代培养启动第3天; B. 原代培养肝细胞长成单层; C. 传代后小鼠肝细胞; D. 长满单层的第2代小鼠肝细胞A. 3 days after primary culture; B. Primary cultured murine hepatocytes monolayer; C.Subcultured murine hepatocytes; D. Cultured murine hepatocytes monolayer at passage 2 图1 体外培养的小鼠肝细胞(200×)Fig.1 Cultured murine hepatocytes in vitro

A~G:氯化镉添加浓度分别为0、5、10、20、40、80、160 μmol/L。下同 A-G: treated group by CdCl2: 0,5,10,20,40,80,160 μmol/L. The same as below图2 氯化镉处理24 h的小鼠肝细胞(200×)Fig.2 Murine hepatocytes treated with CdCl2 for 24 hours

图3 氯化镉处理48h的小鼠肝细胞(200×) Fig.3 Murine hepatocytes treated with CdCl2 for 48 hours
2.3 氯化镉对小鼠肝细胞存活率的影响
与空白对照组(细胞存活率为100 %)相比,5~160 μmol/L氯化镉处理小鼠肝细胞24和48 h均可极显著降低细胞存活率(P<0.01),且随着添加浓度的增加,细胞存活率逐渐降低,具有浓度依赖性(图3);相同添加浓度时,5~160 μmol/L氯化镉处理48 h组的细胞存活率显著低于24 h组。经寇氏法计算[11],氯化镉处理24和48 h的的半致死率浓度分别为30.3和21.0 μmol/L。

图4 氯化镉处理24和48 h的小鼠肝细胞存活率Fig.4 Survival rate of murine hepatocytes treated with CdCl2 for 24 and 48 hours
凋亡细胞具有染色质凝集等形态学或生理生化特征[13],如等。Hoechst33342 是一种可穿透细胞膜的特异性DNA荧光探针,入细胞核后在聚AT序列的富集区域的小沟处与DNA结合。经紫外光激发,Hoechst-DNA呈亮蓝色荧光,与对照组非凋亡细胞(图5A)相比,氯化镉处理组的细胞染色质固缩,趋边化(图5B),呈现凋亡细胞的染色质特征。
细胞凋亡晚期,核酸内切酶被活化,将核小体间的染色质DNA特异性切割成180~200 bp或其整数倍片段,经常规琼脂糖凝胶电泳后,呈现出梯状条带(DNA ladder)[11,13]。DNA电泳时鉴定细胞凋亡最为简便可靠的方法之一。电泳结果显示,氯化镉处理小鼠肝细胞48 h后,DNA出现梯状条带;处理72和96 h后,DNA出现明显的梯状条带,其中,200、400、600和800 bp左右的DNA条带清晰可见(图6),说明氯化镉处理导致了小鼠肝细胞的凋亡[11]。

A. DNA marker; B. 空白对照组; C~E. 40 μmol/L CdCl2处理24, 48,和72 hA. DNA marker; B. Control; C-F. Treated group by 40 μmol/L CdCl2 for 24, 48 and 72 hours图6 DNA 琼脂糖电泳Fig.6 DNA agarose gel electrophoresis
3 讨 论
本实验建立的培养体系适合于小鼠肝细胞的体外存活和生长,所培养的细胞贴壁生长,呈不规则多角形,细胞透光性较好,细胞增殖速度较快;一定浓度氯化镉短期处理即可导致细胞出现皱缩变圆,染色质凝缩和DNA片段化等特征,引起细胞凋亡。这与Jicang Wang等的研究结果一致[14]。研究表明,镉诱导的细胞凋亡通路主要有:①未折叠蛋白质应答反应(UPR)途径[15-16];②线粒体介导的,caspase 依赖性[17]和非caspase依赖性途径[18];③活性氧和Ca+[14]途径;④细胞自噬途径等[19-20]。而氯化镉通过上面哪种或者哪几种信号转导通路诱导体外培养的小鼠肝细胞的凋亡还有待进一步研究。
综上,由于镉(Cd)是一种生物体非必须的元素,通过肺脏呼吸和消化道吸收最终积累于人体肝脏和肝脏中长达15~20年,并对组织或细胞产生持续的毒性作用[21]。因此,积极开展切实有效的管控措施,严格限制土壤中重金属镉的输入,保护未被污染的土地资源,修复已经被镉等重金属污染的土地,提高农产品质量安全,才能保护人体健康[2]。

A. 对照组; B. 40 μmol/L的氯化镉处理48 h; “↙”示正常细胞核;“*”示致密浓染的凋亡细胞细胞核A. Control; B. Treated group by 40μmol/L CdCl2 for 48 hours;↙’ control; ‘*’ apoptotic cell nucleus 图5 Hoechst33342染色后小鼠肝细胞细胞核(400×)Fig.5 Murine hepatocytes’ nucleus stained by Hoechst33342
4 结 论
本文利用组织块法启动了小鼠肝细胞的体外培养,利用其体外培养体系,研究不同浓度氯化镉处理对其存活的影响作用。所建立的培养体系适合于小鼠肝细胞的体外存活和生长,同时证明了一定浓度氯化镉短期处理即可导致细胞出现皱缩变圆,染色质凝缩和DNA片段化等特征,引起细胞凋亡。
参考文献:
[1]庞荣丽,王瑞萍,谢汉忠,等. 农业土壤中镉污染现状及污染途径分析简[J]. 天津农业科学, 2016 (12):87-91.
[2]李 婧,周艳文,陈 森,等. 我国土壤镉污染现状, 危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24):104-107.
[3]曾咏梅,毛昆明,李永梅. 土壤中镉污染的危害及其防治对策[J]. 云南农业大学学报, 2005, 20(3):360-365.
[4]罗 琼,王 昆,许靖波,等. 我国稻田镉污染现状危害来源及其生产措施[J]. 安徽农业科学, 2014, 42(30):10540-10542.
[5]于立红,王 鹏,于立河,等. 地膜中重金属对土壤-大豆系统污染的试验研究[J]. 水土保持通报, 2013, 33(3):86-90.
[6]Godt J, Scheidig F, Grosse-Siestrup C, et al. The toxicity of cadmium and resulting hazards for human health [J]. Journal of Occupational Medicine and Toxicology, 2006, 1(1):22.
[7]赵中秋,朱永官,蔡运龙. 镉在土壤-植物系统中的迁移转化及其影响因素[J]. 生态环境, 2005, 14(2):282-286.
[8]朱俊德,余资江,戈 果,等. 慢性镉中毒对小鼠学习记忆及海马 CA3 区的影响[J]. 环境与健康杂志, 2009 (7):576-579.
[9]Wang B, Du Y. Cadmium and its neurotoxic effects[J]. Oxidative Medicine and Cellular Longevity, 2013, 2013.
[10]李颖超,武 昕,严家荣,等. 亚慢性镉中毒肾功能性损伤小鼠模型的研究[J]. 山西医科大学学报, 2013, 44(4):267-270.
[11]王 晶,商 旋,张晓敬,等. 镉对体外培养小鼠皮肤细胞存活的影响[J]. 西南农业学报, 2016, 29(9):2244-2248.
[12]常云峰. 镉致肺纤维化作用机制的初步研究[D]. 长沙:中南大学, 2013.
[13]翟中和,王喜忠,丁明孝. 细胞生物学[M]. 第四版. 北京:高等教育出版社: 342-343.
[14]Wang J, Zhu H, Liu X, et al. Oxidative stress and Ca2+signals involved on cadmium-induced apoptosis in rat hepatocyte[J]. Biological Trace Element Research, 2014, 161(2):180-189.
[15]Yokouchi M, Hiramatsu N, Hayakawa K, et al. Atypical, bidirectional regulation of cadmium-induced apoptosis via distinct signaling of unfolded protein response[J]. Cell Death & Differentiation, 2007, 14(8):1467-1474.
[16]Yokouchi M, Hiramatsu N, Hayakawa K, et al. Involvement of selective reactive oxygen species upstream of proapoptotic branches of unfolded protein response[J]. Journal of Biological Chemistry, 2008, 283(7):4252-4260.
[17]Liu Y, Templeton D M. Initiation of caspase-independent death in mouse mesangial cells by Cd2+: Involvement of p38 kinase and CaMK‐II [J]. Journal of Cellular Physiology, 2008, 217(2):307-318.
[18]Lee W K, Abouhamed M, Thevenod F. Caspase-dependent and-independent pathways for cadmium-induced apoptosis in cultured kidney proximal tubule cells[J]. Am J Physiol Renal Physiol, 2006, 291(4):F823-832.
[19]李 楠. 镉经内质网应激途径诱导鸡肝细胞自噬的机制[D]. 东北农业大学, 2014.
[20]皮会丰. DNM1L蛋白介导的线粒体自噬在镉致肝脏毒性中的作用研究[D]. 第三军医大学, 2015.
[21]蒋廷亚,周 阳,林 毅,等. 镉代谢分子机制研究进展[J]. 安徽农业大学学报, 2013, 40(4):678-684.

