解淀粉芽孢杆菌菌株XZ-1对甘薯黑斑病的生物防治效果研究
杨冬静,孙厚俊,张成玲,徐 振,赵永强,谢逸萍
(江苏徐淮地区徐州农业科学研究所,中国农业科学院农业部甘薯生物学与遗传育种重点实验室,江苏 徐州 221131)
【研究意义】随着人们生活水平的提高和膳食结构的不断改善,甘薯已不仅仅是重要的粮食和工业原料作物[1],日本、欧洲以及美国等发达国家和地区更把甘薯视为营养平衡全面的保健食品[2],甘薯富含花青素、胡萝卜素、可溶性膳食纤维、糖蛋白以及多种矿物质成分,具有增强免疫功能、防癌抗癌以及抗衰老等多种功效,被许多专家认为是21世纪最理想的食物之一[3]。我国是世界上最大的甘薯生产国家,甘薯常年种植面积约560万hm2,约占世界甘薯种植面积的53.5 %。甘薯黑斑病(black rot)又名黑疤病,在世界各甘薯产区均有发生,也是我国北方薯区三大病害之一,每年我国由该病导致甘薯产量损失为5 %~10 %,发病严重时可达20 %~50 %。甘薯黑斑病病原物为甘薯长喙壳菌(CeratocystisfimbriataEllis et Halsted),属于子囊菌亚门长喙壳属真菌,可为害甘薯幼苗茎基部,主要表现为茎基部长出黑褐色椭圆形或菱形病斑,稍凹陷,高湿条件下可产生黑色刺毛状及粉状物,造成薯苗受害;该病原菌也可侵染甘薯块根组织[4],导致甘薯黑疱霉酮等呋喃萜类有毒物质的产生,目前我国已有较多关于人畜食用黑斑病侵染后薯块产生中毒症状的报道[5]。黑斑病的防控已成为我国甘薯产业面临的重要问题之一。【前人研究进展】目前国内外对于甘薯黑斑病研究主要包括黑斑病抗性鉴定方法[6-7]、抗病品种筛选[8-9]以及室内化学药剂的筛选[10-12]等方面。国外Hong等(2016)[13]首次报道了一种内生细菌红球菌KB6可提高甘薯品种对黑斑病的抗性,而我国目前还未见针对甘薯黑斑病的生防菌株筛选和应用的报道。解淀粉芽孢杆菌是目前研究报道较多的一种生防菌,具有繁殖迅速,对人畜无毒无害,与环境友好,且可产生芽孢并由此具有较强的耐逆性,并由此得到广泛的生产和应用,如德国ABiTEP GmbH 公司已将解淀粉芽孢杆菌BacillusamyloliquefaciensFZB42登记并产业化[14]。【本研究切入点】本课题组前期通过分离筛选鉴定获得一株具有广谱抗真菌活性的解淀粉芽孢杆菌菌株XZ-1,本文拟进一步测定该菌株对甘薯黑斑病菌的拮抗活性以及对薯块黑斑病的防治效果。【拟解决的关键问题】为甘薯黑斑病的防控提供新方法新思路,为甘薯绿色生产奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 生防细菌 解淀粉芽孢杆菌菌株XZ-1由江苏徐淮地区徐州农业科学研究所甘薯病虫害防控课题组分离筛选自江苏省徐州市铜山区班井村甘薯种植地,经过纯化后采用甘油保存于-20 ℃冰箱。
1.1.2 病原真菌 供试病原菌甘薯黑斑病菌经分离鉴定后保存于4 ℃冰箱。
1.1.3 培养基 甘薯黑斑病菌的培养采用PDA培养基(土豆20 g/L,葡萄糖20 g/L,琼脂粉15 g/L,水1000 mL);解淀粉芽孢杆菌的培养采用LBA培养基(胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠10.0 g/L),LB培养基为LBA培养基中不加琼脂。配置好的培养基于121 ℃高压灭菌锅(Zealway GR85DA,America) 20 min后备用。
1.2 XZ-1发酵液对甘薯黑斑病菌的拮抗活性测定
将XZ-1在LBA平板中划线活化后,挑取单菌落于27 ℃、150 r/min振荡培养36 h后备用。采用平板对峙法,在PDA平板中央接种蘸取上述菌液的无菌滤纸片,在滤纸片左右分别接种黑斑病病菌菌碟,以蘸取LB液体培养基的滤纸片在PDA平板中心作为对照,每个处理都设置3个重复,将处理好的平板置于28 ℃恒温培养箱中培养,大约4 d左右对照中两病原菌菌丝交接时,记录抑菌带直径并拍照。
1.3 XZ-1对黑斑病菌菌丝形态和产孢的影响
取载玻片加1滴灭菌水,用灭菌的接种针从1.2的平板菌落边缘挑取少量菌丝,置于载玻片上,加盖玻片后,置于倒置显微镜(Leica DMILLED,Germany)下观察菌丝形态以及产孢情况,并于40×物镜下拍照记录,以1.2中未XZ-1发酵液的平板中挑取的菌丝形态为对照。
1.4 XZ-1发酵滤液对黑斑病菌孢子萌发的影响
取制备好的发酵滤液,用22 μm孔径的无菌滤器过滤,采用灭菌培养皿收集XZ-1发酵滤液,将培养好的黑斑病菌平板中的孢子洗脱镜检后,取500 μl孢子悬浮液加入发酵滤液后置于28 ℃恒温培养箱中培养6 h左右取出,采用倒置显微镜(Leica DMILLED,Germany)观察孢子萌发状况,并于40×物镜下拍照记录,以清水处理的孢子作为对照。
1.5 XZ-1对薯块黑斑病的防治
1.5.1 薯块的获得 采收后的薯块经高温愈合后,选取大小均匀无病无虫的徐薯32薯块,每处理3个薯块,将取好的薯块洗净晾干,再用75 %酒精均匀喷雾消毒后自然晾干,备用。
1.5.2 黑斑病菌孢子悬浮液的制备 将培养好的黑斑病菌平板取出,用无菌水洗脱孢子,用血球计数板计算孢子浓度并稀释到约为5.0×105CFU/mL,将制备好的孢子悬浮液置于培养皿中备用。
1.5.3 防治效果方案设置 共设置5个处理,分别为A:清水对照;B:XZ-1发酵原液;C:XZ-1发酵液10× 稀释液;D:XZ-1发酵液100× 稀释液;E:对照药剂多菌灵1600倍稀释液,每个处理分别喷3个薯块,待喷药后的薯块晾干以后接种黑斑病菌孢子液。
1.5.4 薯块黑斑病的接种及发病 用灭菌好的针头长度为0.5 cm的接种针蘸配好的黑斑病菌孢子悬浮液,垂直扎测试的薯块,每个薯块接种3排,每排5个点,每扎1次蘸1次菌液,将接种好的薯块装入消毒的周转箱中,加盖消毒纱布保湿,置于约为26 ℃的恒温室中,每天往保湿纱布上喷水保湿。培养10 d后,切开薯块测量病斑直径和深度,计算病斑体积,并计算防治效果,防效计算公式如下:防治效果( %) = (对照病斑体积-处理病斑体积)/对照病斑体积× 100 %。
1.6 数据分析
采用DPS.05软件对试验数据进行方差分析,应用Duncan氏新复极差法进行统计分析。
2 结果与分析
2.1 XZ-1发酵液对甘薯黑斑病菌的拮抗活性测定
28 ℃生化培养箱中培养4 d后对照中的两黑斑病菌菌碟交接,取出平板观察发现XZ-1发酵液对甘薯黑斑病菌有明显的拮抗活性(图1)。经测量,抑菌带平均直径为25.3 mm。
2.2 XZ-1发酵液对黑斑病菌菌丝形态及产孢的影响
如图2所示,未见XZ-1发酵液对黑斑病菌菌丝有明显的致膨大或致畸等作用;但从图3的菌丝产孢情况来看,从菌落边缘挑出的菌丝产生的孢子发生了明显改变,图3-A中未经处理的菌丝产生的孢子主要为分生孢子,而图3-B中经XZ-1处理后的菌丝产生的孢子主要为厚垣孢子。
2.3 XZ-1发酵液对黑斑病菌产孢及孢子萌发的影响
发酵液处理6 h后取出平板,显微观察孢子萌发状况,如图4所示,清水处理的孢子已正常萌发并产生芽管,而XZ-1处理的孢子并未萌发,说明XZ-1可明显抑制黑斑病菌孢子的萌发。

图1 XZ-1 对甘薯黑斑病菌的拮抗活性测定Fig.1 Analysis of antibiotic activity of XZ-1 against Ceratocystis fimbriata

A为对照未处理的菌丝;B为XZ-1发酵液处理后的菌丝A: Hyphae treated by water; B: Hyphae treated by XZ-1 fermentation图2 XZ-1发酵液对甘薯黑斑病菌菌丝形态的影响Fig.2 Effects of fermentation liquid of XZ-1 on hyphae morphology of Ceratocystis fimbriata
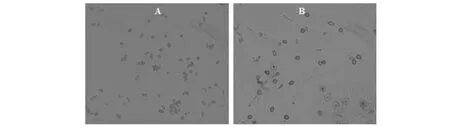
A为对照未处理的黑斑病菌的产孢情况; B为XZ-1发酵液处理后的黑斑病菌的产孢情况A: Sporulation type which treated by water; B: Sporulation type which treated by XZ-1 fermentation图3 XZ-1发酵液对甘薯黑斑病菌产孢的影响Fig.3 Effects of fermentation liquid of XZ-1 on sporulation of Ceratocystis fimbriata

A为灭菌水处理的黑斑病菌孢子萌发情况; B图XZ-1发酵液处理后黑斑病菌孢子萌发情况4: Spores germinate normally in water; B: Spores nearly ungerminated in XZ-2 fermentation图4 XZ-1发酵液对甘薯黑斑病菌孢子萌发的影响Fig.4 Effects of fermentation liquid of XZ-1 on spores germination of Ceratocystis fimbriata
2.4 XZ-1发酵液对薯块黑斑病的防治
10 d后取出薯块,拍照记录薯块的发病情况(图5),B、C、D中XZ-1 3种不同浓度的发酵液处理的薯块表面的病斑直径明显小于对照中薯块的病斑直径,而对照药剂多菌灵处理的薯块表面病斑直径比XZ-1各浓度处理的要大,比对照要小。
如表1所示,清水对照处理的薯块黑斑病发病体积高达35.08 mm3,而XZ-1原液处理的薯块黑斑病发病体积仅为12.64 mm3,XZ-1 10×稀释液处理的薯块黑斑病发病体积为13.84 mm3,XZ-1 10×稀释液处理的薯块黑斑病发病体积为15.75 mm3,3种不同浓度的XZ-1发酵液处理的薯块黑斑病发病体积均与对照病斑体积呈极显著水平差异;而多菌灵处理的薯块发病体积为26.00 mm3,与对照没有显著性差异,与3种浓度的XZ-1发酵液处理后病斑体积呈显著差异。从防治效果来看,XZ-1 3种从高到低浓度的发酵液对黑斑病的防治效果也是从高到低,分别为65.02 %,58.19 %和54.14 %,而多菌灵1600倍液处理对黑斑病防治效果仅为23.99 %,XZ-1 3种不同浓度的发酵液对黑斑病的防效与多菌灵对黑斑病的防效呈极显著水平差异。

图5 XZ-1发酵液对薯块黑斑病的生物防治效果Fig.5 Biological control efficacy of XZ-1 fermentation against black rot of sweet potato on the storage roots

处理 Treatments 平均病斑体积(mm3) Anverage disease volume平均防效( %) Anverage control efficacy清水对照 Control (water)35.08±3.38 AaXZ-1原液 XZ-1 initial fermentation12.64±3.27 Bb65.02±5.86AaXZ-1 10×稀释液 10 × diluent of XZ-1 initial fermentation13.84±3.39 Bb58.19±12.65 AaXZ-1 100×稀释液 100 × diluent of XZ-1 initial fermentation15.75±1.84 Bb54.14±6.66 Aa多菌灵 1600倍液 1600 × diluent of carbendazim26.00±0.86 ABa23.99±9.6 0Ab
注:不同大写字母表示经Duncan氏新复极差法检验在P<0.05水平差异显著;不同小写字母表示经Duncan氏新复极差法检验在P<0.01水平差异显著。
Note: Data in the table were mean ± SD. Different capital letters indicate significant difference atP<0.05 level by Duncan’s new multiple range test; Different lower case letters indicate significant difference atP<0.01 level by Duncan’s new multiple range test.
3 讨 论
采用平板对峙等方法研究解淀粉芽孢杆菌菌株XZ-1甘薯黑斑病菌的生物防治效果,表明该菌株对黑斑病菌具有较强的拮抗活性,通过菌丝形态显微观察尚未发现该菌株对黑斑病菌菌丝有明显抑制作用,这与其他一些生防菌株可导致病原菌菌丝肿胀、畸形、原生质浓缩等报道有所差异[16-17],这可能是由于各生防菌株产生的抗菌物质类型不同,其作用方式和作用机理也相应的有所差异。该菌株对黑斑病菌产孢类型有较大的影响,黑斑病菌可产生3种孢子:分生孢子、厚垣孢子和子囊孢子[18],分生孢子在正常条件可随时萌发出牙管,牙管顶端再长出次生内孢子然后生成菌丝,而厚垣孢子具有厚壁,需要经过一段时间休眠后才可萌发,本文中经XZ-1处理的菌丝产生了大量厚垣孢子,推测这是黑斑病菌对XZ-1的一种抵御机制。薯块的防治效果试验结果表明不同浓度的XZ-1发酵液对均可显著降低薯块黑斑病的发病体积,其中发酵原液处理后薯块的病斑体积最小,仅为12.64 mm3;XZ-1 10 × 稀释液和XZ-1 100 × 稀释液处理的薯块黑斑病发病体积13.84和15.75 mm3;而多菌灵处理的薯块黑斑病发病体积为26.00 mm3,统计分析表明3种不同浓度XZ-1发酵液处理的薯块黑斑病发病体积均与对照病斑体积呈极显著差异;而多菌灵处理的薯块与对照薯块发病体积没有显著性差异。从防效来看,XZ-1原液对薯块黑斑病的防治效果最佳,为65.02 %;XZ-1 10 × 稀释液和XZ-1 100 × 稀释液的防治效果仅次于原液,分别为58.19 %和54.14 %,但3种浓度的XZ-1发酵液对薯块黑斑病的防治效果没有显著性差异,而多菌灵1600倍液处理对黑斑病防治效果仅为23.99 %,XZ-1 3种不同浓度的发酵液对黑斑病的防效与多菌灵对黑斑病的防效呈极显著水平差异,说明XZ-1对储藏期甘薯黑斑病具有较好的防治效果,是一株具有较好应用前景的生防菌株。
已有的报道表明,生防菌的防治机理有产生抗菌活性物质[19]、营养位点的竞争、对作物根际微生态的改善[20]、防御相关酶活性增强[21]以及诱导植物抗病性产生[22]等。XZ-1是本课题组从甘薯根际土壤中分离筛选鉴定所得,因此该菌株是否可以定殖在甘薯植株体内,该菌株是否可以改善甘薯根际微生态,缓解植物自身的化感作用,该菌株是否可以诱导甘薯产生抗病性等这些都值得我们进一步深入的研究,也是下一步课题组将要开展的研究工作,这将为甘薯黑斑病生防菌剂的开发提供理论依据,为甘薯绿色防控作出重要贡献。
4 结 论
甘薯作为保证我国粮食安全的底线作物、抗灾救灾的先锋作物、生物质能源原材料和保健的最佳食品[15],越来越受到人们的关注。但近年来由于全球气候异常,我国江淮薯区甘薯生长季节高温高湿天气增多,导致甘薯黑斑病的迅速发生,对甘薯的产量和质量造成了严重影响。化学防治可在一定程度上减轻该病害的发生,但是由于化学药剂的施用容易导致农作物抗药性的产生,且对环境产生污染,对农作物造成农药残留严重危害人们的健康,因此,急需对甘薯黑斑病安全有效的防控方法。将解淀粉芽孢杆菌应用于甘薯黑斑病生物防控,目前在我国尚未见相关报道,本文首次将生防菌应用到甘薯黑斑病防治研究中,并通过试验证明该解淀粉芽孢杆菌对储藏期甘薯黑斑病具有很好的生防效果,是一株具有较好应用前景的生防菌株。
参考文献:
[1]陆漱韵,刘庆昌,李惟基. 甘薯育种学[M]. 北京:中国农业出版社, 1998.
[2]康明丽. 甘薯与甘薯食品的开发[J]. 山西食品工业, 2001(3):19-20.
[3]张立明,王庆美,王荫墀. 甘薯的主要营养成分和保健作用[J]. 杂粮作物, 2003, 23(3):162-166.
[4]Halsted B D. Some fungous diseases of the sweet potato-the black rot[J]. New Jersey Agriculture Experiment Station Bulletin, 1890, 76:7-14.
[5]孙厚俊,刘美艳,宗玮玮,等. 黑斑病对甘薯体内几种保护酶活性的影响[J].广西农学报, 2011, 26(3);14-17.
[6]周佳明,朱实祥. 甘薯黑斑病抗性鉴定方法研究[J]. 西南农业学报, 2004, 17(6):797-799.
[7]孙厚俊,赵永强,谢逸萍,等. 一种甘薯黑斑病苗期抗性鉴定方法[J]. 徐州工程学院学报(自然科学版), 2013, 28(3):77-79.
[8]谢一芝,尹晴红,戴起伟,等. 甘薯品种抗黑斑病鉴定及其遗传趋势[J]. 植物遗传资源学报, 2003, 4(4);311-313.
[9]贾赵东,谢一芝,尹晴红,等. 甘薯抗黑斑病种质资源的研究及育种利用[J]. 植物遗传资源学报, 2010, 11(4):424-427.
[10]张德胜,乔 奇,田雨婷,等. 5种杀菌剂对储藏期甘薯黑斑病的防效及对薯块的安全性评价[J]. 植物保护, 2015, 41(6):221-224.
[11]张德胜,张永超,乔 奇,等. 10种杀菌剂对甘薯黑斑病的毒力及联合毒力[J]. 农药, 2012, 51(6):452-454.
[12]杨冬静,孙厚俊,赵永强,等.多种药剂对甘薯黑斑病菌的毒力测定及其对苗期黑斑病的防治效果研究[J]. 江西农业学报, 2014, 26(11):72-74.
[13]Hong Chi Eun, Jeong Haeyoung, Jo Sung Hee, et al. A Leaf-Inhabiting Endophytic Bacterium,Rhodococcussp. KB6, Enhances Sweet Potato Resistance to Black Rot Disease Caused byCeratocystisfimbriata[J]. Journal of Microbiology and Biotechnology, 2016, 26(3):488-492.
[14]Chen X H, Koumoutsi A, Scholz R, et al., Comparative analysis of the complete genome sequence of the plant growth-promoting bacteriumBacillusamyloliquefaciensFZB42[J]. Nature Biotechnology, 2007, 25(9):1007-1014.
[15]梁婧婧. 甘薯水溶性糖蛋白的提取纯化及降血脂机理的研究[D]. 沈阳:沈阳农业大学, 2009.
[16]Dongjing Yang, Bo Wang, Jianxin Wang, et al., Activity and efficacy ofBacillussubtilisstrain NJ-18 against rice sheath blight and Sclerotinia stem rot of rape[J]. Biological Control, 2009, 51:61-65.
[17]程 超,赵延存,李红旭,等. 产酶溶杆菌OH11代谢产物HSAF对梨树腐烂病的防治效果[J]. 中国生物防治学报, 2017, 33(1):114-120.
[18]郭予元,吴孔明,陈万权,等. 中国农作物病虫害(第二版)[M]. 北京:中国农业出版社, 2011.
[19]邱思鑫,阮宏春,宋美仙,等. 内生解淀粉芽孢杆菌TB2菌株活性物质诱导辣椒果抗疫病的生化机理[J]. 热带作物学报, 2010, 31(10):1813-1820.
[20]乔俊卿,刘邮洲,夏彦飞,等. 生防菌B1619在番茄根部的定植及对根际微生态的影响[J]. 植物保护学报, 2013, 40(6):507-511.
[21]王璐瑶,蒋盼盼,甘 颖. 解淀粉芽胞杆菌B1619诱导番茄防御酶活性提高和抗病相关基因的表达上调[J]. 中国生物防治学报, 2017, 33(2):234-240.
[22]Yim W J, Kim K Y, Lee Y W, et al., Real time expression of ACC oxidase and PR-protein genes mediated byMethylobacteriumspp. in tomato plants challenged withXanthomonascampestrispv.Vesicatoria[J]. Journal of Plant Physiology, 2014, 171:1064-1075.

