不同浓度β-巯基乙醇对6周龄杜泊羊卵母细胞发育能力的影响
毛杨毅,罗惠娣,王志武,赵 鹏,张冠武,李 俊,郭宏宇,张 丽,薛丽娜,党文庆
(山西省农业科学院畜牧兽医研究所,太原 030032)
幼龄羊胚胎体外生产技术始于20世纪70年代初。 Worthington 等[1]对 5~6 周龄的羔羊注射 HCG,发现羔羊卵巢上大量卵泡开始发育;Trounson等[2]对10~16周龄青年羔羊的卵母细胞进行了研究,将卵母细胞在体外发育到囊胚。21世纪,科学家们对羔羊卵泡发育和体外受精技术进行了更深入的研究,现已利用幼畜超排技术获得幼龄羊的大量卵母细胞,经体外成熟、受精、胚胎发育等一系列孵育、培养过程后生产出“试管羊”[3-12]。但是,在幼龄羊胚胎体外生产技术体系中,一直存在卵母细胞继续发育能力差及卵母细胞质成熟不充分的问题[13-14]。为此,研究者模仿体内卵母细胞成熟环境条件,在成熟液中添加胎牛血清(FBS)、谷胱甘肽(GSH)、促卵泡素(FSH)、17β-雌二醇(17β-E2)、促黄体素(LH)、生长因子(IGF-1、FGF、EGF)及能量物质等,试图通过改进卵母细胞成熟液,达到提高幼龄羊卵母细胞的发育能力。韩岩等[15]进行了谷胱甘肽对卵母细胞成熟及胚胎发育影响的研究;曹忻等[16]进行了血管内皮生长因子对体外成熟绵羊卵母细胞超微结构变化影响的研究。但迄今为止,未见有关不同浓度β-巯基乙醇成熟液对幼龄羊的卵母细胞发育能力影响的研究报道。因此,本试验进行了不同浓度β-巯基乙醇成熟液对6周龄杜泊羊的卵母细胞发育能力影响的研究,为优化幼龄羊胚胎体外生产技术体系提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试验时间和地点 试验于2014年10月7—25日在山西省农业科学院畜牧兽医研究所动物遗传工程实验室进行。
1.1.2 试验羊 6只6周龄杜泊羊由晋中林山养殖合作社提供。
1.1.3 冷冻精液和发情羊血清(ESS) 杜泊羊冷冻精液和ESS自制。
1.1.4 主要激素、试剂及耗材 促黄体素(LH)、17β-雌二醇(17β-E2)、促卵泡素(FSH)及孕马血清(PMSG),均购自北京绿欣农牧科技有限公司;肝素钠、牛血清白蛋白(BSA)、必需氨基酸(EAA)、非必需氨基酸(NEAA)等为索来宝(Solarbio) 品牌,M199、Hepes、β-巯基乙醇、NaCl、CaCl2·2H2O、NaHCO3等为 SIGMA 品牌,圆底玻璃试管、离心管、培养皿等为Corning品牌,四孔培养板为Nunc品牌,均购自山西赛奥生物科技有限公司。
1.1.5 主要仪器 超净工作台(SW-CJ-2FD)、离心机(Sigma 3-16PK)、体视显微系统(OLYMPUS SZX10)、研究级倒置显微系统(OLYMPUS IX71)、二氧化碳培养箱(SANYO MCO-5AC)等均由山西省农业科学院畜牧兽医研究所动物遗传工程实验室提供。
1.1.6 主要手术器械及用品 手术刀、手术剪、止血钳、注射器、75%酒精、碘酒等均购自山西省医疗器材公司。
1.1.7 培养液 采卵液:M199(含20 mmol/L Hepes,2%ESS,10 mg/mL 肝素钠);对照组成熟液:M199(含 20%ESS,10 μg/mL FSH,10 μg/mL LH,1 μg/mL 17β-E2);试验Ⅰ、Ⅱ、Ⅲ组成熟液:在对照成熟液的基础上,分别含50、70、100 μmol/L 的 β-巯基乙醇;获能液:合成输卵管液(SOF)(含 20 μg/mL肝素钠);受精液:SOF液(含 2%ESS);受精卵发育液:SOF液(含 8 mg/mL BSA,2%EAA,1%NEAA)。
1.2 方法
1.2.1 6周龄杜泊羊的激素诱导和卵母细胞采集 采用Kelly等[3]的羔羊激素诱导方法,不同之处是PMSG注射量为每只羊300~350 IU;采用白佳桦[7]的活体采集卵母细胞方法。
1.2.2 ESS制备 从发情1 d羊的颈静脉采集血液,4℃冰箱静置20 h左右,吸取血清,56℃水浴灭活30 min,用0.22 μm滤器过滤后分装,-20℃冷冻保存。
1.2.3 冻精制作 将活力0.8以上杜泊羊精液用常规干冰冷冻法制作颗粒冻精。
1.2.4 精子获能 采用白佳桦[7]的精子体外获能方法。
1.2.5 卵母细胞成熟 采用白佳桦[7]的卵母细胞体外成熟培养的方法。不同之处是将采集的6只幼龄杜泊羊的A、B级COCs随机分为4份,分别放入已在5%二氧化碳(38.5℃、饱和湿度)培养箱平衡2 h的四孔培养板孔中的对照组、试验Ⅰ组、试验Ⅱ组和试验Ⅲ组的成熟液里,矿物油覆盖,继续在5%二氧化碳培养箱里成熟培养24 h。
1.2.6 卵母细胞受精及受精卵培养 采用白佳桦[7]的卵母细胞体外受精和受精卵培养的方法。卵母细胞和精子共同孵育24 h左右,在显微镜下观察卵裂情况;再将受精卵移至受精卵发育液培养12 h左右统计卵裂率;继续培养4~5 d,观察受精卵发育情况并统计桑葚胚率或囊胚率。
1.3 数据处理方法
采用Excel进行数据处理,χ2检验方法进行显著性分析。
2 结果与分析
2.1 幼龄杜泊羊激素诱导效果
由表1可知,6只6周龄杜泊羊共采集卵丘-卵母细胞复合体(COCs)489.0 枚,平均 81.5枚/只,其中 A、B级COCs 460.0枚,平均76.7枚/只。
由图1可以看出,促性腺激素诱导后幼龄杜泊羊卵巢体积增大、红涨,上面密布充满卵泡液的卵泡。

表1 6周龄杜泊羊获得卵母细胞情况 枚/只

图1 6周龄杜泊羊激素诱导后卵巢上卵泡
2.2 不同浓度β-巯基乙醇成熟液对卵母细胞发育的影响
460.0 枚A、B级卵母细胞分别在不同浓度(0、50、70、100 μmol/L)β-巯基乙醇的对照组、试验Ⅰ、试验Ⅱ和试验Ⅲ组的成熟液中成熟后,经体外受精孵育、受精卵发育培养等过程,卵母细胞的发育情况见表2及图2~3。
由表2可知,试验Ⅰ、Ⅱ、Ⅲ组的卵裂率、囊胚率均比对照组高(P>0.05),其顺序为试验Ⅲ组>试验Ⅱ组>试验Ⅰ组>对照组,100 μmol/L β-巯基乙醇组卵母细胞的卵裂率和囊胚率分别比对照组增加6.09个百分点和9.57个百分点,且囊胚率增加幅度大于卵裂率。表明卵母细胞成熟液中添加β-巯基乙醇可以提高幼龄羊卵母细胞的卵裂率和囊胚率,尤其囊胚率提高幅度更大。β-巯基乙醇浓度在100 μmol/L以内,卵母细胞的卵裂率和囊胚率呈上升趋势。

表2 不同浓度β-巯基乙醇成熟液卵母细胞发育情况

图2 卵母细胞体外受精后的2~4细胞受精卵
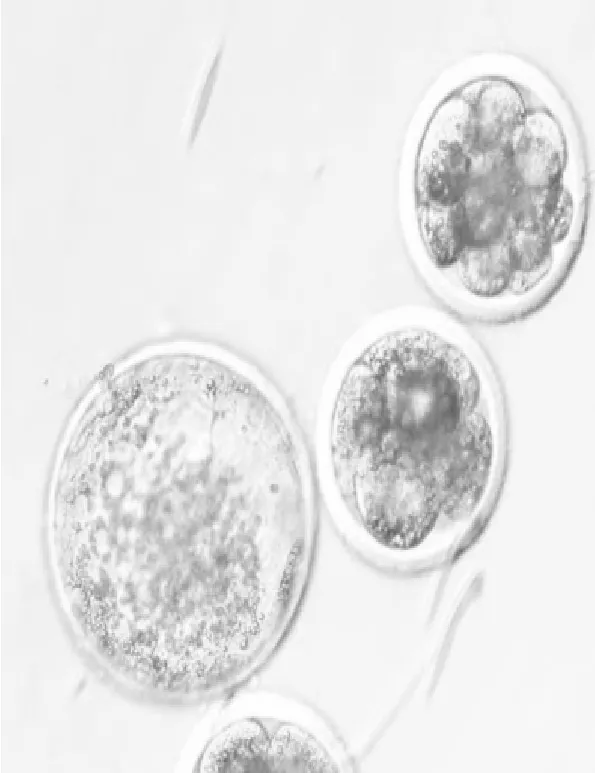
图3 卵母细胞体外受精后的囊胚
3 讨论
幼畜胚胎体外生产的培养体系不仅直接影响卵母细胞成熟的程度和继续发育的能力,而且直接影响幼畜胚胎体外生产的效率。白佳桦[7]、郭洪等[17]研究表明,在4~8周龄的蒙古羔羊、绵羔羊卵母细胞体外成熟液中添加100 μmol/L β-巯基乙醇,卵母细胞正常受精比例和囊胚率显著提高,多精入卵比例明显下降,且正常受精的比例与成年羊没有显著差异(P>0.05)。权富生等[18]研究发现,在牛卵母细胞的颗粒细胞培养液中添加β-巯基乙醇,能提高活细胞率,且活细胞率随着β-巯基乙醇浓度的增大而增加,在浓度为25 μmol/L时活细胞率最高。舒见洪等[19]研究显示,在牛卵母细胞培养液中,添加100 μmol/L的β-巯基乙醇可显著提高牛体外受精后胚胎的囊胚率以及囊胚内细胞团细胞数。兰宗宝等[20]研究发现,在猪卵母细胞成熟液中添加β-巯基乙醇,可以提高胞质内谷胱甘肽浓度,而给受精卵提供适宜的细胞内条件,可防止氧化损伤,有助于胚胎发育到囊胚。本试验表明,在6周龄杜泊羊的卵母细胞成熟液中添加(50、70、100 μmol/L)β-巯基乙醇,提高了卵裂率和囊胚率,尤其是囊胚率;试验Ⅲ组(含100 μmol/L β-巯基乙醇)的卵裂率(65.22%)和囊胚率(21.74%)最高,β-巯基乙醇浓度在100 μmol/L以内,卵母细胞的卵裂率和囊胚率呈上升趋势,且囊胚率增加幅度比卵裂率大,说明β-巯基乙醇有助于卵母细胞发育到囊胚。本研究结果与白佳桦[7]、郭洪等[17]、权富生等[18]、舒见洪等[19]、兰宗宝等[20]的研究结果一致。其原因可能是β-巯基乙醇是一种低分子量的巯醇类化合物,能够还原胱氨酸为半胱氨酸,半胱氨酸是合成谷胱甘肽(Glutathione,GSH)的底物。GSH存在于身体的每一个细胞,具有抗氧化和解毒作用。在卵母细胞发育过程中,它通过自由巯醇基团(-SH)保护细胞发育、氨基酸转运、蛋白质合成和DNA复制等过程中所需功能蛋白质、酶不被氧化,消除活性氧自由基(ROS)对其继续发育的阻滞或延迟作用,加速受精卵中精子解聚和原核形成,减少孤雌激活和多精子受精的发生,提高正常受精的比例和受精卵的发育能力,增加囊胚率。
4 结论
本研究结果表明,成熟液中添加一定量的β-巯基乙醇,能够提高6周龄杜泊羊卵母细胞的发育能力和受精卵质量,β-巯基乙醇浓度在100 μmol/L以内,卵母细胞的卵裂率和囊胚率呈上升趋势。关于成熟液里β-巯基乙醇的最佳浓度,有待进一步研究。
[1]Worthinqton C A,Kennedy J P.Ovarian response to exogenous hormones in six week old lambs[J].Aust J Biol Sci,1979,32(7):91-95.
[2]Trounson A O,Willadsen S M,Moor R M.Reproductive function in prepubertal lambs:ovulation,embryo development and ovarian steroidogenesis[J].J Reprod Fertil,1977,49:69-75.
[3]Kelly J M,Kleemann d O,Walker S K.Enhanced efficiency in the production of offspring from 4-to 8-week-old lambs[J].Theriogenology,2005,63(7):1876-1890.
[4]Kelly J M,Kleemann D O,Walker S K.The effect of nutrition during pregnancy on the in vitro production of embryos from resulting lambs[J].Theriogenology,2005,63(7):2020-2031.
[5]Gou K M,Guan H,Bai J H,et al.Field evaluation of juvenile in vitro embryo transfer(JIVET)in sheep[J].Animal Reproduction Science,2009,112(3/4):316-324.
[6]Bai J H,Hou J,Guan H,et al.Effect of 2-mercaptoethanol and cysteine supplementation during in vitro maturation on the developmental competence of oocytes from hormone-stimulated lambs [J].Theriogenology,2008,70(5):758-764.
[7]白佳桦.性成熟前绵羊、牛JIVET技术研究[D].北京:中国农业大学,2008.
[8]郭洪,万鹏程,石文艳,等.不同品种绵羊超数排卵及胚胎体外生产技术研究[J].畜牧与兽医,2012,44(10):20-24.
[9]汪立芹,何宗霖,林嘉鹏,等.萨福克羔羊卵泡诱导发育效果的研究[J].中国农业大学学报,2015,20(4):141-146.
[10]刘宗正,李和刚,程明,等.利用JIVET技术快速繁育萨福克羊的研究[J].畜牧与饲料科学,2016,37(3):1-3.
[11]马世科,乔海生,马利青,等.幼畜超数排卵及体外胚胎生产技术在青海高原地区的应用研究[J].青海畜牧兽医杂志,2015,45(2):13-14.
[12]陈晓勇,田树军,桑润滋,等.诱导幼羔卵泡发育及体外胚胎生产[J].农业生物技术学报,2008,16(3):456-460.
[13]郭洪,万鹏程,代蓉,等.羔羊卵母细胞体外胚胎生产影响因素分析[J].湖北农业科学,2013,52(19):4726-4729.
[14]李运生,曹鸿国,刘亚,等.羔羊超数排卵与胚胎体外生产技术研究进展[J].动物医学进展,2011,32(11):99-104.
[15]韩岩,尹多,张涛,等.谷胱甘肽对卵母细胞成熟及胚胎发育影响的研究进展[J].江苏农业科学,2010(3):269-270.
[16]曹忻,赵有璋,罗海玲,等.血管内皮生长因子对体外成熟绵羊卵母细胞超微结构变化的影响[J].畜牧兽医学报,2010,41(2):167-173.
[17]郭洪,万鹏程,石文艳,等.EGF和β-巯基乙醇对羔羊卵母细胞体外受精和体外发育的影响[J].安徽农业科学,2012,40(11):6537-6540.
[18]权富生,刘琴,王丽,等.β-巯基乙醇和发情羊血清对牛颗粒细胞体外培养的影响[J].西北农业学报,2011,20(12):22-25.
[19]舒建洪,张志鹏,李向臣,等.β-巯基乙醇对牛孤雌胚胎发育的影响[J].西北农林科技大学学报,2008,36(12):24-28.
[20]兰宗宝,何若钢,莫品方,等.β-巯基乙醇对猪卵母细胞体外受精及胚胎发育的影响[J].广西畜牧兽医,2008,24(4):202-203.

