大动脉炎肺动脉受累者超声心动图评价右心功能的临床观察
张宇
(广东省茂名市中医院 功能科,广东 茂名 525000)
大动脉炎好发于主动脉弓及其分支,往往忽略其对肺动脉的侵犯[1]。大量文献显示,大动脉炎患者并发肺动脉高压发生率有50%,甚至更高[2]。故对大动脉炎肺动脉受累患者的右心功能进行评估,是一种了解疾病危害程度的有效手段,医务人员可根据结果对患者进行及时有效的治疗,临床意义重大。本研究选取2014年8月‐2017年3 月本院首次确诊为大动脉炎肺动脉受累的患者43 例,探讨应用超声心动图对大动脉炎肺动脉受累者右心功能评价的临床价值,结果令人满意,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年8月‐2017年3月本院首次确诊为大动脉炎肺动脉受累的患者43例,其中,男9例,女34例;年龄26~49岁,平均(38.2±8.4)岁。大动脉炎诊断均符合美国风湿病学会制定的相关标准[3],平均病程(37.4±4.3)个月,有18例患者仍处于病情活动期。排除合并有其他影响右心功能疾病的患者以及相关血管疾病患者。将该43 例患者纳入观察组,另选取同时期本院体检中心健康体检者30例,纳入对照组。经医院伦理委员会审批,所有患者签署知情同意书。对比两组患者基线数据,确保差异无统计学意义(P >0.05),具有可比性。
1.2 方法
1.2.1 肺血管CT造影与肺动脉造影 使用通用公司HighSpeed VCT和Signal 64层CT扫描患者整个肺野已进行肺血管CT造影(CT pulmonary angiography, CTPA)。Seldinger技术则用于肺动脉造影。造影剂为优维显(Ultravist)370 mgI/ml。
1.2.2 超声心动图 常规行彩色多普勒超声与二维检查,超声仪器选择Philips iE33彩色超声诊断仪,S5-1探头。根据美国超声心动图学会所制定的成人右心指南设置右心检查参数,包括以右心室为中心测量右房长径(right atrial long axis diameter, RAL)、右房短径(right atrial short axis diameter, RAS)、右室基底径(right ventricular diameter, RVD)、右室壁厚度(right ventricular wall thickness, RVT)、右室面积变化分数(right ventricular fractional area change, RVFAC%)、三尖瓣环收缩期峰值速度(S')、肺动脉收缩压(systolic pulmonary artery pressure, SPAP)以及右室做功指数(right ventricular index of myocardial performance,RIMP)。所有参数测量均由经验丰富的高级技术职称人员进行,测量3次取平均值。
1.3 统计学方法
使用SPSS 19.0软件包对本研究数据进行统计学分析。验证正态分布性后,计量资料以均数±标准差(±s)表示,计量资料与计数资料分别采用t检验、χ2检验进行分析。P <0.05为差异有统计学意义。
2 结果
2.1 肺动脉受累情况
43例大动脉炎患者主要以扩张、狭窄、闭塞及扭曲为肺动脉受累表现。其中,14例患者发生一侧肺动脉主干完全闭塞,9例患者为右肺动脉,5例患者为左肺动脉。
2.2 右心功能变化情况
观察组43例患者中,23例出现右房右室增大,占53.49%,15例出现右室肥厚,占34.88%,29 例出现肺动脉高压,占67.44%。与对照组健康体检者相比,观察组患者RAL、RAS、RVD、RVT、SPAP和RIMP水平升高,RVFAC%与S'水平下降,差异有统计学意义(P <0.05)。详见表1。
2.3 肺动脉主干闭塞患者右心功能比较
本研究中共有14例患者发生一侧肺动脉主干完全闭塞,其中8例发生右心功能不同程度降低,SPAP升高,平均(89.23±24.32)mmHg,见图1。另有6例患者右心功能正常,SPAP未见升高,平均(23.03±5.43)mmHg,见图 2。
表1 右心功能变化情况比较 (±s)
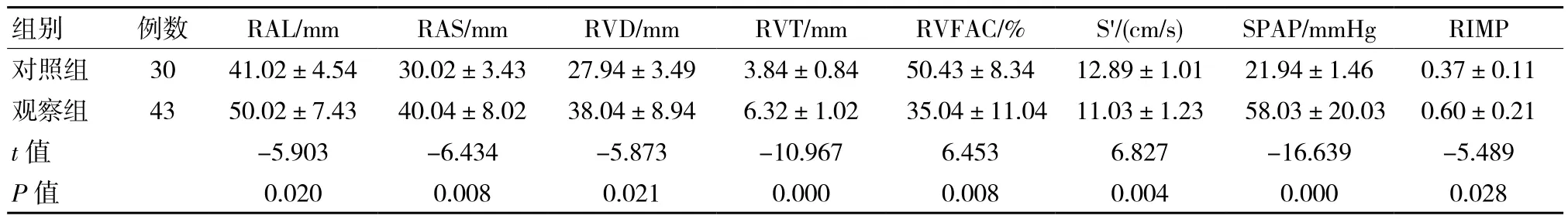
表1 右心功能变化情况比较 (±s)
组别 例数 RAL/mm RAS/mm RVD/mm RVT/mm RVFAC/% S'/(cm/s) SPAP/mmHg RIMP对照组 30 41.02±4.54 30.02±3.43 27.94±3.49 3.84±0.84 50.43±8.34 12.89±1.01 21.94±1.46 0.37±0.11观察组 43 50.02±7.43 40.04±8.02 38.04±8.94 6.32±1.02 35.04±11.04 11.03±1.23 58.03±20.03 0.60±0.21 t值 -5.903 -6.434 -5.873 -10.967 6.453 6.827 -16.639 -5.489 P值 0.020 0.008 0.021 0.000 0.008 0.004 0.000 0.028

图1 患者女性,34岁,肺动脉造影可见左肺动脉闭塞(左),超声可示右心明显扩大(右)
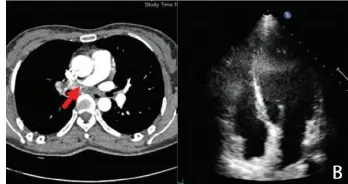
图2 患者女性,42岁,CT P A可见右肺动脉远端闭塞(左),超声可示右心大小正常(右)
3 讨论
作为结缔组织疾病的一种,大动脉炎好发于年轻女性,有流行病学研究显示,我国40岁前大动脉炎患者男女比例约为1∶4[4],这与本研究中比例接近。该病多以血管狭窄、组织器官缺血、非特异性炎症为临床表现[5],但起病隐匿,以上症状与体征多不典型,容易误诊、漏诊、延误治疗时机,许多患者都延误至肺动脉出现高压才得到正确诊断[6]。病变早期以血管外层出现肉芽肿炎性病变为特点,并随疾病的进展而逐渐发展至血管全层,使血管纤维化,管壁增厚,管腔狭窄,甚至闭塞[7]。若肺动脉受累,则会导致肺动脉高压,最终诱发右心衰竭,严重危害患者生命[8]。故对大动脉炎肺动脉受累患者的右心功能进行评估,是一种了解疾病危害程度的有效手段,医务人员可根据结果对患者进行及时有效的治疗,临床意义重大。
关于大动脉炎患者肺动脉受累发生率的高低尚无定论。国外学者报道称,对200例大动脉炎患者进行回顾性分析,肺动脉受累并导致肺动脉高压的发生率为43%[9]。而国内有文献报道,对94例大动脉炎患者进行相关检查,有69例(73%)并发肺动脉高压[10]。在本研究中,肺动脉高压的发生率为67.44%,与国内学者研究结果基本相符,且肺动脉收缩压>50 mmHg的患者占82%,提示对于大动脉炎患者,肺动脉受累后肺动脉高压的发生率较高,且程度较重。进一步的超声心动图结果显示,该类患者各项右心功能指标显著低于对照组中的健康者,提示右心功能收到不同程度损伤。
在对一侧肺动脉主干完全闭塞的14例患者右心功能评价中,笔者发现有6例患者的右心功能与其肺动脉病变程度不一致。有学者认为,对于无心肺基础性疾病的患者,肺血管床阻塞程度应与肺动脉压力成正比[11]。对于本研究中6例右心功能正常的一侧肺动脉主干完全闭塞患者,推测是由于大动脉炎发展缓慢,受累血管有较为丰富的侧支循环,当一侧肺动脉受损,同侧支气管循环可代偿性增粗,而对侧肺血管也能发挥一定代偿作用。
综上所述,大动脉炎肺动脉受累会导致患者右心功能不全,但仍有个别患者在肺血管严重病变的前提下保持右心功能正常,其机制有待进一步研究。
[1] Saadoun D, Garrido M, Comarmond C, et al. Th1 and Th17 cytokines drive Takayasu arteritis inflammation[J]. Arthritis Rheumatol, 2015, 67(5): 1353-1360.
[2] Eleftheriou D, Varnier G, Dolezalova P, et al. Takayasu arteritis in childhood: retrospective experience from a tertiary referral centre in the United Kingdom[J]. Arthritis Research & Therapy, 2015,17(1): 36.
[3] Serra R, Butrico L, Fugetto F, et al. Updates in pathophysiology,diagnosis and management of Takayasu arteritis[J]. Annals of Vascular Surgery, 2016, 2(35): 210.
[4] Guleria A, Misra D P, Rawat A, et al. NMR based serum metabolomics discriminates Takayasu arteritis from healthy individuals: a proof of principle study[J]. Journal of Proteome Research, 2015, 14(8): 3372.
[5] Mekinian A, Comarmond C, Resche-Rigon M, et al. Efficacy of biological-targeted treatments in Takayasu arteritis: multicenter,retrospective study of 49 patients[J]. Circulation, 2015, 132(18):1693.
[6] Watanabe Y, Miyata T, Tanemoto K. Current clinical features of new patients with Takayasu arteritis observed from cross-country research in Japan: age and sex specificity[J]. Circulation, 2015,132(18): 1701-1709.
[7] Furuta S, Cousins C, Chaudhry A, et al. Clinical features and radiological findings in large vessel vasculitis: are Takayasu arteritis and giant cell arteritis 2 different diseases or a single entity?[J].Journal of Rheumatology, 2015, 42(2): 300-308.
[8] Wang X, Dang A, Lv N, et al. High-sensitivity C-reactive protein predicts adverse cardiovascular events in patients with Takayasu arteritis with coronary artery involvement[J]. Clinical Rheumatology,2016, 35(3): 679-684.
[9] Maejima Y, Tamura N, Ito Y, et al. Abstract 340: single nucleotide polymorphism of MLX gene plays a crucial role in the pathogenesis of Takayasu arteritis through facilitating inflammasome formation of the aorta[J]. Journal of Tribology, 2015, 124(3): 461-467.
[10] 曾绮娴, 柳志红, 何建国,等. 多发性大动脉炎累及肺动脉所致肺动脉高压患者的临床特征[J]. 中华医学杂志, 2016,96(16): 1252-1255.
[11] Mason J C. Takayasu arteritis: surgical interventions[J]. Current Opinion in Rheumatology, 2015, 27(1): 45-52.

