槲皮素对宫颈癌细胞C33A增殖和凋亡的影响
槲皮素是一种具有多种生物活性的黄酮类化合物,具有免疫调节、抗菌、抗病毒以及清除自由基等多种作用[1]。研究[2-5]表明,槲皮素可有效抑制乳腺癌、结肠癌、肝癌及卵巢癌等多种恶性肿瘤细胞的增殖。同时,槲皮素还可增强肿瘤细胞对化疗药物的敏感性,可与其他化疗药物联合用于肿瘤的化学治疗[6-10]。
因此,本研究通过槲皮素作用于人宫颈癌C33A细胞,研究槲皮素对C33A细胞增殖及凋亡的影响,并初步探讨其相关作用机制,为临床槲皮素治疗宫颈癌提供参考。
1 材料与方法
1.1 材料与试剂 人子宫颈癌细胞系C33A购自武汉普诺赛生命科技有限公司(CL-0045)。 槲皮素购于Sigma公司(Q4951),顺铂购于Sigma公司(479306-1G), DMEM培养基购于Gibco公司(12100-046),胎牛血清购于HyClone公司(SH30070.04),Cyclin D1鼠单克隆抗体(sc-20044)、Caspase-3鼠单克隆抗体(sc-273503)、Caspase-9鼠单克隆抗体(sc-273525)和β-actin鼠单克隆抗体(sc-130656)均购于Santa Cruz公司,二甲基亚砜 (dimethylsulfoxide, DMSO)购于Sigma公司(D-2678),噻唑蓝染液(thiazole blue,MTT)购于Sigma公司(BR-03955),其余为国产分析纯试剂。
1.2 方法
1.2.1 细胞培养 人宫颈癌C33A细胞培养于含10%胎牛血清的1640培养基中,置于含5%CO2的37℃孵箱中常规培养, 每3~4 d用胰酶消化、传代1次。
1.2.2 药物配置与实验分组 将241.792 mg槲皮素溶于10 mL DMSO中作为备用母液,-20℃保存备用。实验时,将1 mL母液加入999 mL DMEM培养液稀释为80 μmol/L,之后分别等倍稀释为20、40 μmol/L,DMSO的最终浓度<0.1%。将C33A细胞分为对照组(1640培养基+DMSO)、槲皮素组(20、40和80 μmol/L)、顺铂组(5、10、15、20 μg/mL)、联合组(槲皮素40 μmol/L+顺铂 10 μg/mL[11])。
1.2.3 MTT法检测细胞活力 C33A细胞经胰酶消化后,制成单细胞悬液,按照4×104个/孔的细胞浓度接种于96孔板中,每孔加入200 μL 1640培养液。待细胞贴壁后,换为含有不同浓度的槲皮素和顺铂培养液培养。各孔细胞在培养24 h和48 h后,吸弃培养液,分别加入100 μL MTT(5 g/L),37℃孵育4 h后吸弃上清液;再分别加入150 μL DMSO,混匀后测定490 nm波长处每孔的光密度值(optical density,OD) ,每组均设置3个复孔。细胞活力计算公式:细胞活力(%)=(槲皮素组OD值/对照组OD值)×100%。
1.2.4 流式细胞术检测细胞周期 C33A细胞经胰酶消化后,接种于6孔板中,待细胞贴壁后, 更换为含有不同浓度(空白对照、20、40和80 μmol/L)槲皮素的培养液中。48 h后收集各组细胞,1 000 r/min离心5 min后,吸弃上清,加入70%酒精4 ℃固定12 h。再次离心,用含0.01% RNase的碘化丙啶(propidium iodide,PI)避光染色30 min后,上机检测。通过CellQuest软件分析结果,每组均设置3个复孔。
1.2.5 Western Blot检测蛋白表达 C33A细胞经胰酶消化后,接种于6孔板中,待细胞贴壁后, 更换为含有不同浓度(空白对照、20、40和80 μmol/L)槲皮素的培养液中。48 h后收集细胞,裂解并测定各组细胞的蛋白浓度,行SDS-PAGE分离蛋白。电泳结束后,将膜移至含5%脱脂奶粉的TBST缓冲液中室温封闭1 h,TBST洗膜10 min×4次。加入一抗,4℃孵育过夜。加入辣根过氧化物酶标记的二抗(1∶10 000),室温孵育1 h,用检测液行发光反应,于暗室中曝光,通过Image J软件进行灰度分析,计算蛋白的相对表达量。
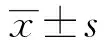
2 结果
2.1 槲皮素对C33A细胞活力的影响 经过槲皮素处理24 h后,各组细胞活力分别为(86.92±3.953)%(20μmol/L组)、(66.54±3.932)%(40μmol/L组)和 (52.21±2.970)%(80μmol/L组),均低于空白对照组的(98.35±1.230)% ;经过槲皮素处理48 h后,各组细胞活力分别为(65.19±7.071)%(20μmol/L组)、(47.04±8.881)%(40μmol/L组)和 (29.71±6.505)%(80μmol/L组),均低于空白对照组的(96.97±1.788)%。C33A细胞经过不同浓度的槲皮素处理后,细胞活力均低于空白对照组,差异有统计学意义(P<0.05);经不同浓度的顺铂(5、10、15、20 μg/mL)处理后C33A细胞的细胞活力也低于空白对照组(P<0.05);此外,槲皮素40 μmol/L+顺铂 10 μg/mL联合作用于C33A细胞24 h后,细胞活力下降为(31.12±2.835)%; 48 h后,细胞活力下降为(17.86±3.182)%,低于空白对照组,差异有统计学意义(P<0.05)。详见表1。

表1 槲皮素及顺铂对C33A细胞活力的影响
2.2 槲皮素对C33A细胞周期的影响 C33A细胞分别经不同浓度(空白对照、20、40和80 μmol/L)槲皮素作用48 h后,G0/G1期细胞百分比为(47.07±2.404)%、(52.48±1.188)%、(60.30±1.874)%和(64.54±2.157)%,S期细胞百分比为(29.41±2.114)%、(23.69±1.881)%、(20.41±3.111)%和(16.62±1.570)%,差异均具有统计学意义(P<0.05)。详见表2。
2.3 槲皮素对C33A细胞Cyclin D1、Caspase-3 和Caspase-9蛋白表达的影响 根据前期MTT的结果,在槲皮素浓度为40 μmol/L,作用时间为48 h的条件下,对C33A的细胞活力的抑制作用比较明显,而且细胞凋亡的作用也不至于过于强烈,因此选择该条件来检测槲皮素对蛋白表达的影响。与空白对照组(蛋白相对表达量分别为:0.315±0.024、0.082±0.019、0.070±0.006)相比,槲皮素(浓度为40 μmol/L)作用于C33A 细胞48 h后,Cyclin D1表达降低(0.152±0.002),Caspase-3 和Caspase-9的表达增多(0.481±0.013、0.306±0.014),差异均具有统计学意义(t=6.687、17.020、15.690,P=0.022、0.003、0.004)。详见图3。

图3 槲皮素对Cyclin D1、Caspase-3 和Caspase-9蛋白表达的影响

表2 槲皮素对C33A细胞周期的影响
3 讨论
槲皮素是一种天然的黄酮类化合物,包括芸香苷和槲皮苷2种糖基化形式,广泛分布于水果、蔬菜及多种中草药中。研究[1-3]表明,槲皮素有抗氧化、抗菌、抗病毒、抗炎以及保护心血管等功能。本研究中,宫颈癌细胞C33A经不同浓度槲皮素作用24 h和48 h后,C33A细胞活力同空白对照组相比出现了明显的下降。上述结果表明,随着槲皮素作用浓度的升高以及时间的延长,槲皮素抑制C33A细胞的能力也在增强。
此外,细胞周期结果显示,C33A细胞经不同浓度(20、40和80 μmol/L)槲皮素处理48 h后,G0/G1期细胞百分比明显增加,而S期细胞百分比则出现明显下降(P<0.05)。上述结果表明,槲皮素可增加G0/G1期细胞数量,同时减少S期细胞数量,从而抑制C33A细胞的增殖。同时,Western Blot检测结果显示,槲皮素可下调C33A细胞周期相关蛋白Cyclin D1的表达。因此,推测槲皮素可能是通过下调细胞中Cyclin D1蛋白的表达,阻断细胞由G0/G1期向S期的转换,从而抑制C33A细胞的增殖和活力。
施剑明等[12]研究发现,槲皮素可影响人骨肉瘤MG-63细胞的增殖及凋亡,,与顺铂联合有协同效应。本研究中,两者联合作用于C33A细胞24 h和48 h后,细胞活力分别为(31.12±2.835)%和(17.86±3.182)%,作用效果强于相同条件下两者单独使用,提示槲皮素可增强顺铂对C33A细胞的敏感性,与顺铂具有协同效应。
Caspase-3 和Caspase-9作为凋亡信号转导通路中的关键蛋白,可以诱导细胞进入凋亡程序。有研究[13]证实,槲皮素可通过上调Caspase-3的表达,促进人膀胱癌细胞的凋亡。本研究中,Western Blot结果显示,槲皮素增加C33A细胞凋亡相关蛋白Caspase-3 和Caspase-9的表达。因此,推测槲皮素可能通过提高Caspase-3 和Caspase-9的表达,促进C33A细胞凋亡。
综上所述,槲皮素可能通过调节周期相关蛋白Cyclin D1以及凋亡相关蛋白Caspase-3 和Caspase-9的表达,抑制C33A细胞的增殖和活力;槲皮素还可以增强顺铂对C33A细胞的敏感性,与顺铂具有协同效应,相关作用机制还有待进一步研究。
[1] REN M X, DENG X H, AI F, et al. Effect of quercetin on the proliferation of the human ovarian cancer cell line SKOV-3 in vitro[J]. Exp Ther Med,2015,10(2):579-583.
[2] ZHAO X, WANG Q, YANG S, et al. Quercetin inhibits angiogenesis by targeting calcineurin in the xenograft model of human breast cancer[J]. Eur J Pharmacol,2016,781:60-68.
[3] 王芬,熊玲. 槲皮素对结肠癌SW480细胞增殖及蛋白表达的影响[J]. 医学综述,2015,21(16):3011-3013.
[4] CHENG Z, SUN G, GUO W, et al.Inhibition of hepatitis B virus replication by quercetin in human hepatoma cell lines[J].Virol Sin,2015,30(4):261-268.
[5] 邓晓慧,宋海岩,孙春莉. 槲皮素对人卵巢癌SKOV-3细胞增殖的影响[J]. 中国病理生理杂志,2013,29(1):99-102.
[6] 张润香,谌学军,王顺金,等. 槲皮素对人肝癌细胞耐药株SMMC7721/VCR逆转作用的实验研究[J]. 江西医学院学报,2008,48(4):25-27.
[7] 王力,董怀平,高恒强,等. 槲皮素逆转人胆囊癌细胞耐药性的作用机制探讨[J]. 山东医药,2007,47(29):21-23.
[8] 谭君,祝连彩,王伯初. Survivin和Bcl-2调节槲皮素诱导的A549细胞凋亡[J]. 中国药理学通报,2008,24(9):1220-1224.
[9] 谭君,祝连彩,王伯初. Survivin在槲皮素诱导肝癌细胞SMMC7721凋亡中的调节作用研究[J]. 时珍国医国药,2008,19(10):2358-2360.
[10]顾超,徐水凌,唐文稳,等. 槲皮素诱导HeLa细胞凋亡及Caspase-3、Caspase-8活化对凋亡影响的研究[J]. 中国药学杂志,2011,46(8):595-599.
[11]张欣,董春力,付丽丽,杜鹃,李少闻. 槲皮素对宫颈癌细胞SiHa增殖的影响[J]. 国际妇产科学杂志,2017,44(3):304-306,311.
[12]施剑明,殷嫦嫦,孙维君,等. 槲皮素联合顺铂对人骨肉瘤MG-63细胞增殖及凋亡的影响[J]. 中国药理学通报,2014(10):1361-1366.
[13]SU Q, PENG M, ZHANG Y, et al. Quercetin induces bladder cancer cells apoptosis by activation of AMPK signaling pathway[J]. Am J Cancer Res,2016,6(2):498-508.

