肝癌高表达抗原MAGEC2 CTL表位肽的鉴定*
贺晓静, 贺 洁
(1开封大学医学部, 2河南大学生命科学院, 河南 开封 475000)
肝癌是世界上最流行的恶性肿瘤之一,全球每年新发病例达200万例。5年生存率低至5%[1]。鉴于肝癌患者手术和化疗后的预后不良,为了改善治疗,因此,需要探索更多的治疗方法。近些年,肿瘤免疫治疗已经成为一个很有发展前景的治疗方法。这种方法具有消除全身肿瘤细胞的潜力,并具有区分肿瘤和非肿瘤细胞的特异性。在恶性肿瘤组织中过表达的基因或抗原是特异性肿瘤免疫治疗的先决条件[2]。MAGEC2 (GenBank: AF151378)几乎不出现在正常组织中,仅在睾丸中检测到MAGEC2 的mRNA表达;但是在肝癌、恶性黑色素瘤和膀胱癌中具有高水平的MAGEC2表达。它又被称为肝细胞癌相关抗原587(hepatocellular carcinoma-associated antigen 587,HCA587)。HCA587是从肝癌患者的肝癌组织DNA表达文库中克隆出来、且在多种肿瘤组织中高表达的一种新型肿瘤/睾丸(cancer/testis,CT)抗原[3-4]。有研究发现,肝癌样品中有特别高的MAGEC2表达,mRNA水平为70%,蛋白水平为38%[5]。肿瘤抗原多肽诱导的细胞毒性T淋巴细胞(cytotoxic T-lymphocyte,CTL)除了具有特异性外,在设计上还可以对野生型多肽进行改造,从而提高主要组织相容性(抗原)复合物(major histocompatibility complex,MHC)分子的结合力,以及T细胞识别的兼并性等。本研究使用NetCTL 1.2、SYFPEITHI和IEDB等生物信息学软件进行综合预测,筛选出综合打分较高的表位,并对优势表位进行适当替换,通过鉴定筛选出新的MAGEC2 HLA-A2限制性CTL表位[6-7]。多肽疫苗的设计核心是T细胞表位,其鉴定和改造是多肽疫苗发展及应用的基础[8-10]。
材 料 和 方 法
1 材料
T2细胞和HepG2细胞(MAGEC2+、HLA-A2+)[6]由开封大学医学部实验室常规保存,在37 ℃、5% CO2饱和湿度培养条件下常规培养。外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)由HLA-A2+健康供者捐赠。HLA-A2+外周血健康供者来自课题组寻找的健康供者。
2 方法
2.1HLA-A2限制性CTL表位肽的预测 使用NetCTL 1.2(http://www.cbs.dtu.dk/services/NetCTL/)、SYFPEITHI(http://www.syfpeithi.de/bin/MHCServer.dll/EpitopePrediction.htm)和IEDB(http://tools.iedb.org/main/tcell/)软件对MAGEC2氨基酸序列进行预测打分。分别打开这3种预测软件的主页,进入 CTL 表位预测界面。本次研究以A2超型为主;参数设定:CTL表位限制性MHC类型为HLA-A*0201;预测抗原肽为nonamers (9 aa)。根据各个预测软件所推选的前10个优势表位进行综合选择,选出在各种软件打分较好的HLA-A2限制性表位[11]。
2.2HLA-A2限制性CTL表位肽的合成 候选表位肽由上海生工生物工程有限公司合成,经HPLC分析纯化后,其纯度>95%,质谱分析其相对分子质量符合理论值。
2.3质谱鉴定 采用电喷雾电离质谱(electrospray ionization mass spectrometry,ESI-MS)鉴定多肽。我们使用的仪器是德国布鲁克道尔顿仪器公司的BRU KER Esquire-3000电喷雾-离子阱多级质谱仪。根据质谱鉴定结果与肽段分子量进行对比,确定所合成的多肽是否为设计的表位肽。电喷雾质谱条件设置:喷雾器压力为7.0或11.0 Psi;干燥器流速为4.0或8.0 L/min;温度为300 ℃;喷雾针电压为4.0 kV。G2025A Software A.02.01数据分析软件检测精肽的分子质量。
2.4表位肽与HLA-A2分子结合力实验 收集T2细胞,用无血清RPMI-1640培养基洗3次,调整细胞密度至1×109/L,铺于24孔板中(每孔1 mL),每实验孔加入待测肽50 μmol/L,β2-微球蛋白3 mg/L,37 ℃、5% CO2共孵育18 h后,冷PBA洗涤3次,加入500 μL稀释度为1∶100的单克隆抗体(鼠抗人β2-微球蛋白),4 ℃避光静置40 min。之后冷PBA洗涤3次,加入50 μL稀释度为1∶50的FITC-羊抗鼠抗体溶液,4 ℃静置40 min,PBA洗涤1次后上流式细胞仪检测。其结果用荧光指数表示:荧光指数(flourescence index,FI)=(表位肽平均荧光强度-背景平均荧光强度)/背景平均荧光强度。FI>1.0表示高等结合力,1.0>FI>0.5表示中等结合力,FI<0.5表示低结合力。
2.5CTL的体外诱导 抽取HLA-A2+健康供者的外周血,肝素钠抗凝,经常规聚蔗糖-泛影葡胺分层液梯度离心,获取PBMCs,用含10%胎牛血清的IMDM培养基调整细胞浓度为1.5×109/L。第2天分别加入10 mg/L的候选肽共培养,第3天加入5×104U/L的rIL-2继续培养。每周收集细胞,1 000 r/min离心10 min,除去上清,加入新鲜的10%胎牛血清的IMDM培养基,同时加入上述条件的候选肽和rIL-2。刺激3轮后于最后一次刺激的第3天收集细胞。调整细胞浓度作为效应细胞。用无血清IMDM培养基调整细胞浓度作为靶细胞。
2.6IFN-γ分泌水平的检测 取出酶联免疫斑点(enzyme-linked immunospot,ELISPOT)实验板条(购自达科为生物技术有限公司),加200 μL无血清的IMDM培养基进行封闭,静置10 min;诱导的CTL作为效应细胞,荷肽的T2作为刺激细胞,细胞浓度均调整为2×109/L;设立对照孔和实验孔;37 ℃、5% CO2孵育18 h;倾尽孔中培养基,每孔加入200 μL无菌的去离子水,4 ℃ 裂解细胞10 min;倾尽孔内液体,加入200 μL 1×Washing Buffer 洗涤6次,每次停留60 s;加入 100 μL生物素标记的抗体,37 ℃ 孵育1 h;倾尽孔内液体,加入200 μL 1×Washing Buffer进行洗涤,方法同上,在吸水纸上拍干;加入100 μL酶联亲和素,37 ℃ 孵育1 h;每孔加入200 μL 1×Washing Buffer进行洗涤,方法同上;加入100 μL现配的AEC显色液,25 ℃避光静置30 min;结束后置于通风处,室温静置干燥;结果用 ELISPOT 图像分析仪计数 96 孔板中每孔的斑点数[12]。
2.7细胞毒活性检测 调整CTL细胞浓度为5×109/L;调整靶细胞HepG2细胞浓度为1×108/L;按50∶1、25∶1和12.5∶1的不同效靶比铺于96孔板中,同时设立效应细胞自发释放组、靶细胞自发释放组、靶细胞最大释放组、体积校正组和背景对照组,每孔终体积为100 μL。37 ℃、体积分数5%的CO2培养4 h。于孵育结束前45 min,在靶细胞最大释放组及体积校正组中加入10 μL裂解液。1 000 r/min离心4 min,转移50 μL上清至另一干净96孔板中,每孔加入50 μL底物混合液,室温避光孵育30 min;每孔再加入50 μL终止液。用酶标仪检测其在490 nm波长处的吸光度(A)值。杀伤率(%)=(实验孔A值-效应细胞自发释放A值-CTL自发释放A值)/(靶细胞A值-效应细胞自发释放A值)×100%。
2.8胞内因子染色法 诱导的CTL作为效应细胞,荷肽的T2细胞作为刺激细胞;阴性对照孔每孔加入1×109/L的效应细胞;阳性对照孔每孔加入1×109/L的效应细胞和100 μL植物血凝素再补加900 μL无血清的IMDM培养基培养。加入阻断剂brefeldin A 5 mg/L到培养体系中,充分混匀。培养箱中37 ℃、5% CO2孵育4 h;孵育结束后,1 500 r/min,离心5 min,收集细胞,PBS洗涤 2 次,用含2% FBS溶液的PBS将细胞重悬。避光加入细胞表面抗体,4 ℃避光孵育20 min,1 500 r/min,离心5 min。收集细胞,每孔加入100 μL破膜剂,4 ℃孵育20 min。加入抗IFN-γ抗体,4 ℃避光孵育30 min;每管加入500 μL细胞染色溶液,重悬,转移到Falcon 圆底试管中上机检测。
3 统计学处理
采用SPSS 16.0分析数据实验数据用均数±标准差(mean±SD)表示,采用单因素方差分析检验多组平均数之间的差别,用GraphPad Prism软件绘图,以P<0.05为差异有统计学意义。
结 果
1 MAGEC2 HLA-A2限制性CTL表位的预测结果
为了预测MAGEC2蛋白开放阅读框中潜在的HLA-A*0201限制性CTL表位,依据NetCTL 1.2、SYFPEITHI和IEDB软件的结果,选取在各个预测软件中分值排名靠前的表位肽,根据这3个预测软件进行综合打分,筛选出分值在各个软件中打分较好的CTL表位肽,对筛选的表位肽进行氨基酸替换,软件预测改造表位打分情况见表1。候选表位肽由上海生工生物工程有限公司合成,用质谱仪测定其分子量,结果显示各多肽分子量测定值与理论值相符,表明合成的多肽是我们所需要的目的肽,见表2。

表1 MAGEC2 HLA-A2限制性CTL表位预测结果
2 表位肽/HLA-A2分子结合力实验结果
T2结合力实验测试表位肽与HLA-A*0201的结合能力。使用流式细胞术进行检测,对所得到的数据进行处理,结果表明P248、P248-1Y、P248-2L、P356、P356-1Y、P356-2L和P356-1Y2L均具有较好结合力(FI>0.5),见表2。这一结果表明,经过改造后的表位肽与MHC分子的结合能力明显提高。
表2候选肽与HLA-A*0201分子结合力结果
Table 2. The HLA-A*0201 binding affinity of the peptides derived from MAGEC2

PeptideESI⁃MS[M+H]+CalculatedObservedFIP228970.2971.20.36P228⁃1Y1046.31047.20.46P2481042.21042.50.86P248⁃1Y1106.31105.41.82P248⁃2L1042.21042.31.06P3171019.21021.60.24P317⁃1Y1035.21032.70.48P356922.1922.30.76P356⁃1Y986.1986.51.28P356⁃2L904.0905.21.08P356⁃1Y2L968.1969.81.87HBcAg18⁃271155.31155.61.24
FI=[mean fluorescence intensity (MFI) of the peptide-MFI background]/MFI background.
3 IFN-γ分泌水平结果
为了检测表位肽是否可被MAGEC2抗原特异性的CD8+T细胞识别,根据结合力的实验结果,我们选择了较好结合力的多肽进行实验,结果显示,P248、P248-1Y、P356、P356-1Y、P356-2L和P356-1Y2L多肽疫苗能检测到特异性T细胞免疫,能分泌较多的IFN-γ,且P248-1Y和P356-1Y2L诱导特异性T细胞免疫分泌的IFN-γ略高于原肽(P<0.05),见图1。
4 细胞毒实验结果
根据IFN-γ分泌水平结果,我们将有效果的P248、P248-1Y、P356和P356-1Y2L的免疫活性进行进一步检测。P248和P248-1Y这2条候选肽诱导得到的CTL在效靶比为50∶1时对靶细胞的杀伤率分别是(29.5±3.56)%和(36.3±3.26)%,P356和P356-1Y2L这2条候选肽诱导得到的CTL在效靶比为50∶1时对靶细胞的杀伤率分别是(26.5±3.02)%和(38.6±2.32)%,与阴性对照组(PBS组)和无关肽组(HBcAg18-27组)比较均显著升高,见图2。
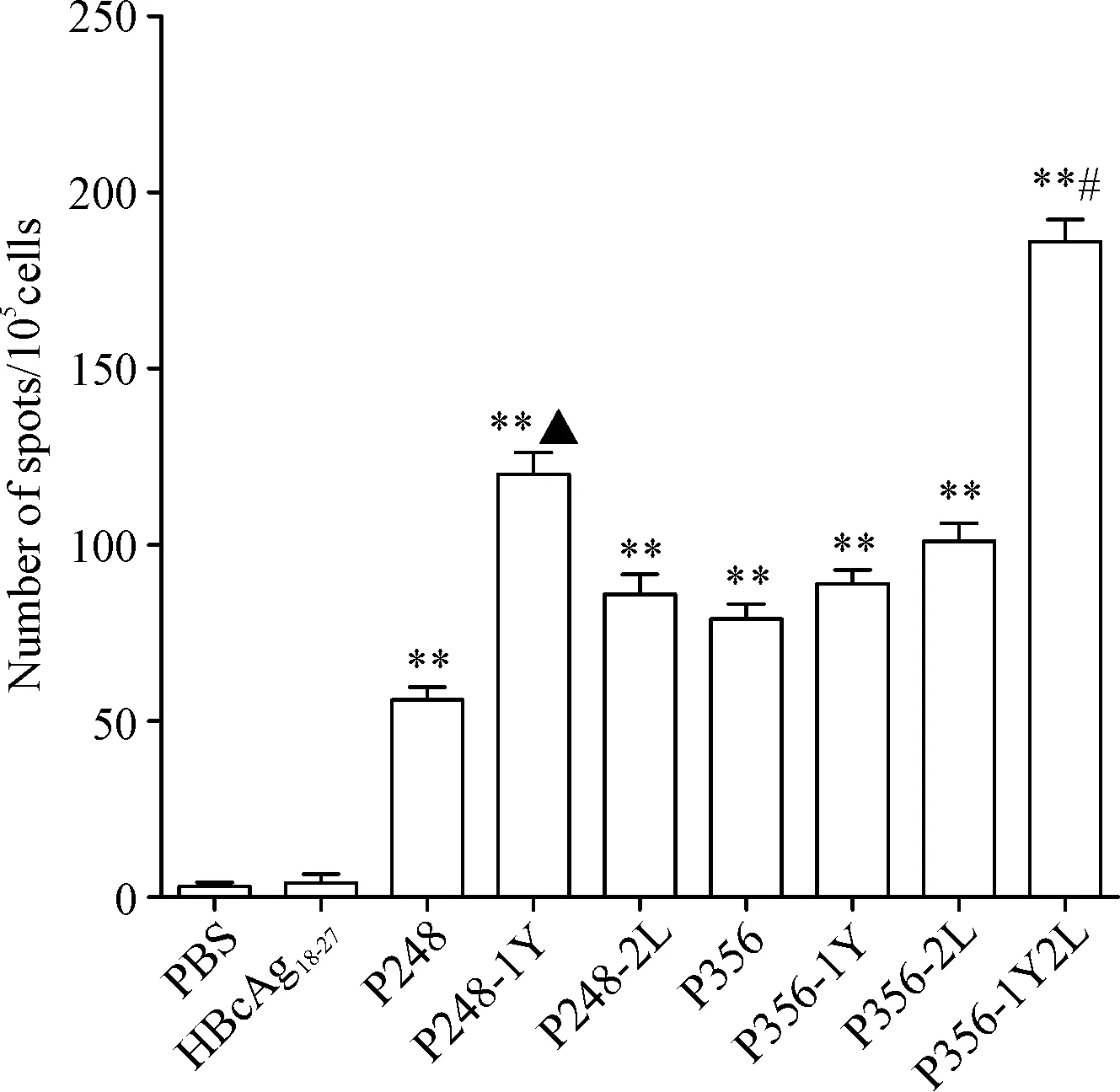
Figure 1. ELISPOT assay was conducted to measure IFN-γ release by CTLs induced from the PBMCs of healthy donors. CTLs induced by PBS and irrelevant peptide HBcAg18-27were taken as negative controls. Mean±SD.n=3.**P<0.01vsPBS group;▲P<0.05vsP248 group;#P<0.05vsP356 group.
图1ELISPOT法检测MAGEC2候选表位肽诱导特异性CTL分泌IFN-γ的能力
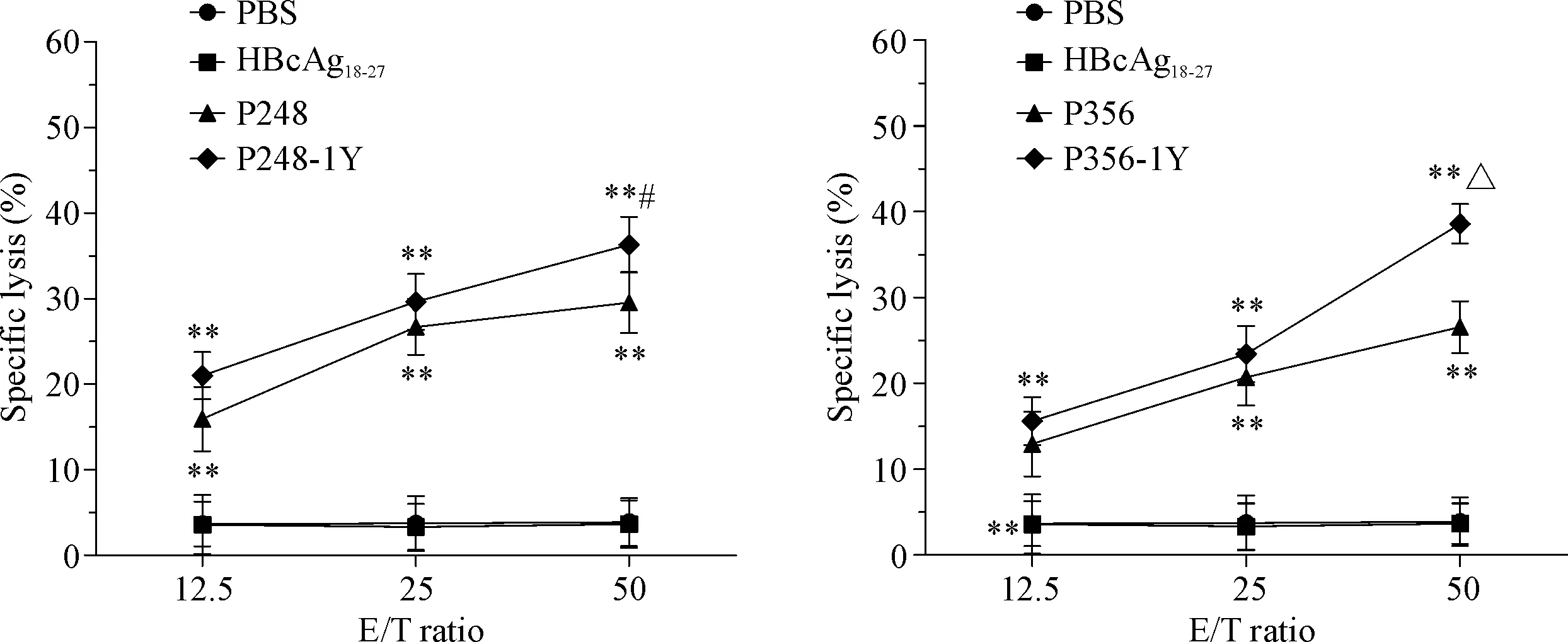
Figure 2. Specific lysis of HepG2 cells by the CTLs generated from the PBMCs of healthy donor. CTLs were induced by MAGEC2-derived peptides and their analogues. Mean±SD.n=3.**P<0.01vsPBS group;#P<0.05vsP248 group;△P<0.05vsP356 group.
图2P248和P356候选肽及其类似物诱导得到的CTL在不同效靶比时对靶细胞HepG2的杀伤情况
5 胞内因子染色法检测T细胞释放IFN-γ水平
使用胞内因子染色法检测多肽体外免疫刺激后IFN-γ分泌水平。以空载T2细胞和荷肽T2细胞作为靶细胞,流式细胞术结果进一步证实,P248、P248-1Y、 P356和P356-1Y2L候选肽可诱导产生特异性的CD8+T细胞。P248、P248-1Y、P356和P356-1Y2L均能诱导特异性T细胞分泌较多的IFN-γ。P248-1Y和P356-1Y2L诱导特异性T细胞免疫分泌的IFN-γ略高于原肽,见图3。
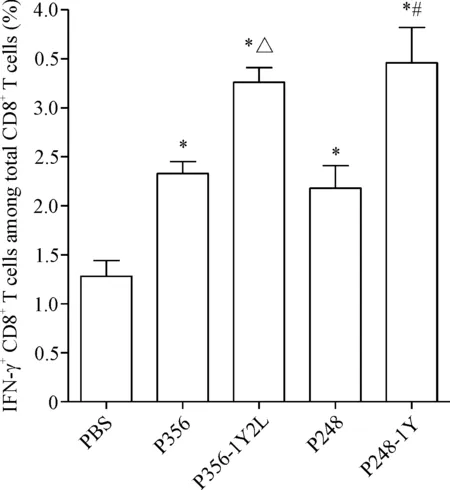
Figure 3. Specific CD8+T-cell responses to MAGEC2-derived peptides in PBMCs of healthy donor. Peptide-stimulated CD8+T cells from PBMC samples were examined for IFN-γ production in co-culture with T2 cells loa-ded with each of the peptides. Mean±SD.n=3.*P<0.05,vsPBS group;#P<0.05vsP248 group;△P<0.05vsP356 group.
图3胞内因子染色法检测候选表位肽体内诱导CTL分泌IFN-γ的能力
讨 论
肿瘤疫苗已经探索了一个多世纪,疫苗对于传染病的巨大影响相比,它们提供了更多的希望。肿瘤疫苗主要集中在疾病治疗上,这是一个更高的治疗方案,现有的研究对于癌症在免疫系统上的能力几乎不了解[13]。针对肿瘤疫苗的另外的挑战是患者的免疫系统受到损伤,抑制或衰老,不仅是因为肿瘤的负担造成的,而是标准治疗疗法和有害的经验。新形式下,免疫效应机制知识的快速增长以及免疫抑制分子信号正在发展[14]。除此之外,存在新的基因编辑工具和对癌症患者免疫力的关键炎症和免疫分子的相关研究。这些研究的快速增长带给癌症疫苗新的希望[15]。
肽的肿瘤疫苗是通过接种特定肿瘤相关抗原(tumor-associated antigen,TAA)的肿瘤特异性肽来诱导肿瘤特异性T细胞反应。目前已经开发出了激活或改善免疫系统来对抗肿瘤的方法[16]。肿瘤免疫疗法是非常有前景的治疗方法,该疗法能激发免疫系统摧毁癌细胞,还可以选择性接种针对TAA的合成肽、来源于TAA重组蛋白、病毒载体编码重组TAA、TAA树突状细胞或DNA/RNA编码的TAA。TAA相关肽的内源性肿瘤特异性T细胞反应是一个有前景的癌症治疗,原因是其易于使用,而且在许多临床试验显示低毒性[17]。
MAGEC2在肿瘤组织和正常组织之间的差异表达,以及MAGEC2突出的免疫原性使其有希望成为肿瘤免疫治疗的的靶标。为了探索其治疗潜力,鉴定该抗原中包含的优势CD8+T细胞表位是至关重要的。在本研究中,我们采用“反向免疫学”的方法筛选能够诱导CTL反应的新MAGEC2 HLA-A2限制性表位,并对其进行表位锚定位点的改造。通过修饰MHC抗原结合槽中保守氨基酸分子可以改变这些多肽与MHC分子的亲和力,结果是可以得到体内诱导更为强烈的多克隆CTL应答的所谓异变性多肽[18-19]。该多肽能识别野生型表位,排斥新植入的肿瘤以及原有肿瘤,这一概念在转移性黑色素瘤患者中使用黑色素瘤相关抗原gp100来源的免疫优势表位的实验中得到证实[20]。gp100多肽在修饰后体内免疫原性得到增强,这一点在更大规模的临床试验中得到证实,转移性黑色素瘤患者阳性反应的比例增加到75%以上,多于90%的患者手术切除Ⅰ到Ⅲ期。在体外,修饰肽诱导的CTL与天然肽诱导的CTL相比,对抗原的识别能力更强[21]。
在本次研究中,野生肽及其类似物的免疫原性已在体外实验中展示,结果显示野生肽以及类似物均能有效诱导MAGEC2+、HLA-A2+限制性CTL,能够识别和裂解自然递呈野生型MAGEC2表位的靶细胞。近年来,肿瘤免疫疗法领域取得了显著进展[22-24]。然而,为了实现癌症疫苗的进一步发展,仍然有许多等待我们解决的问题。虽然这次研究鉴定出新的MAGEC2表位在体外表现出显著的免疫原性潜能,但其在体内抗肿瘤免疫诱导中的效力仍有待确定。需要HLA转基因小鼠模型以及HLA分子转染的小鼠肿瘤细胞系来鉴定MAGEC2表位体内抗肿瘤效果。这是我们接下来进一步要研究的内容。
[参考文献]
[1] Wang Y, Han KJ, Pang XW, et al. Large scale identification of human hepatocellular carcinoma-associated antigens by autoantibodies[J]. J Immunol, 2002, 169(2):1102-1109.
[2] Xiao YF, Jie MM, Li BS, et al. Peptide-based treatment: a promising cancer therapy[J]. J Immunol Res, 2015, 2015:761820.
[3] 王万祥, 冷希圣, 彭吉润, 等. 肝细胞癌抗原基因在肝细胞癌组织中的表达及临床意义[J]. 中华外科杂志,2003, 41(7):506-508.
[4] 张丽洁, 陈娟娟, 徐翠香,等. 基于HCA587的HLA-A2限制性表位肽的体内免疫原性研究[J]. 免疫学杂志, 2016, 32(1):25-28.
[5] Riener MO, Wild PJ, Soll C, et al. Frequent expression of the novel cancer testis antigen MAGE-C2/CT-10 in he-patocellular carcinoma[J]. Int J Cancer, 2009, 124(2):352-357.
[6] Xing Q, Pang XW, Peng JR, et al. Identification of new cytotoxic T-lymphocyte epitopes from cancer testis antigen HCA587[J]. Biochem Biophys Res Commun, 2008, 372(2):331-335.
[7] Li B, Wang Y, Chen J, et al. Identification of a new HLA-A*0201-restricted CD8+T cell epitope from hepatocellular carcinoma-associated antigen HCA587[J]. Clin Exp Immunol, 2005, 140(2):310-319.
[8] Schneble E, Clifton GT, Hale DF, et al. Peptide-based cancer vaccine strategies and clinical results[J]. Methods Mol Biol, 2016, 1403:797-817.
[9] Kumai T, Kobayashi H, Harabuchi Y, et al. Peptide vaccines in cancer-old concept revisited[J]. Curr Opin Immunol, 2017, 45:1-7.
[10] Harao M, Mittendorf EA, Radvanyi LG. Peptide-based vaccination and induction of CD8+T-cell responses against tumor antigens in breast cancer[J]. BioDrugs, 2015, 29(1):15-30.
[11] Wu YH, Gao YF, He YJ, et al. A novel cytotoxic T lymphocyte epitope analogue with enhanced activity derived from cyclooxygenase-2[J]. Scand J Immunol, 2012, 76(3):278-285.
[12] Liu W, Zhai M, Wu Z, et al. Identification of a novel HLA-A2-restricted cytotoxic T lymphocyte epitope from cancer-testis antigen PLAC1 in breast cancer[J]. Amino Acids, 2012, 42(6):2257-2265.
[13] Vigneron N. Human tumor antigens and cancer immunotherapy[J]. Biomed Res Int, 2015, 2015:948501.
[14] Sakamoto S, Noguchi M, Yamada A, et al. Prospect and progress of personalized peptide vaccinations for advanced cancers[J]. Expert Opin Biol Ther, 2016, 16(5):689-698.
[15] Jones LH. Recent advances in the molecular design of synthetic vaccines[J]. Nat Chem, 2015, 7(12):952-960.
[16] Desrichard A, Snyder A, Chan TA. Cancer neoantigens and applications for immunotherapy[J]. Clin Cancer Res, 2016, 22(4):807-812.
[17] Wu D, Gao Y, Qi Y, et al. Peptide-based cancer therapy: opportunity and challenge[J]. Cancer Lett, 2014, 351(1):13-22.
[18] Creticos PS. Allergen immunotherapy: vaccine modification[J]. Immunol Allergy Clin North Am, 2016, 36(1):103-124.
[19] Cherryholmes GA, Stanton SE, Disis ML. Current me-thods of epitope identification for cancer vaccine design[J]. Vaccine, 2015, 33(51):7408-7414.
[20] Minor DR. gp100 peptide vaccine in melanoma[J]. N Engl J Med, 2011, 365(8):771.
[21] Baba T, Sato-Matsushita M, Kanamoto A, et al. Phase I clinical trial of the vaccination for the patients with metastatic melanoma using gp100-derived epitope peptide restricted to HLA-A*2402[J]. J Transl Med, 2010, 8:84.
[22] 时冉冉, 李伯和, 袁 磊, 等. 肿瘤抗原PIWIL2的HLA-A2限制性CTL表位鉴定[J]. 中国病理生理杂志, 2015, 31(7):1315-1319.
[23] 范柳笛, 刘 辉, 袁 磊, 等. 胰腺癌高表达抗原MUC4 CTL表位肽的筛选与改造[J]. 中国病理生理杂志, 2017, 33(5):811-816.
[24] 杜 玲, 孙 俊, 刘建生, 等. TIMP-1 B细胞表位的预测和鉴定[J]. 中国病理生理杂志, 2012, 28(10):1917-1920.

