克拉屈滨对人脐静脉内皮细胞活力和代谢的影响*
陈丽璇, 张 红, 王小华, 段锋祺, 周 兆, 刘革修△
(1广州中医药大学, 广东 广州 510405; 2浙江省台州医院康复科, 3临海市第一人民医院普内科, 浙江 临海 317000; 4南方医科大学, 广东 广州 510515; 5暨南大学基础医学院血液研究所, 广东 广州 510632)
克拉屈滨(cladribine; 2-氯-2’-脱氧腺苷,2-chloro-2’-deoxyadenosine,2-CdA)是临床上重要的抗肿瘤药物,主要用于治疗多发性硬化症、多发性骨髓瘤、B细胞淋巴瘤和急性粒细胞性白血病等[1]。目前,由于克拉屈滨上市时间短,关于克拉屈滨的临床应用报道较少,药物疗效也有争议。克拉屈滨的抗肿瘤作用与脱氧胞苷激酶和脱氧核苷酸激酶活性有关,其主要以被动转运的方式运输到细胞内,被脱氧胞苷激酶磷酸化,转化为克拉屈滨三磷酸,掺合到DNA分子中,阻碍DNA的修复,影响DNA的合成[2]。在本研究中,我们观察克拉屈滨对内皮细胞EA.hy926的作用,探究克拉屈滨在血管生成和调控肿瘤微环境的作用基础上发挥的抗肿瘤效应,进一步讨论其治疗其它实体瘤的可能性,为临床应用提供实验依据。
材 料 和 方 法
1 材料与试剂
克拉屈滨为广州军区广州总医院血液科惠赠;DMEM/high glucose培养基购于Gibco;胎牛血清、0.25%胰酶、青霉素和链霉素购于Sigma-Aldrich;CCK-8试剂盒购于日本同仁公司;细胞凋亡检测试剂盒(Annexin V-FITC/PI 双染)和细胞周期试剂盒(PI单染)购于Sigma-Aldrich;兔抗人caspase-3、Bax、p21和p53抗体购于CST;RIPA细胞裂解液购自上海碧云天生物技术有限公司;ECL化学发光试剂盒购于Thermo;TNF-α、TGF-β1和VEGF酶联免疫吸附试剂盒购于武汉华美;NO检测试剂盒购自南京建成生物工程研究所。96孔细胞培养板、6孔细胞培养板和25 cm2细胞培养瓶购于Beaver。
2 细胞
人脐静脉血管内皮细胞株EA.hy926购于中国科学院细胞生物学研究所北京细胞库。用DMEM/high glucose培养液(含10%胎牛血清和1%双抗)培养EA.hy926细胞,置于37 ℃、5% CO2培养箱中培养,每 24~48 h 传代 1 次。取对数生长期细胞进行实验。
3 主要方法
3.1细胞活力抑制实验 制备细胞悬液,细胞计数,取8×104个细胞接种于96孔板,每孔5×103个。分为4个组,每组设4个复孔;各组对应加入克拉屈滨,使孔中终浓度分别为0、0.4、0.8和1 μmol/L。于37 ℃、5% CO2培养箱中继续培养48 h后,吸弃旧的培养液,每孔加入100 μL新鲜培养液和8 μL CCK-8试剂,混匀后继续孵育3 h。在酶标仪上测定 450 nm 波长处的各孔吸光度(A)值。按照同样的方法,分别检测各组细胞经克拉屈滨作用24 h和72 h的细胞活力情况。根据该部分实验结果及对照组细胞在48 h时融合率达70%~80%,所以后续实验采用48 h的作用时间。
3.2流式细胞术检测细胞周期分布 将细胞接种于T25细胞培养瓶中,分为4组。取克拉屈滨加入细胞培养瓶中,使培养瓶中药物终浓度分别为0、0.4、0.8和1 μmol/L。克拉屈滨作用48 h后,消化离心收集细胞,以PBS清洗细胞1遍,每组细胞沉淀加入500 μL 70%冷乙醇4 ℃固定过夜。次日离心收集细胞并用PBS洗1遍,用200 μL RNase酶重悬细胞,置于37 ℃、 5% CO2培养箱中孵育30 min。随后加入PI 100 μL,轻轻混匀,室温避光反应30 min;然后上机检测。
3.3流式细胞术检测细胞凋亡 将细胞接种于T25细胞培养瓶中,分为4组。取克拉屈滨加入细胞培养瓶中,使培养瓶中药物终浓度分别为0、0.4、0.8和1 μmol/L。克拉屈滨作用内皮细胞48 h后,按照Annexin-V FITC/PI 双染细胞凋亡试剂盒说明进行操作。简述如下:消化并离心收集细胞,以PBS清洗细胞1遍,细胞沉淀加入200 μL结合缓冲液,混匀后加入5 μL的Annexin V-FITC和5 μL的PI,混匀后室温下避光反应15 min;最后上机检测。
3.4Western blot 检测目的蛋白的表达水平 收集不同浓度克拉屈滨处理48 h后的细胞,按照蛋白抽提试剂盒上的说明提取细胞总蛋白; BCA法测定蛋白浓度后,取40 μg变性后蛋白样品上样、12% SDS-PAGE,待溴酚蓝达到凝胶底部时,将蛋白转移至硝酸纤维素膜上;5%脱脂奶粉液室温封闭1 h后,TBST洗3次,每次5 min,I 抗4 ℃ 孵育过夜;TBST洗3次,每次5 min,II 抗中室温摇床孵育1 h ,TBST洗3次,每次5 min,ECL发光,凝胶成像仪中显影,采用Gel-Pro Analyzer 6.0进行蛋白条带灰度分析。
3.5ELISA检测上清液中TNF-α、TGF-β1和VEGF的含量 收集不同浓度克拉屈滨处理48 h后的细胞培养上清液。按照ELISA试剂盒上的说明,检测上清液中TNF-α、TGF-β1和VEGF的水平。
3.6Gries法检测上清液中NO的含量 收集1 μmol/L克拉屈滨处理48 h后的细胞培养上清液。按照试剂盒上的说明,检测上清液NO含量。
4 统计学处理
用Stata 13.0统计软件进行数据分析,GraphPad Prism 7.00 进行统计绘图。本研究的所有实验均重复 3 次,数据以均数±标准差(mean±SD)表示。两组间的比较采用t检验;多组间比较采用单因素方差分析;组间两两比较采用Bonferroni 法。以P<0.05为差异有统计学意义。
结 果
1 克拉屈滨对内皮细胞EA.hy926活力的抑制作用
克拉屈滨作用48 h后,随着药物浓度的增加,细胞活力下降,呈现良好量效关系,除了0.4 μmol/L组外,其余组与对照组相比有明显抑制作用(P<0.05),IC50约为3.644 μmol/L。此外,随着作用时间的延长,细胞活力降低;除24 h组外,其余组与对照组相比均有显著的抑制作用(P<0.05),见图1。这提示克拉屈滨对内皮细胞的生长有抑制作用。
2 不同浓度克拉屈滨对EA.hy926细胞周期的影响
克拉屈滨作用48 h后,与对照组相比,随着药物浓度增加,G0/G1期的细胞显著减少(P<0.05),S期的细胞显著增加(P<0.05),G2期的细胞变化不明显。这提示克拉屈滨能将内皮细胞周期阻滞在S期,见图2、表1。
3 不同浓度克拉屈滨对EA.hy926细胞凋亡率的影响
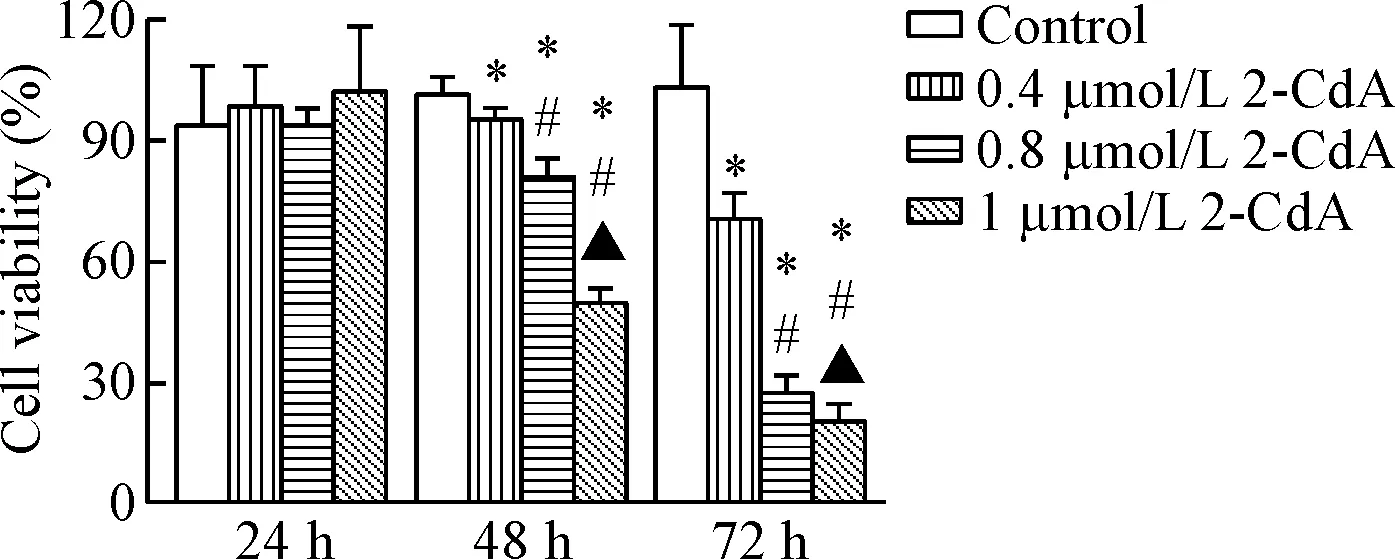
Figure 1. Cladribine (2-CdA) inhibited the viability of the EA.hy926 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vs0.4 μmol/L 2-CdA group;▲P<0.05vs0.8 μmol/L 2-CdA group.
图1克拉屈滨对EA.hy926细胞活力的影响
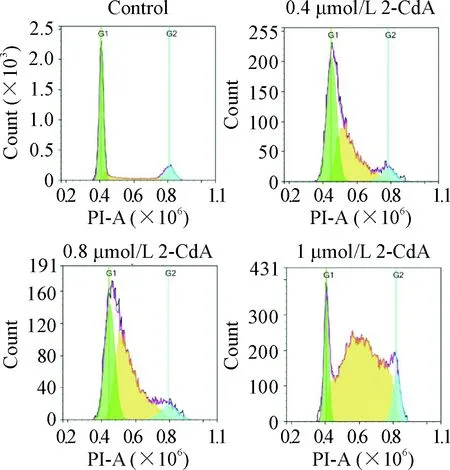
Figure 2. Cladribine ( 2-CdA) induced cell cycle arrest of the EA.hy926 cells.
图2克拉屈滨作用于EA.hy926细胞对细胞周期的影响
克拉屈滨作用48 h后,与对照组相比,各组细胞凋亡率的差异没有统计学显著性,见表1。这提示0.4~1 μmol/L浓度范围的克拉屈滨作用48 h并不诱导内皮细胞凋亡。
表1不同浓度克拉屈滨对EA.hy926细胞细胞周期和凋亡的影响
Table 1. The effects of cladribine ( 2-CdA) at different concentrations on the cell cycle distribution and apoptosis of the EA.hy926 cells for 48 h (%. Mean±SD.n=3)
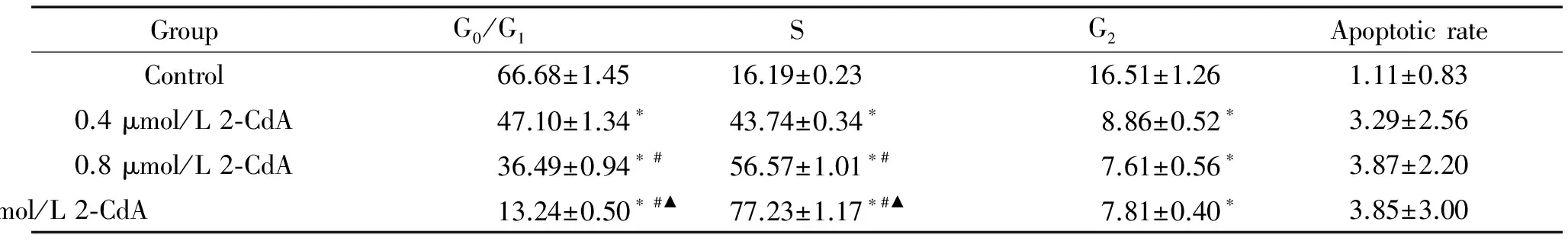
GroupG0/G1SG2ApoptoticrateControl66.68±1.4516.19±0.2316.51±1.261.11±0.830.4μmol/L2⁃CdA47.10±1.34∗43.74±0.34∗8.86±0.52∗3.29±2.560.8μmol/L2⁃CdA36.49±0.94∗#56.57±1.01∗#7.61±0.56∗3.87±2.201μmol/L2⁃CdA13.24±0.50∗#▲77.23±1.17∗#▲7.81±0.40∗3.85±3.00
*P<0.05vscontrol group;#P<0.05vs0.4 μmol/L 2-CdA group;▲P<0.05vs0.8 μmol/L 2-CdA group.
4 不同浓度克拉屈滨对内皮细胞EA.hy926蛋白表达水平的影响
克拉屈滨作用48 h后,caspase-3和Bax表达水平无明显差异;p21表达水平随着浓度增加而减少,p53蛋白表达水平随着药物浓度增加而增加;与对照组相比,有统计学差异(P<0.05),见图3。这些结果提示克拉屈滨抑制p21蛋白的表达,促进p53蛋白的表达;对caspase-3和Bax的表达无显著影响。
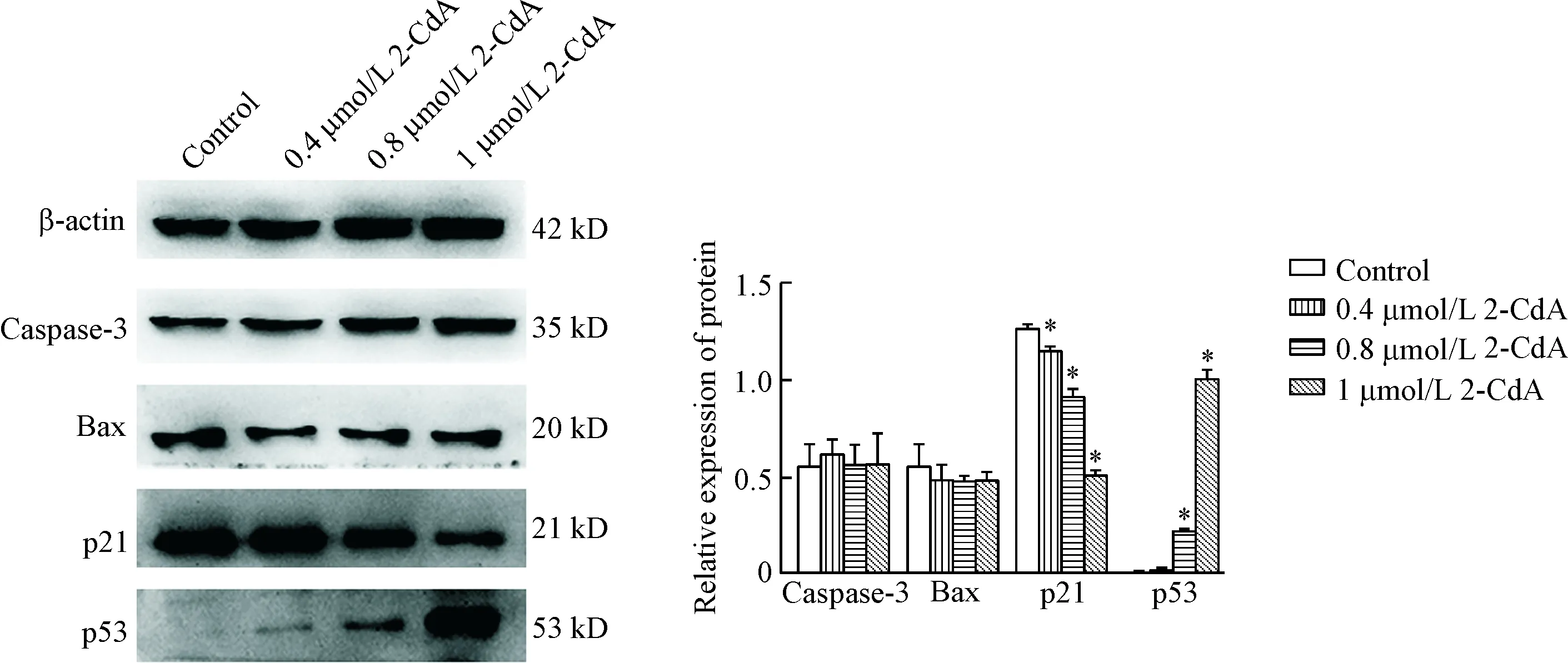
Figure 3. The expression of caspase-3, Bax, p21 and p53 in the EA.hy926 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3克拉屈滨对EA.hy926细胞caspase-3、Bax、p21和p53蛋白表达的影响
5 不同浓度克拉屈滨对内皮细胞EA.hy926分泌TNF-α、TGF-β1和VEGF水平的影响
克拉屈滨作用48 h 后,上清液中TNF-α含量随药物浓度的升高而逐渐增加,且各组TNF-α的含量具有统计学差异(P<0.05);上清液中TGF-β1的含量随着浓度升高而逐渐增加,除了0.4 μmol/L组,其它各组与对照组相比,TGF-β1的含量均显著增加(P<0.05);此外,与对照组相比,克拉屈滨(1 μmol/L)作用48 h,上清液中VEGF含量明显减少(P<0.05),见图4。这些结果提示克拉屈滨能促进内皮细胞分泌TNF-α和TGF-β1,但抑制其分泌VEGF。
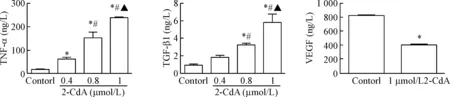
Figure 4. The effect of different concentrations of cladribine (2-CdA) on the production of TNF-α, TGF-β1 and VEGF in the EA.hy926 cells for 48 h. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vs0.4 μmol/L 2-CdA group;▲P<0.05vs0.8 μmol/L 2-CdA group.
图4克拉屈滨对EA.hy926细胞TNF-α、TGF-β1和VEGF水平的影响
6 不同浓度克拉屈滨对细胞EA.hy926培养上清NO水平的影响
与对照组相比,克拉屈滨(1 μmol/L)作用内皮细胞48 h后,上清液中NO含量明显减少(P<0.05)。这提示克拉屈滨可抑制NO的生成,见图5。
讨 论
血管内皮细胞是抗肿瘤血管生成的重要靶细胞,是肿瘤血管的基础单位。因此抑制血管内皮细胞的增殖,可以发挥抗肿瘤血管生成的作用[3-4]。本研究探讨克拉屈滨对内皮细胞活力的抑制作用和对细胞分泌活性的影响,进而探究其治疗实体瘤的可能性。
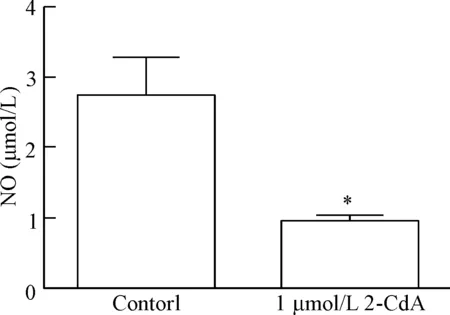
Figure 5. The effect of cladribine (2-CdA) on NO production in the EA.hy926 cells for 48 h. Mean±SD.n=3.*P<0.05vscontrol group.
图5克拉屈滨对EA.hy926细胞NO水平的影响
克拉屈滨抑制内皮细胞的活力。本研究通过CCK-8法检测不同浓度克拉屈滨作用于内皮细胞后的细胞活力,发现随着药物浓度增加和作用时间延长,克拉屈滨对内皮细胞活力抑制率显著增高。
克拉屈滨对内皮细胞的凋亡没有显著的影响。本研究通过流式细胞术检测各组细胞凋亡率,各组细胞凋亡率与对照组相比没有统计学差异。凋亡相关蛋白检测结果,caspase-3、Bax各组无明显差异。Caspase-3是caspase家族蛋白酶的重要部分,是凋亡途径的关键因子。细胞线粒体膜电位的下降,使细胞色素C释放,启动caspase介导凋亡级联反应[5]。Bax过度表达可拮抗Bcl的保护效应而介导细胞凋亡[6]。这些结果说明克拉屈滨并不是通过诱导内皮细胞的凋亡而发挥其抗肿瘤作用。
克拉屈滨诱导内皮细胞的细胞周期阻滞。本研究通过流式细胞术检测细胞周期,显示克拉屈滨作用后,G1期细胞减少,S期细胞增多,G2期无明显变化。为了深入了解克拉屈滨对细胞周期的作用,本研究检测了相关蛋白表达水平。结果显示p21蛋白表达减少,p53蛋白表达增加。p21是细胞周期素依赖性激酶抑制因子,是细胞周期G1期检查站[7]。通过p21与p53的检查,减少损伤的DNA的合成。p21表达减少,使其对G1期的检查作用减弱,更多的细胞进入S期,细胞周期阻滞在S期。p53位于p21的上游,其主要功能是抑制p21、cyclin、CDK和PCNA四聚体的功能,此四聚体能活化细胞增殖信号。p53表达增强,四聚体功能被抑制,细胞增殖信号未能活化[7]。p53蛋白表达水平随着药物浓度增加而增加,这与CCK-8检测结果一致。克拉屈滨被动转运到细胞内,转化为克拉屈滨三磷酸,掺合到DNA分子中,阻碍DNA的修复,影响DNA的合成,进而细胞阻滞于S期,不能进入G2/M期。这些结果说明克拉屈滨可诱导内皮细胞的细胞周期阻滞,从而发挥其抗肿瘤作用。
克拉屈滨促进内皮细胞分泌TNF-α和TGF-β1。ELISA结果显示上清液TNF-α和TGF-β1水平增高。血管内皮细胞是TNF-α作用的靶细胞之一,TNF-α诱导血管内皮细胞外钙内流,血管内皮细胞渗透性增加,导致内皮细胞损伤或导致血管功能紊乱,使血管损伤和血栓形成,造成肿瘤组织的局部血流阻断而发生出血、缺氧坏死,是重要的肿瘤坏死因子[8-9]。且TNF-α能抑制内皮细胞增长,使细胞分裂缓慢。TGF-β1能够抑制多种细胞增殖。克拉屈滨作用内皮细胞后,TGF-β1分泌增加,通过自分泌的方式作用于自身可导致细胞增殖减慢。TGF-β1对肿瘤有促进和抑制双重作用,其抑制肿瘤的能力与TGF-β1信号促进上皮-间充质转化(epithelial-mesenchymal transition,EMT)相关[10-11]。这些结果说明克拉屈滨可通过促进TNF-α的分泌,发挥抗肿瘤作用。
克拉屈滨抑制内皮细胞分泌VEGF。ELISA结果显示VEGF分泌减少。VEGF是血管内皮细胞特异性有丝裂原,是重要的血管生成因子,促进血管新生和肿瘤细胞增殖[12]。VEGF能够诱导抗凋亡蛋白Bcl-2的表达,抑制肿瘤细胞的凋亡和增强肿瘤细胞对放疗的耐受性[13]。有研究发现p53与VEGF之间有明显相关性,p53参与下调VEGF mRNA水平和启动子的活性[14-15]。VEGF含量减少与本研究中p53蛋白表达增加相一致。这些结果提示克拉屈滨使内皮细胞减少VEGF的分泌,在抑制VEGF促肿瘤血管新生的基础上发挥抗肿瘤作用。
克拉屈滨抑制NO的分泌。通过Gries法检测结果显示NO含量减少。NO含量持续增多,引起不稳定活性氧的生成,导致细胞损伤,舒张血管[16-17]。NO在维持肿瘤血管扩张状态起重要作用。其舒张血管的机制与细胞中鸟苷酸环化酶的活性提高, 使细胞内环磷酸鸟苷水平升高有关[18-19]。此外,许多研究发现NO有促进肿瘤血管生成和促进肿瘤生长转移的作用[20-21]。其促进肿瘤血管生成的主要机制与其介导VEGF的信号传递有关。NO能诱导VEGF的合成,而VEGF能上调一氧化氮合酶的表达,增加NO 合成[22-24]。这说明克拉屈滨抑制NO的分泌,引起血管收缩和VEGF生成减少,血管生成受限,肿瘤血液供应受抑制。
综上所述,克拉屈滨促进内皮细胞分泌TNF-α、TGF-β1,减少VEGF与NO的生成,阻滞细胞周期,抑制内皮细胞的生长。根据本研究结果,我们大胆地推测克拉屈滨有抗肿瘤血管生成和调控肿瘤微环境的作用。由于本研究主要涉及的是体外实验,至于其在体内时对肿瘤血管内皮细胞的影响还需要进一步的研究探索。
[参考文献]
[1] 杜雅慧, 王 文, 纪春岩,等. 克拉屈滨的临床应用[J]. 中国处方药, 2013, 11(3):33-35.
[2] Zhou NC, Qi MY, Liu BL, et al. Mechanisms of cladri-bine-inducing apoptosis of multiple myeloma RPMI 8226 cellsinvitro[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2014, 22(6):1644-1648.
[3] Luo H, Li B, Li Z, et al. Chaetoglobosin K inhibits tumor angiogenesis through downregulation of vascular epithelial growth factor-binding hypoxia-inducible factor 1α[J]. Anticancer Drugs, 2013, 24(7):715-724.
[4] 田 超. 基于生物网络调控下丹参抗肿瘤血管生成研究——丹酚酸B通过下调肝癌细胞AT1R蛋白的表达及VEGF的产生抑制肝癌血管生成[D]. 南京: 南京中医药大学, 2014.
[5] 丁黎敏, 黃小民, 张 微, 等. 原花青素通过对Caspase-3和Bcl-xl、Bax蛋白的调节抑制人脐静脉内皮细胞凋亡[J]. 中华中医药学刊, 2013, 31(3):582-584.
[6] 周亚丽, 彭志刚, 张晓梅, 等. 氟达拉滨对多发性骨髓瘤细胞系KM3细胞增殖和代谢的影响[J]. 临床血液学杂志, 2010, 23(2):104-106.
[7] 李向荣, 林星余, 肖忠秀. P21结构功能与研究新进展[J]. 医学综述, 2008, 14(14):2094-2097.
[8] 罗 丽. CGA衍生多肽CHR抑制肿瘤坏死因子-α诱导血管内皮细胞高渗透性的钙相关信号机制探讨[D]. 重庆: 重庆医科大学, 2015.
[9] 金惠铭, 刘清行, 曹 翔, 等. TNF-α引起的微血管内皮细胞功能障碍及其细胞分子机制[J]. 微循环学杂志, 2000, 10(3):5-6.
[10] 贾 军, 张志明, 杨世勇. 转化生长因子TGF-β1与肿瘤[J]. 现代肿瘤医学, 2001, 9(1):60-61.
[11] David CJ, Huang YH, Chen M, et al. TGF-β tumor suppression through a lethal EMT[J]. Cell, 2016, 164(5):1015-1030.
[12] 曹宁川, 杨向红. 肿瘤细胞对体外诱导人内皮细胞血管形成的影响及VEGF的作用[J]. 中国医科大学, 2006, 37(3):405-407.
[13] 刘丽璇, 吴灵飞, 邓 巍, 等. 丹参酮 IIA 对低氧条件下人肝癌 HepG2 细胞增殖、凋亡的影响及与 HIF-1α、VEGF和野生型 P53蛋白表达的关系[J]. 中国病理生理杂志, 2014, 30(12):2155-2160.
[14] Giatromanolaki A, Koukourakis MI, Kakolyris S, et al. Vascular endothelial growth factor, wild-type p53, and angiogenesis in early operable non-small cell lung cancer[J]. Clin Cancer Res, 1998, 4(12):3017-3024.
[15] Jana NR, Dikshit P, Goswami A, et al. Inhibition of proteasomal function by curcumin induces apoptosis through mitochondrial pathway[J]. J Biol Chem, 2004, 279(12):11680-11685.
[16] 任德成, 胡娟娟, 张均田, 等. 内皮细胞损伤机制研究[J]. 医学研究杂志, 2003, 32(10):11-15.
[17] Liao JK. Linking endothelial dysfunction with endothelial cell activation[J]. J Clin Invest, 2013, 123(2):540- 541.
[18] Tozer GM, P rise VE, Chaplin DJ, et al. Inhibition of nitric oxide synthase induces a selective reduction in tumor blood flow that is reversible with L-arginine[J]. Cancer Res, 1997, 57(5):948-955.
[19] Vamvakas S, Schmidt HH. Just say NO to cancer?[J]. J Natl Cancer Inst, 1997, 89(6):406-407.
[20] Gallo O, Masini E, Morbidelli L, et al. Role of nitric oxide in angiogenesis and tumor progression in head and neck cancer[J]. J Natl Cancer Inst, 1998, 90(8):587-596.
[21] Yudoh K, Matsui H, Tsuji H. Nitric oxide induced by tumor cells activates tumor cell adhesion to endothelial cells and permeability of the endotheliuminvitro[J]. Clin Exp Metastasis, 1997, 15(6):557-567.
[22] Chin K, Kurashima Y, Oqura T, et al . Induction of vascular endothelial growth factor by nitric oxide in human glioblastoma and hepatocellular carcinoma cells[J]. Oncogene, 1997, 15(4):437-442.
[23] Dulak J, Jzkowicz A, Dembinska-Kiec A, et al. Nitric oxide induces the synthesis of vascular endothelial growth factor by rat vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol, 2000, 20(3):659-666.
[24] Papetropoulos A, García-Cardea G, Madri JA, et al. Nitric oxide production contributes to the angiogenic proper-ties of vascular endothelial growth factor in human endothelial cells[J]. J Clin Invest, 1997, 100(12): 3131-3139.

