长链非编码RNA MIAT在非小细胞肺癌中的表达及功能研究*
裴 振, 霍小蕾, 田向阳, 张毅强, 贾建桃, 韩玲娜△
(长治医学院 1生理学教研室, 2组织胚胎学教研室, 3附属和平医院, 4生化教研室, 5病理生理学教研室, 山西 长治 046000)
非小细胞肺癌(non-small-cell lung carcinoma,NSCLC)是全球范围内最常见的肺部恶性肿瘤,具有极高的发病率和死亡率,居所有的恶性肿瘤之首[1]。近来年,我国的NSCLC发病率和死亡率均呈上升趋势,其治疗也面临着严峻的挑战[2]。目前,NSCLC的治疗手段仍然是以手术治疗为主。随着治疗技术日臻成熟,尽管治疗方法大大改进,但是NSCLC的预后仍然不佳,患者5年生存率约为15%[3-4]。因此,NSCLC的治疗亟需一种新的治疗靶标,以更好监测其复发和转移等病程。长链非编码RNAs(long non-coding RNAs,lncRNAs)是一类近年来被发现与多种疾病密切相关的RNA分子[5-6],心肌梗死相关转录本(myocardial infarction-associated transcript,MIAT)是lncRNA家族分子的一员[7],在调控神经内分泌前列腺癌[8]、胃癌[9]、肾透明细胞癌[10]、慢性淋巴细胞白血病和胶质母细胞瘤[11]等恶性肿瘤的发生发展中发挥了重要作用,然而MIAT在NSCLC中的研究还鲜有报道。本研究通过研究MIAT在NSCLC中的表达、定位及分子调控方式,初步探究MIAT对非小细胞肺癌生物学行为的作用机制,为非小细胞肺癌的分子治疗提供理论依据。
材 料 和 方 法
1 材料
Lipofectamine 2000 购于Invitrogen;TRIzol试剂和逆转录试剂盒(miScriptⅡRT Kit)购于QIAGEN;逆转录试剂盒(Reverse Transcription System)购于Promega;小干扰RNA(small interfering RNA, siRNA)片段购于广州瑞博生物有限公司;细胞周期与细胞凋亡检测试剂盒(Cell Cycle and Apoptosis Analysis Kit)、CCK-8试剂购于碧云天生物科技公司;细胞浆/核RNA抽提试剂盒(PARISTMKit Protein and RNA Isolation System)购于Ambion;抗细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,CDKN1A)和GAPDH抗体购自上海优宁维生物科技有限公司。
2 方法
2.1一般资料 收集25例长治医学院附属和平医院肿瘤科自2014年12月~2016年1月行手术切除的非小细胞肺癌患者癌组织和癌旁组织(癌周3 cm以上)。患者年龄35~75 岁,平均(55.23±3.45)岁。患者术前均未进行放化疗和生物治疗,未合并其它肿瘤等,并且可收集患者完整检查、治疗和手术资料,以及联系方式等。标本首先置于液氮灌中10 min,然后取出置于-80 ℃保存用于抽提RNA,行qPCR法检测MIAT的表达情况。
Gene Expression Omnibus (GEO)公共数据库中GSE19804和GSE30219数据集在Pubmed GEO DataSets 主页(http://www.ncbi.nlm.nih.gov/gds/)下载获得,这2个数据集的平台来源为GPL570,其基因表达谱芯片分析均采用Affymetrix HumanGenome U133 Plus 2.0 Array,MIAT对应的探针号为237322_at。GSE19804中包含60对人非小细胞肺癌患者癌组织及癌旁组织,GSE30219中包含289例非小细胞肺癌患者临床预后资料。
2.2细胞系 人正常支气管上皮细胞系HBE及人NSCLC细胞系A549、NCI-H266和NCI-NCI-H1299均购于中国科学院上海生命科学研究院细胞资源中心。HBE、A549、NCI-H266和NCI-H1299细胞所用培养液为含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基,细胞保持在37 ℃、5% CO2的潮湿环境中。
2.3细胞转染 首先,将生长状态良好的A549细胞接种于6孔板中(按每孔1.5×105个细胞),然后用阴性对照siRNA(negative control siRNA,si-NC)和si-MIAT(5 μmol/L)进行细胞转染,具体步骤参照LipofectamineTM2000试剂盒说明书。转染48 h后,收集细胞及上清进行相应检测。si-MIAT片段的序列为5’-GGUGUUAAGACUUGGUUUCTT-3’; si-NC片段的产品编号为siN05815122147。
2.4qPCR实验 采用TRIzol法提取各组细胞的总RNA,反转录得到cDNA,进行qPCR检测。MIAT的正向引物为5’-GCTCACACCTCCTATTCCT-3’,反向引物为5’-CTTCACCAACTCTCCCACT-3’; cyclin D1的正向引物为5’-TCGTTGCCCTCTGTGCCACA-3’,反向引物为5’-GCAGTCCGGGTCACACTTGA-3’; CDKN1A的正向引物为5’-TGTCCGTCAGAACCCATGC-3’,反向引物为5’-AAAGTCGAAGTTCCATCGCTC-3’; U6(细胞核的参照物)的正向引物为5’-CTCGCTTCGGCAGCACA-3’,反向引物为5’-AACGCTTCACGAATTTGCGT-3’;18S (细胞质的参照物)的正向引物为5’-GTGGGCCGAAGATATGCTCA-3’,反向引物为5’-TTGGCTAGGACCTGGCTGTA-3’;GAPDH (细胞质的参照物)的正向引物为5’-TGCACCACCAACTGCTTAGC-3’,反向引物为5’-GGCATGGACTGTGGTCATGAG-3’。引物根据GenBank序列,用软件Primer Premier 5.0 和 Oligo 6.22 设计,由华大基因生物科技有限公司合成。PCR反应条件为:95 ℃ 5 min; 95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,重复40个循环。
2.5CCK-8实验检测细胞活力 各组细胞设置5个复孔,进行相应的处理后。各孔加入100 μL混合培养液(90 μL联合培养基+10 μL CCK-8溶液),在37 ℃孵育长达2 h,并使用SpectraMax 190光吸收酶标仪测定450 nm处的吸光度(A)。
2.6集落形成实验 各组细胞按每孔1×103个分别接种于6孔板中,培养约15 d后,肉眼可见克隆时即终止培养。PBS清洗数次,4%多聚甲醛固定30 min,再用1%结晶紫染液染色10 min,晾干,拍照。每组设置3个复孔。
2.7细胞周期分布的分析 收集细胞并用70%的冷乙醇固定,4℃过夜。用碘化丙啶(0.05 g/L)和RNA酶(2 g/L)常温下进行染色30 min,用流式细胞术分析细胞周期,使用Cell Lab Quanta SC软件对处于G0/G1、S和G2/M期细胞在细胞周期的百分比进行评估。
2.8细胞核/质RNA的分离及检测 收集约1×106个A549细胞,用预冷的PBS清洗数次,离心,重悬,再将细胞分成2份(一份抽提总RNA,一份抽提核/质RNA)。总RNA的抽提利用TRIzol法,细胞浆/核RNA的抽提步骤参考胞浆/核RNA抽提试剂盒说明书。将qPCR法测得的细胞核RNA样本中MIAT、U6、GAPDH和18S的表达量减去各自在总RNA样本中的表达量,得到ΔCt,然后计算2-ΔCt,最后进行log10(2-ΔCt)转换即得到最终的表达值[12]。当MIAT表达量大于0 时, 即表示该分子主要分布在细胞核中;反之,当MIAT表达量小于0时,在横坐标下方,即表示该分子主要分布在细胞质中。
2.9Western blot分析 处理细胞后,用 RIPA 裂解液(强)冰上裂解细胞 30 min,20 W超声振荡2 min,在4 ℃条件下,12 000×g离心10 min,收集上清,测蛋白浓度。50 μg待测蛋白进行10% SDS-PAGE分离,电泳条件为积层胶 80 V 40 min、分离胶120 V 90 min,然后在100 V的条件下湿转膜 90 min,室温封闭1 h,I 抗4 ℃孵育过夜(抗cyclin D1和CDKN1A 抗体的稀释比例为1∶500,抗GAPDH 抗体的稀释比例为1∶1 000),洗膜,II 抗37 ℃孵育1 h,洗膜,显影。用Scion Image软件进行条带的灰度分析。
3 统计学处理
所有数据均以均数±标准差(mean±SD)表示;使用SPSS 18.0软件进行统计分析。多组间比较采用单因素方差分析(one-way ANOVA),两组间比较采用Studentt-test。以P<0.05为差异有统计学意义。
结 果
1 GEO 公共数据库分析MIAT在NSCLC组织和正常肺组织中的表达差异
GSE19804数据集分析结果显示,MIAT在NSCLC组织中的表达高于正常肺组织(P<0.05),见图1。GSE30219数据集分析显示,MIAT 高表达患者生存期显著短于低表达患者(P<0.01),见图2。
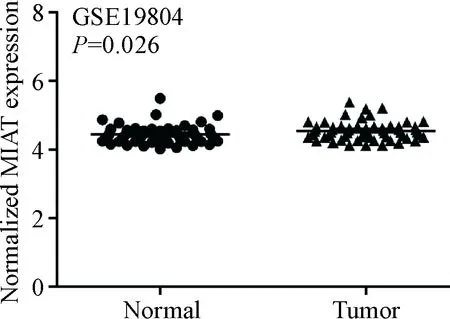
Figure 1. The expression level of MIAT in NSCLC tissues and normal lung tissues analyzed by GEO database. Mean±SD.n=60.
图1GEO公共数据库分析MIAT在NSCLC组织和正常肺组织中的表达
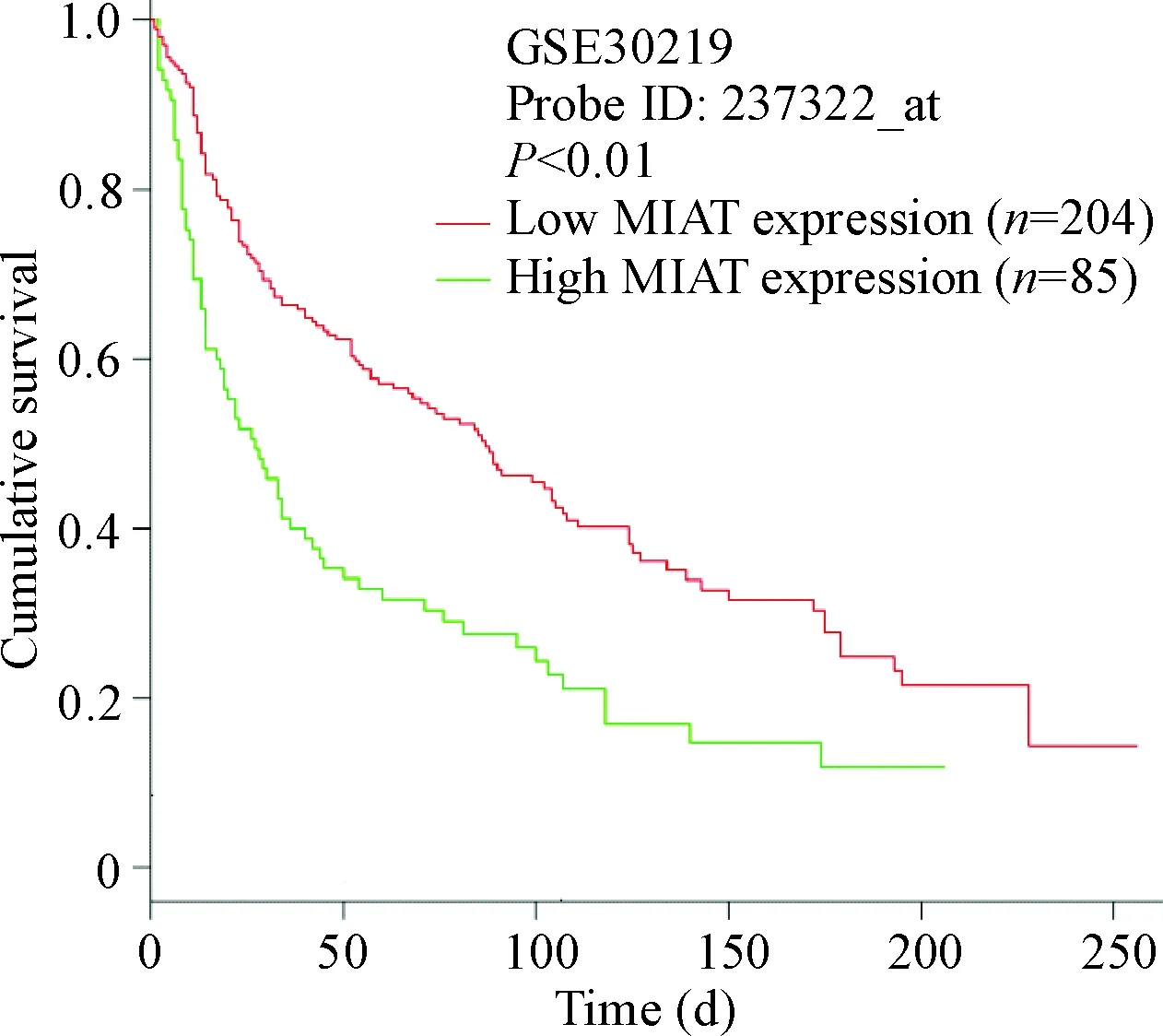
Figure 2. The correlation between the expression level of MIAT and the survival time of NSCLC patients analyzed by GEO database.
图2GEO公共数据库分析MIAT表达水平与NSCLC患者生存期的关系
2 MIAT在NSCLC组织和NSCLC细胞系中的表达及定位
qPCR检测25对人NSCLC组织及其相应的癌旁正常组织,结果显示相对于癌旁正常组织,MIAT在NSCLC组织中呈现高表达(P<0.05),见图3;qPCR检测肺正常支气管上皮细胞系HBE和NSCLC细胞系A549、NCI-H266和NCI-H1299中MIAT的表达情况,结果显示MIAT在NSCLC细胞的表达显著高于正常支气管上皮细胞系HBE(P<0.05),其中,NSCLC细胞系A549中MIAT的表达最高(P<0.01),见图4。此外,用试剂盒抽提分离A549细胞的细胞核RNA和细胞质RNA后,行qPCR检测相应细胞核/质指标,结果显示MIAT主要定位于细胞质中,见图5,提示MIAT可能在细胞质发挥调控某些基因转录后水平或翻译水平的功能。
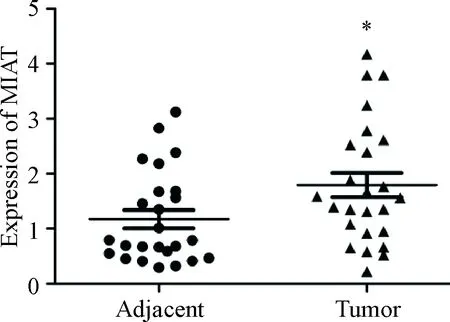
Figure 3. The expression of MIAT in NSCLC cancer tissues and normal lung tissues detected by qPCR. Mean±SD.n=25.*P<0.05vsadjacent.
图3qPCR检测MIAT在NSCLC肿瘤组织及癌旁组织中的表达
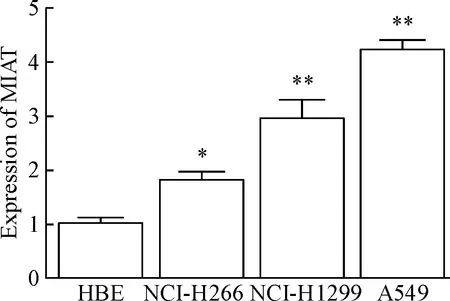
Figure 4. The expression of MIAT in NSCLC cells detected by qPCR. Mean±SD.n=3.*P<0.05,**P<0.01vsHBE.
图4qPCR检测MIAT在NSCLC细胞系中的表达
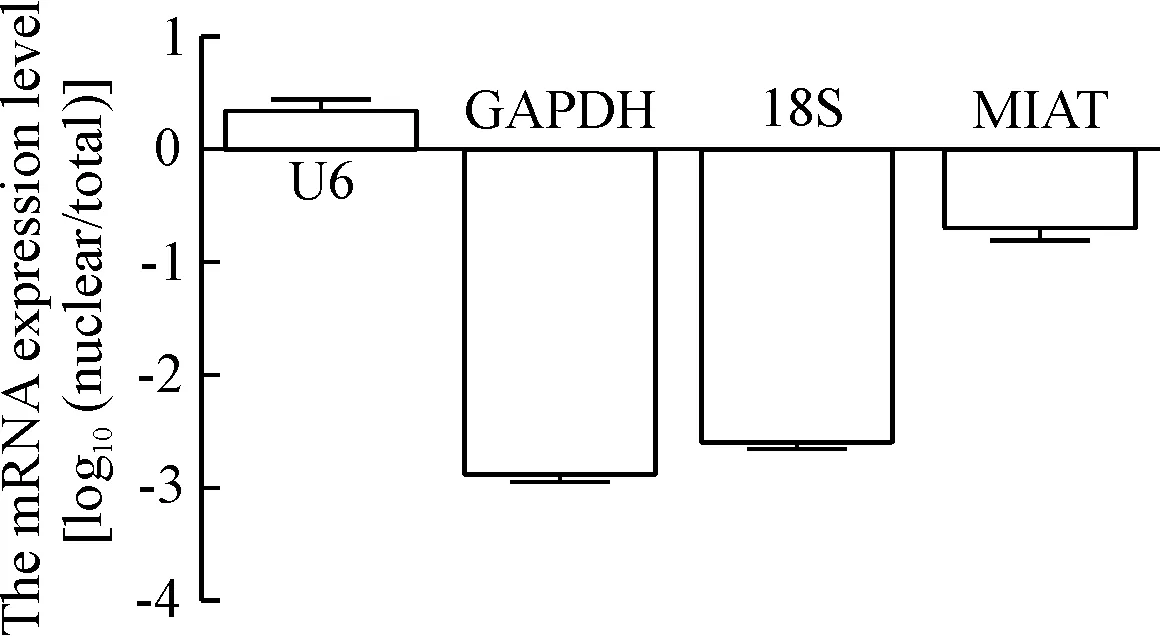
Figure 5. The location of MIAT in NSCLC A549 cells detected by qPCR. Mean±SD.n=3.
图5qPCR检测MIAT在NSCLC细胞系A549中的定位情况
3 验证si-MIAT在A549细胞中的抑制效率
si-MIAT瞬时转染非小细胞肺癌A549细胞48 h后,qPCR检测结果显示,与空白对照(blank control)和转染si-NC的细胞相比,转染si-MIAT的细胞MIAT的表达水平受到抑制(P<0.01),见图6。
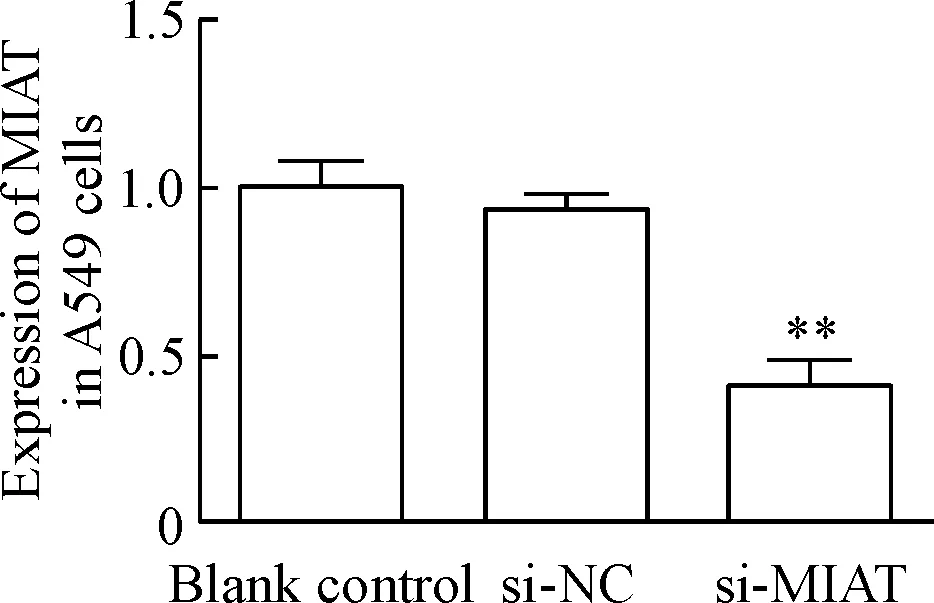
Figure 6. The inhibition efficiency of si-MIAT in NSCLC A549 cells. Mean±SD.n=3.**P<0.01vsblank control group.
图6qPCR检测si-MIAT在NSCLC细胞系A549中的抑制效率
4 沉默MIAT表达对A549细胞活力的影响
si-MIAT瞬时转染非小细胞肺癌A549细胞48 h后,流式细胞术检测结果显示,与si-NC组相比,si-MIAT组处于G0/G1期的细胞比例明显增多(P<0.05),处于S期的细胞比例明显减少(P<0.01),见图7。转染细胞后培养15 d,si-MIAT组细胞相对于si-NC组的集落形成明显受到了抑制,且集落数量明显减少, 差异有统计学意义(P<0.05),见图8。此外,CCK-8实验结果也显示,转染96 h后,si-MIAT组细胞相对于si-NC组的细胞活力明显受到抑制, 差异有统计学意义(P<0.05),见图9。以上结果显示,沉默MIAT表达可抑制非小细胞肺癌A549细胞的生长。
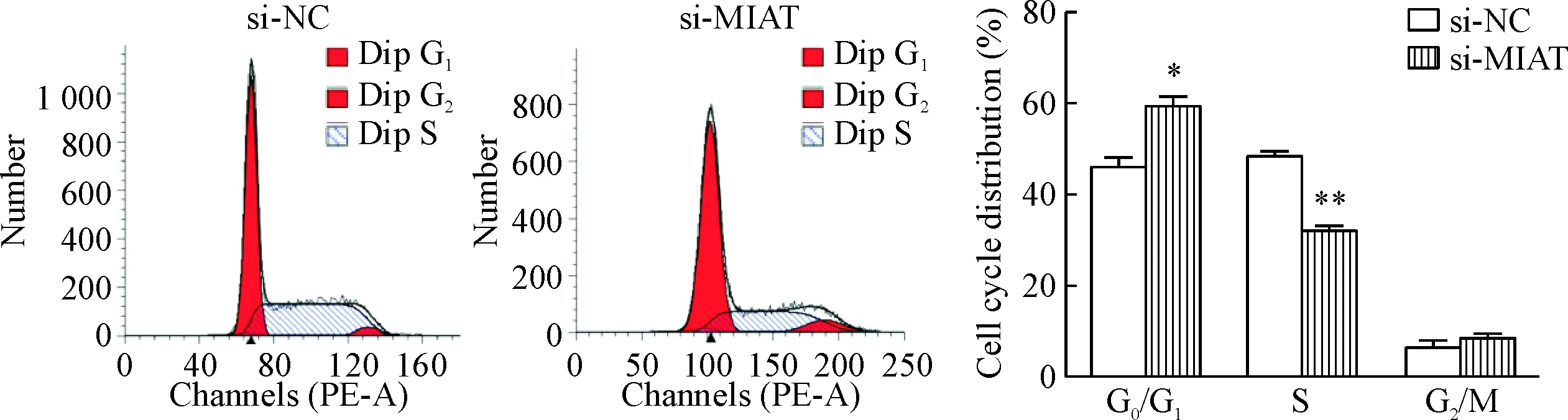
Figure 7. The effect of si-MIAT on cell-cycle distribution of A549 cells detected by flow cytometry. Mean±SD.n=3.*P<0.05,**P<0.01vssi-NC group.
图7流式细胞术检测MIAT对细胞周期分布的影响
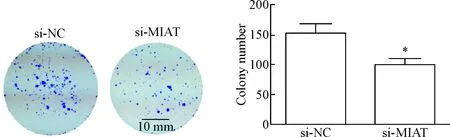
Figure 8. The effect of si-MIAT on colony formation of A549 cells detected by colony formation experiment. Mean±SD.n=3.*P<0.05vssi-NC group.
图8细胞集落形成实验检测si-MIAT对细胞集落形成的影响
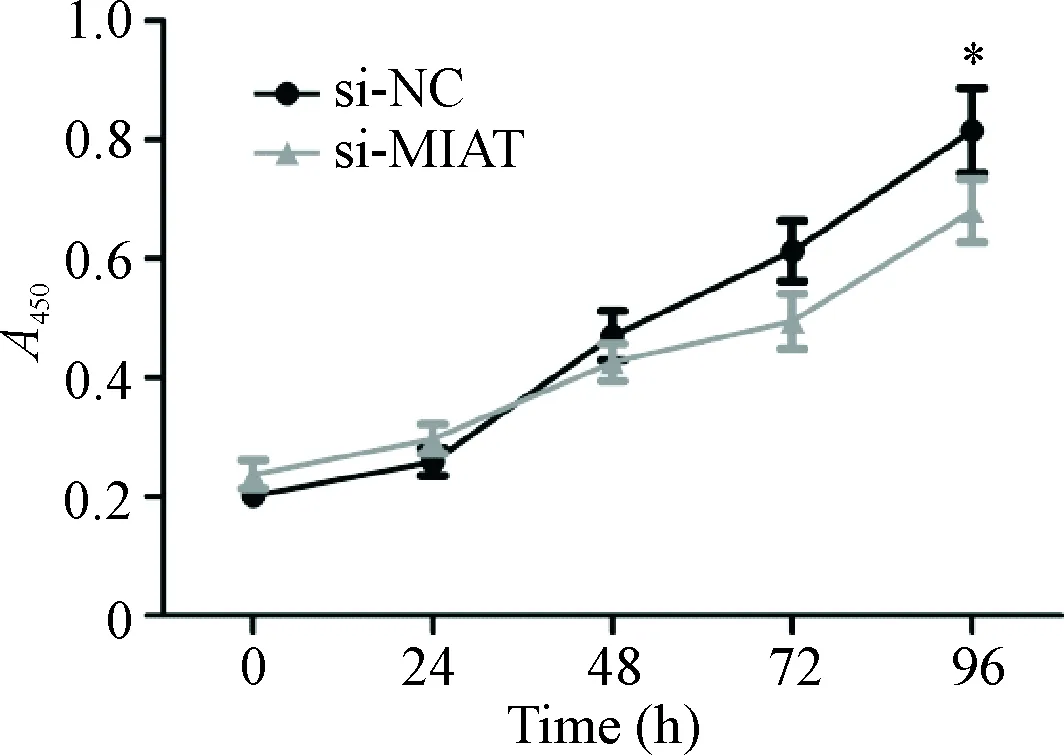
Figure 9. The effect of si-MIAT on the viability of A549 cells detected by CCK-8 assay. Mean±SD.n=5.*P<0.05vssi-NC group.
图9CCK-8实验检测si-MIAT对细胞活力的影响
5 沉默MIAT表达对A549细胞的细胞周期分子表达的影响
si-MIAT瞬时转染非小细胞肺癌A549细胞48 h后收集相应的RNA和蛋白质,qPCR检测结果显示,与si-NC组相比,si-MIAT组细胞中MIAT和cyclin D1的mRNA表达水平均受到了抑制,而CDKN1A的mRNA表达水平升高, 差异有统计学意义(P<0.05),见图10。Western blot法检测结果也同样表明,si-MIAT组相对于si-NC组cyclin D1的蛋白表达量减少,而CDKN1A的蛋白表达量增加,灰度分析显示差异具有统计学意义(P<0.05),见图11。
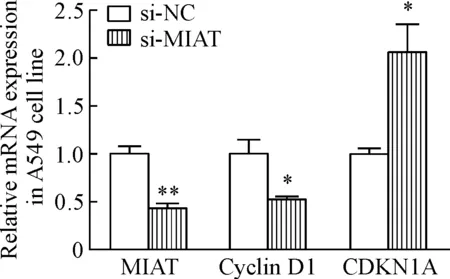
Figure 10. The effect of si-MIAT on cyclin D1 and CDKN1A expression detected by qPCR. Mean±SD.n=3.*P<0.05,**P<0.01vssi-NC group.
图10qPCR检测si-MIAT对细胞周期分子的影响
讨 论
肺癌是世界范围内发病率和死亡率最高的恶性肿瘤,全世界每年约有180万新发病例[13]。肺癌根据病理学形态和临床特征又可分为小细胞肺癌(small-cell lung cancer,SCLC)和NSCLC,其中NSCLC患者约占85%[14]。NSCLC的发病过程涉及多基因、多步骤、多阶段,参与其中的基因及环境影响因素广泛而复杂,因此NSCLC的确切发生机制尚不完全清楚。随着分子生物学技术在疾病的应用逐渐深入,寻找合适、有效的分子标志物和治疗靶点是当前NSCLC治疗的新策略。
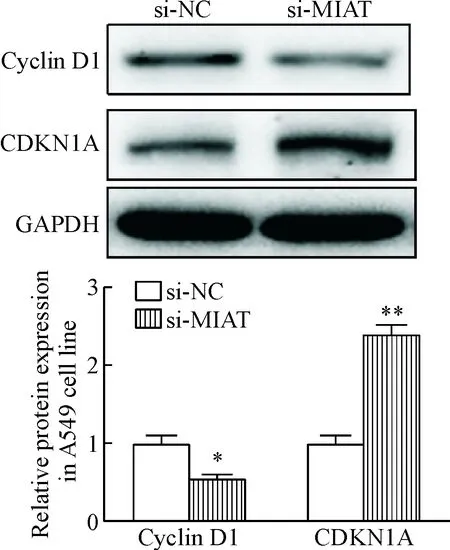
Figure 11. The effect of si-MIAT on cyclin D1 and CDKN1A protein expression detected by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vssi-NC group.
图11Westernblot法检测si-MIAT对细胞周期分子蛋白水平的影响
长链非编码RNAs是在真核生物中发现的一类转录本长度在200~100 000 nt、缺少完整功能性的开放阅读框、仅编码少量功能性短肽的RNA分子[15-17]。lncRNAs可定位于细胞核、细胞质或者特定亚细胞器上,其定位与其行使的功能密切相关[18]。近年来的研究发现,lncRNAs的异常表达或功能缺失也与多种疾病有关,如银屑病、冠心病、糖尿病和肿瘤等[19]。MIAT位于人类染色体22q12.1的位置,有4个转录本,其在多个物种间具有保守性[20-21]。近年来的研究发现,MIAT在多种肿瘤中处于紊乱表达状态,Sattari等[22]报道MIAT在慢性淋巴细胞白血病患者中表达水平升高且与患者染色体突变有关,可成为潜在的预后指标;郑灶松等[10]通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)公共数据库分析发现MIAT在肾透明细胞癌组织中的表达明显高于癌旁正常组织,并且MIAT高表达的患者的总生存时间明显低于MIAT低表达的患者。高通量基因表达数据库是基于大量累积的基因表达谱的数据而形成的高通量基因表达数据库,为疾病相关基因的分析提供了快捷、高效的途径[23-24]。我们通过提取GEO公共数据库GSE19804和GSE30219数据集的生物信息学资料和临床预后资料,分析MIAT在NSCLC组织和正常肺组织中的表达差异以及MIAT表达水平与NSCLC患者生存期的关系。本研究分析结果显示,GEO公共数据库GSE19804数据集中MIAT在NSCLC组织中的表达高于正常肺组织,GEO公共数据库GSE30219数据集中MIAT高表达患者生存期显著短于低表达患者。此外,NSCLC细胞系A549、NCI-H266和NCI-H1299中MIAT的表达也高于支气管正常上皮细胞系HBE,这些结果表明NSCLC患者的MIAT表达升高,可能是判断NSCLC发生的潜在标志物。
肿瘤是一类渐进性增殖异常的疾病,其发生发展常常伴随着细胞的恶性增殖[25]。非小细胞肺癌中MIAT的高表达可能与其侵袭、转移和血管生成等密切相关。Zhang等[26]研究显示MIAT可呈“海绵样”吸附miR-150发挥竞争性内源 RNA(competitive endogenous RNA, ceRNA)的作用促进上皮-间充质转化相关分子锌指E盒结合同源框1的表达,从而抑制NSCLC细胞的侵袭转移。本研究主要从NSCLC细胞恶性增殖的角度出发,通过流式细胞术、CCK-8实验和细胞集落形成实验,检测在NSCLC细胞系A549中通过siRNA沉默MIAT表达后细胞的增殖情况,与对照组si-NC细胞相比,si-MIAT组处于G1期的细胞比例明显增多,处于S期的细胞比例明显减少; si-MIAT组的细胞集落形成明显受到了抑制,且集落数量明显减少;si-MIAT组的细胞活力明显受到抑制。这些结果表明,在非小细胞肺癌细胞中沉默MIAT的表达可明显抑制其恶性增殖的生物学表型。
细胞周期蛋白包括G1期、S期和M期蛋白3种,G1/S期特异性周期蛋白cyclin D1可与细胞周期蛋白依赖性激酶6(cyclin-dependent kinase 6,CDK6)特异性结合,形成cyclin D1-CDK6复合体,推进G1期向S期的进程,而CDKN1A可抑制G1期向S期的转换[27-28]。目前,MIAT如何影响非小细胞肺癌的细胞增殖的分子机制还未见文献报道,鉴于我们在lncRNAs核质定位实验中发现MIAT主要定位在细胞质中以及流式细胞技术检测中发现si-MIAT可使细胞周期G1到S期的进展受到阻滞,因此我们推测MIAT可能通过在细胞质中发挥调控细胞周期分子cyclin D1和CDKN1A的作用从而影响NSCLC的增殖。本研究通过qPCR和Western blot实验检测,结果显示与对照组si-NC细胞相比,si-MIAT组细胞中cyclin D1的表达水平受到抑制,而G1/S期转换的抑制蛋白CDKN1A的表达水平升高,提示MIAT可能在细胞质中通过调控周期相关蛋白的表达影响周期进程,进而促进了NSCLC的增殖。
[参考文献]
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5):E359-E386.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[3] Raungrut P, Wongkotsila A, Lirdprapamongkol K, et al. Prognostic significance of 14-3-3gamma overexpression in advanced non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2014, 15(8):3513-3518.
[4] Miller KD, Siegel RL, Lin CC, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66(4):271-289.
[5] 何笑云, 欧春麟, 周素娴. 长链非编码RNAs在糖尿病中的研究进展[J]. 中华糖尿病杂志, 2016, 8(3):187-189.
[6] Beermann J, Piccoli MT, Viereck J, et al. Non-coding RNAs in development and disease: background, mechanisms, and therapeutic approaches[J]. Physiol Rev, 2016, 96(4):1297-1325.
[7] Ishii N, Ozaki K, Sato H, et al. Identification of a novel non-coding RNA, MIAT, that confers risk of myocardial infarction[J]. J Hum Genet, 2006, 51(12):1087-1099.
[8] Crea F, Venalainen E, Ci X, et al. The role of epigene-tics and long noncoding RNA MIAT in neuroendocrine prostate cancer[J]. Epigenomics, 2016, 8(5):721-731.
[9] Li Y, Wang K, Wei Y, et al. lncRNA-MIAT regulates cell biological behaviors in gastric cancer through a mechanism involving the miR-29a-3p/HDAC4 axis[J]. Oncol Rep, 2017, 38(6):3465-3472.
[10] 郑灶松, 陈海城, 谢文练. 长链非编码RNA MIAT在肾透明细胞癌中的表达情况和预后意义[J]. 岭南现代临床外科, 2017, 17(4):391-394.
[11] Galardi S, Savino M, Scagnoli F, et al. Resetting cancer stem cell regulatory nodes upon MYC inhibition[J]. EMBO Rep, 2016, 17(12):1872-1889.
[12] Huarte M, Guttman M, Feldser D, et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell, 2010, 142(3):409-419.
[13] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1):5-29.
[14] Seve P, Reiman T, Dumontet C. The role of βIII tubulin in predicting chemoresistance in non-small cell lung cancer[J]. Lung Cancer, 2010, 67(2):136-143.
[15] 姜兴明, 王志东, 李景林, 等. 牛磺酸上调基因1对肿瘤发生发展的调控作用[J]. 中国病理生理杂志, 2017,33(7):1332-1337.
[16] 何笑云, 欧春麟, 肖艳华, 等. 沙格列汀对高糖诱导内皮细胞中LncRNA-MALAT1表达的影响[J]. 医学研究生学报, 2016,29(6):902-905.
[17] 覃伟峰, 仉红刚. lncRNA在心血管疾病中作用的研究进展[J]. 中国病理生理杂志, 2016,32(8):1471-1477.
[18] Chen LL. Linking Long Noncoding RNA Localization and Function[J]. Trends Biochem Sci, 2016, 41(9):761-772.
[19] 张明娇, 吴 勇, 李珉珉. 长链非编码RNAs的生物功能及其与器官发育和恶性肿瘤的关系[J]. 中国病理生理杂志, 2015,31(11):2107-2112.
[20] Liao J, He Q, Li M, et al. LncRNA MIAT: myocardial infarction associated and more[J]. Gene, 2016, 578(2):158-161.
[21] Zhou X, Zhang W, Jin M, et al. lncRNA MIAT functions as a competing endogenous RNA to upregulate DAPK2 by sponging miR-22-3p in diabetic cardiomyopathy[J]. Cell Death Dis, 2017, 8(7):e2929.
[22] Sattari A, Siddiqui H, Moshiri F, et al. Upregulation of long noncoding RNA MIAT in aggressive form of chronic lymphocytic leukemias[J]. Oncotarget, 2016, 7(34):54174-54182.
[23] Davis S, Meltzer PS. GEOquery: a bridge between the Gene Expression Omnibus (GEO) and BioConductor[J]. Bioinformatics, 2007, 23(14):1846-1847.
[24] Barrett T, Troup DB, Wilhite SE, et al. NCBI GEO: mining tens of millions of expression profiles--database and tools update[J]. Nucleic Acids Res, 2007, 35(Database issue):D760-D765.
[25] Balkwill F, Mantovani A. Cancer and inflammation: implications for pharmacology and therapeutics[J]. Clin Pharmacol Ther, 2010, 87(4):401-406.
[26] Zhang HY, Zheng FS, Yang W, et al. The long non-co-ding RNA MIAT regulates zinc finger E-box binding homeobox 1 expression by sponging miR-150 and promoteing cell invasion in non-small-cell lung cancer[J]. Gene, 2017, 633:61-65.
[27] Semczuk A, Jakowicki JA. Alterations of pRb1-cyclin D1-cdk4/6-p16INK4Apathway in endometrial carcinogenesis[J]. Cancer Lett, 2004, 203(1):1-12.
[28] Schwartz GK, Shah MA. Targeting the cell cycle: a new approach to cancer therapy[J]. J Clin Oncol, 2005, 23(36):9408-9421.

