骨髓基质细胞介导的微环境对人肺腺癌A549细胞的作用*
李 汪, 陈思成, 孙艳婷, 李具琼, 朱 颖, 张盟浩, 陈 彬, 施 琼△
(1重庆医科大学检验医学院临床诊断教育部重点实验室, 重庆 400016; 2新乡医学院, 河南 新乡 453003)
肺癌是最常见的恶性肿瘤之一,其发病率在男性和女性所患肿瘤均居首位,死亡率在男性各肿瘤中居首,女性中居次[1]。尽管最近几年肺癌的5年生存率略有增长,但是肺癌的预后仍不乐观[2]。而肺癌预后较差的一大原因即是其容易转移,因此控制肺癌转移是改善病人预后的重要课题。1989年,Paget等[3]关于肿瘤转移的“土壤和种子”理论是肿瘤研究史上的里程碑事件。转移靶器官的微环境决定了转移灶是否能形成,而骨髓基质细胞构成了肿瘤骨转移前的微环境。骨髓基质细胞也就是间充质干细胞(mesenchymal stem cells,MSCs)[4],是肿瘤基质中的重要组成成分,能通过分泌多种组分来影响肿瘤的生长和转移。
趋化因子是由白细胞或一些基质细胞分泌的能结合于内皮表面的对某些免疫细胞(如中性粒细胞、淋巴细胞和单核细胞)具有趋化和激活作用的一类细胞因子,通过与其特定的受体结合来发挥生物学效应[5],肿瘤炎症微环境中的重要组成成分。趋化因子受体根据其N端半胱氨酸残基(cysteine,Cys)的数目和相对位置不同可以分为CXC、CC、C和CX3C共4个亚类[6]。而CX3C趋化因子受体1(CX3C chemokine receptor 1,CX3CR1)是CX3CR家族中目前已知的唯一成员。目前的研究已经证实,该受体能够参与调控骨肉瘤、肾癌和肺癌等肿瘤的发生发展[7-9],其既能参与肿瘤细胞的黏附趋化,又能参与抗肿瘤免疫,在肿瘤发展过程中发挥了重要的作用。MSCs对肿瘤的作用具有双面性,既可促进又可抑制肿瘤的生长转移[10-11],但对肺腺癌细胞的作用尚未完全阐明。本课题采用人骨髓基质细胞HS-5为研究对象,利用HS-5细胞条件培养基(HS-5 cell-conditioned medium,HS-5-CM)处理人肺腺癌A549细胞,旨在探讨MSCs对肺腺癌细胞的作用和机制,以及该过程中CX3CR1的变化,为肺癌的临床治疗提供一些新的治疗策略。
材 料 和 方 法
1 材料
1.1细胞株 人肺腺癌细胞株A549和人骨髓基质细胞株HS-5由重庆医科大学临床诊断检验诊断学教育部重点实验室前期保存备用。2种细胞均用含有10%胎牛血清的RPMI-1640高糖培养基,置于37 ℃、5% CO2的培养箱中培养。2种细胞均贴壁生长,当融合度达到80%时,行常规胰酶消化传代。
1.2主要试剂 RPMI-1640高糖培养基和胎牛血清购自HyClone;qPCR试剂盒和qPCR引物购自TaKaRa;MTT试剂购自Sigma;兔抗人CX3CR1单克隆抗体购自Abcam;兔抗人细胞外信号调节激酶(extra-cellular signal-regulated kinase,ERK)及磷酸化ERK(phosphorylated ERK,p-ERK)单克隆抗体购自Cell Signaling Technology;鼠抗人β-actin多克隆抗体购自Santa Cruz;Western blot及蛋白提取相关试剂和MAPK/ERK特异性抑制剂U0126购自上海碧云天生物技术有限公司;聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜和化学发光试剂盒购自Millipore。
2 方法
2.1HS-5-CM的制备 将融合度为70%的HS-5细胞接种在直径为10 cm的培养皿中,待贴壁后PBS洗3次,更换为10 mL无血清的RPMI-1640高糖培养基,第1天收集一次上清液;另一培养皿中的上清液留待第2天收集,之后1 000 r/min离心15 min,取上清分别标记为HS-5-CM-24 h和HS-5-CM-48 h,-20 ℃保存备用。
2.2MTT法检测HS-5-CM对A549细胞活力的影响 A549细胞以每孔500 个接种于96孔板中,每组4个平行孔,待细胞贴壁后PBS洗3次,加入无血清培养液100 μL。实验分为空白对照(blank control,blank)组:A539细胞;HS-5-CM-24 h组:A549细胞+HS-5-CM-24 h;HS-5-CM-48 h组:A549细胞+HS-5-CM-48 h。分别于第1、2和3 d对A549细胞进行MTT检测,每孔加入10 μL MTT(5 g/L),继续培养4 h,吸尽孔内培养液,每孔加入150 μL DMSO,轻摇振荡15 min,使紫色结晶物充分溶解,于酶标仪490 nm处检测各孔吸光度(A),重复3次取平均值。
2.3划痕实验检测HS-5-CM对A549细胞迁移能力的影响 A549细胞以2×105的密度接种于6孔板中,细胞密度达到90%时,用10 μL小枪头行“一”字划痕,弃掉培养基,PBS清洗3遍,每孔加入含2%血清的RPMI-1640培养基,显微镜下观察并拍照,此时记为0 h,继续培养24 h后在同一观察点观察划痕愈合情况并拍照,通过计算多个观察点划痕宽度平均值,得出各组细胞划痕愈合率。划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,实验重复3次。
2.4qPCR检测A549细胞中CX3CR1 的mRNA表达 Trizol法提取各组A549细胞总RNA,按试剂盒的方法逆转录,以转录后的cDNA进行PCR扩增。反应体系为10 μL,反应条件为95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,40个循环;72 ℃ 30 s。重复实验3次。反应引物序列如下:CX3CR1的上游引物序列为5′-CAACAGCAAGAAGCCCAAGAG-3′,下游引物序列为5′-TGAAGAAGAAGGCGGTAGTGAA-3′;β-actin的上游引物序列为5′-CCACCGAACTACCTTCAACTCC-3′,下游引物序列为5′-GTGATCTCCTTCTGCATCCTGT-3′。
2.5Western blot 检测蛋白水平 用MAPK/ERK信号通路抑制剂U0126处理A549细胞24 h后,再加HS-5-CM处理24 h,饥饿处理后提取总蛋白,BCA法测定蛋白浓度,加入蛋白上样缓冲液后,煮沸10 min至蛋白变性。经SDS-PAGE、转膜、封闭。加入 I 抗(1∶1 000),4 ℃孵育过夜,洗膜,加入 II 抗(1∶5 000),37 ℃孵育1 h,洗膜,化学发光显影。Quantity One软件计算各电泳条带的灰度值,以β-actin作为内参照,得出各蛋白的表达水平,实验重复3次。
3 统计学处理
采用SPSS 19.0统计软件进行数据处理和统计分析。实验数据以均数±标准差(mean±SD)表示,采用t检验比较两组间差异的统计学显著性,多组数据差异的比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 HS-5-CM能促进A549细胞的活力
MTT结果显示,细胞培养第1和2天时HS-5-CM-24 h组和HS-5-CM-48 h组的A490值较blank组增加不明显,第3天时HS-5-CM-24 h组和HS-5-CM-48 h组的A490较blank组均显著增加(P<0.01),见图1。这说明HS-5-CM可以促进A549细胞的活力。
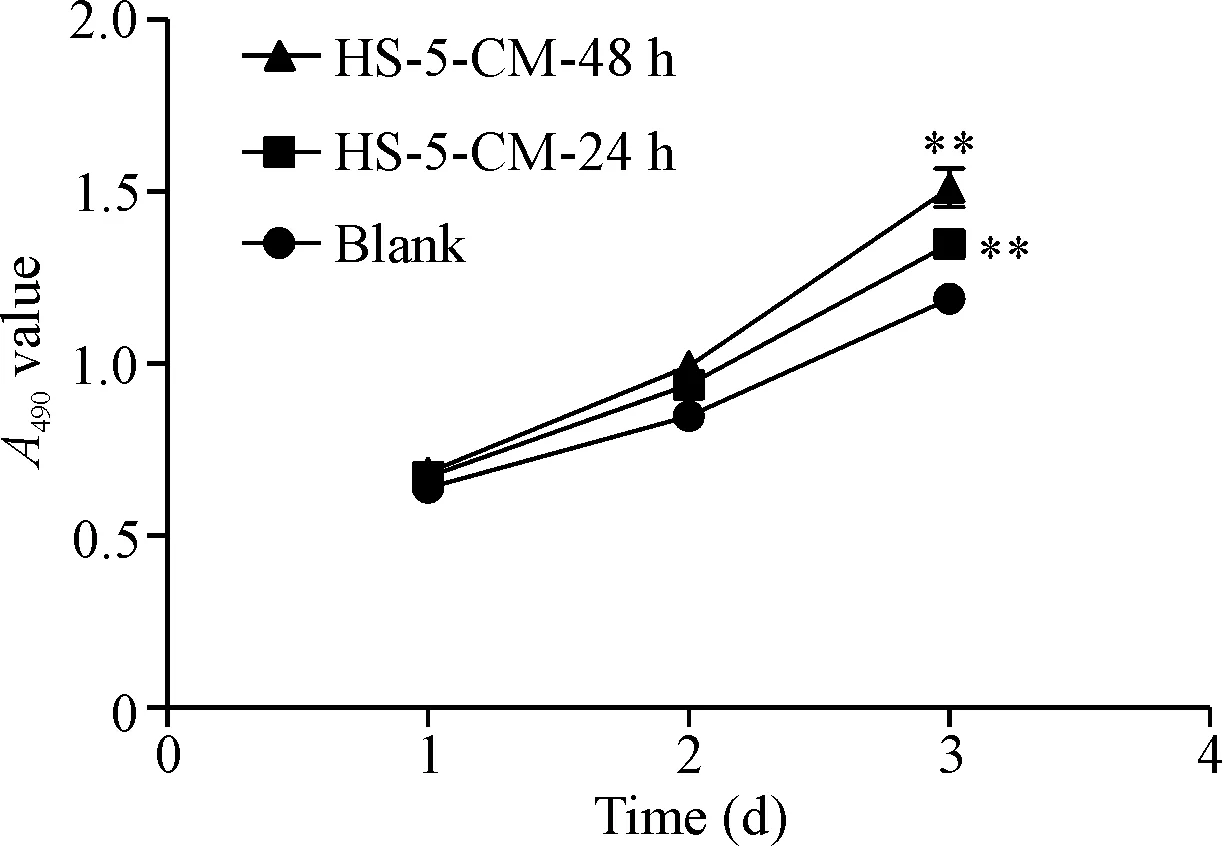
Figure 1. The effects of HS-5-CM on the viability of A549 cells measured by MTT assay. Mean±SD.n=3.**P<0.01vsblank group.
图1MTT测定HS-5-CM对A549细胞活力的影响
2 HS-5-CM能促进A549细胞的迁移能力
划痕实验结果显示,HS-5-CM-24 h组和HS-5-CM-48 h组的细胞划痕在24 h的愈合率与blank组比较显著升高(P<0.01),见图2。这说明HS-5-CM明显促进A549细胞的迁移。
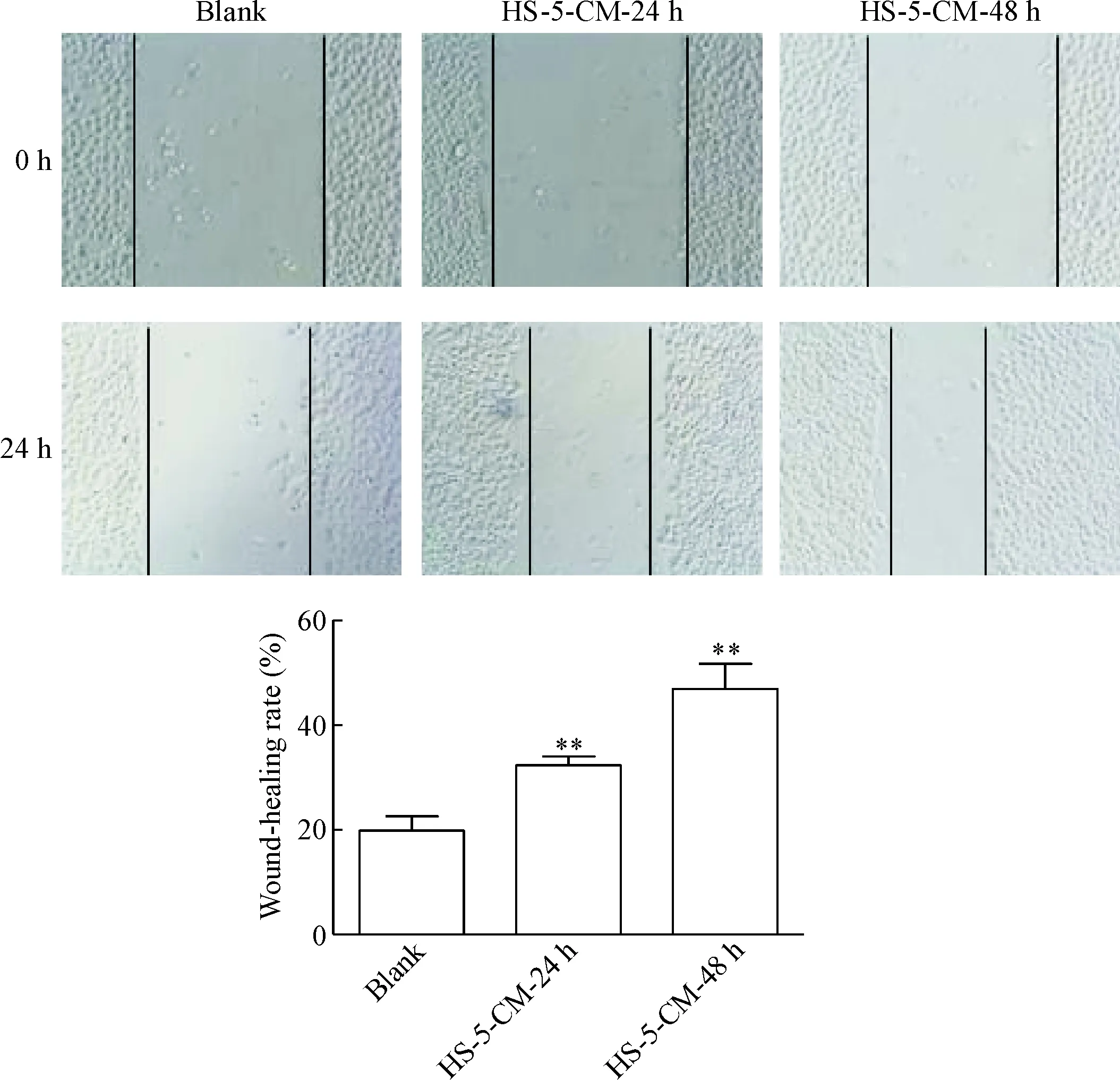
Figure 2. The effects of HS-5-CM on the migration ability of A549 cells measured by wound-healing assay (×100). Mean±SD.n=3.**P<0.01vsblank group.
图2HS-5-CM对A549细胞迁移能力的影响
3 HS-5-CM能增加A549细胞中CX3CR1的表达
qPCR结果显示,与blank组相比,HS-5-CM-48 h组CX3CR1的mRNA表达明显上升(P<0.05)。说明HS-5细胞能增加A549细胞中CX3CR1的mRNA表达水平,见图3。
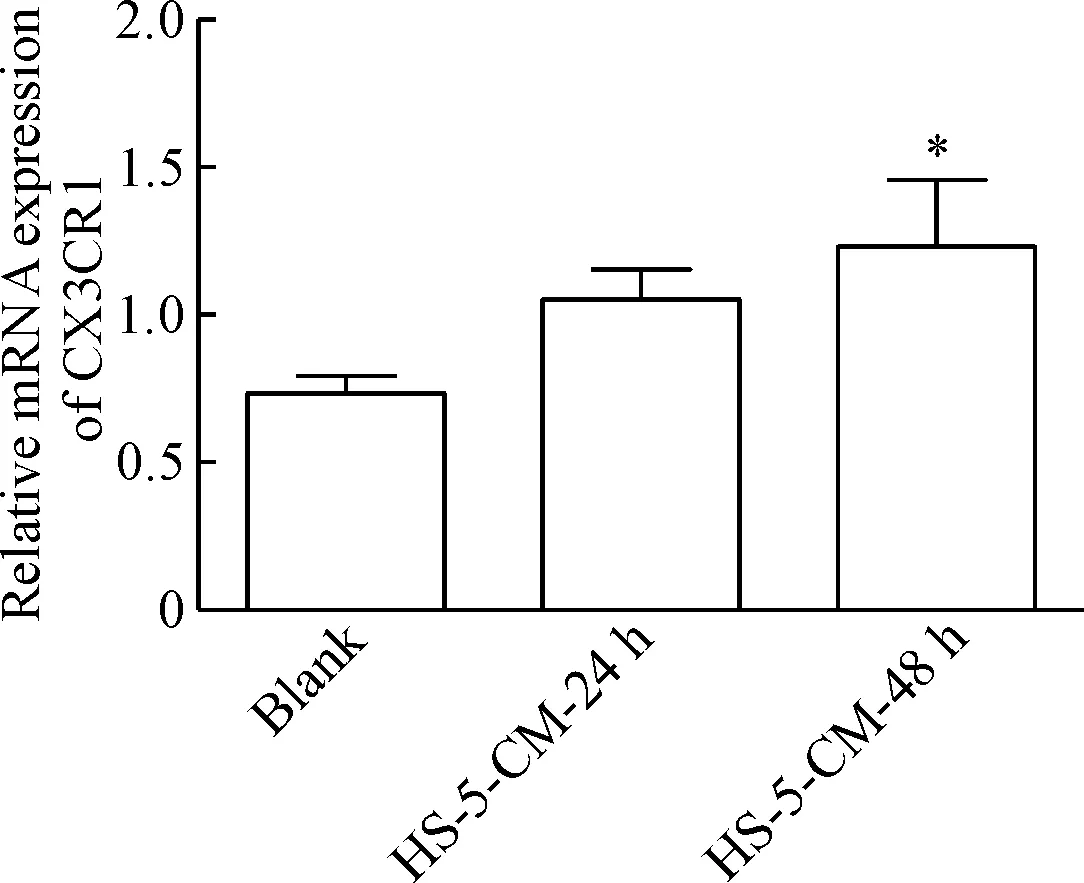
Figure 3. The mRNA expression of CX3CR1 in the A549 cells after treated with HS-5-CM. Mean±SD.n=3.*P<0.05vsblank group.
图3qPCR测定HS-5-CM对A549细胞中CX3CR1表达的影响
4 HS-5-CM能激活A549细胞中MAPK/ERK信号通路
Western blot结果显示,与blank组相比,HS-5-CM-48 h组的p-ERK/ERK的比值增加(P<0.05);分别加入5 μmol/L和10 μmol/L的MAPK/ERK通路抑制剂U0126处理24 h后,与HS-5-CM-48h组相比,5 μmol/L抑制剂组和10 μmol/L抑制剂组的p-ERK/ERK的比值均减少(P<0.01),见图4。
5 MAPK/ERK信号通路受抑可以减弱HS-5-CM促A549细胞迁移的作用
划痕实验结果显示,与blank组相比,HS-5-CM-48 h组的A549细胞划痕在24 h的愈合率显著升高(P<0.01);分别加入5 μmol/L和10 μmol/L的MAPK/ERK通路抑制剂U0126处理24 h后,与HS-5-CM-48 h组相比,5 μmol/L抑制剂组和10 μmol/L抑制剂组的细胞划痕愈合率均显著下降(P<0.01),说明MAPK/ERK信号通路受抑制可以减弱HS-5-CM促A549细胞迁移的作用,见图5。
6 抑制MAPK/ERK信号通路可以降低HS-5-CM处理后A549细胞中CX3CR1的表达
Western blot实验结果显示,与blank 组相比,HS-5-CM-48 h组A549细胞的CX3CR1蛋白表达上升(P<0.05);分别加入5 μmol/L和10 μmol/L的MAPK/ERK通路抑制剂U0126处理24 h后,与HS-5-CM-48 h组相比, 5 μmol/L抑制剂组和10 μmol/L抑制剂组细胞的CX3CR1蛋白表达均显著下降(P<0.05),说明抑制MAPK/ERK信号通路可以降低HS-5-CM处理后A549细胞中CX3CR1的表达,见图6。
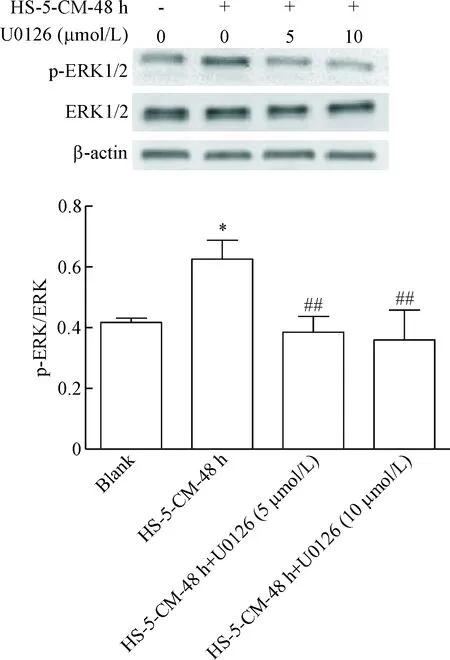
Figure 4. The protein levels of p-ERK in the A549 cells treated with MAPK/ERK inhibitor U0126 after exposed to HS-5-CM for 48 h. Mean±SD.n=3.*P<0.05vsblank group;##P<0.01vsHS-5-CM-48 h group.
图4MAPK/ERK抑制剂对HS-5-CM处理后A549细胞内p-ERK蛋白水平的影响
讨 论
肺癌作为一种最常见的原发性恶性肿瘤,由于其发病隐匿,很多患者初诊时就已发现了远处转移。一旦发生远处转移,患者的5年生存率不足5%,是导致患者治疗疗效差和死亡率高的重要原因,所以探索和阐明肺癌转移的具体机制十分迫切。
目前,随着对肿瘤研究的不断深入,越来越多的研究发现,肿瘤细胞转移到特定的器官,是与该器官的微环境密切相关的。而维持骨微环境的稳态需要成骨细胞、破骨细胞和骨髓基质细胞等共同参与。目前研究发现,MSCs可通过分泌多种细胞因子来促进或者抑制肿瘤转移[12-15]。本研究所采用的骨髓基质细胞HS-5是人永生化的细胞,解决了原代细胞提取困难、传代代数少的问题。同时本研究通过骨髓基质细胞条件培养基处理肺腺癌A549细胞,MTT实验发现HS-5条件培养基能促进A549细胞的活力,划痕愈合实验证实其能上调A549细胞的迁移能力,同时,在A549细胞活力和迁移能力上调的过程中,MAPK/ERK信号通路会活化,p-ERK蛋白水平升高。MAPK/ERK信号通路主要参与细胞的活力和分化,该通路异常激活可导致肿瘤的发生发展。使用MAPK/ERK信号通路抑制剂U0126之后,骨髓基质细胞对A549细胞的这种促迁移能力会有所下调,p-ERK蛋白水平下调,划痕愈合能力降低。说明MAPK/ERK信号通路参与了骨髓基质细胞调控A549细胞迁移的过程。

Figure 5. The migration ability of A549 cells treated with MAPK/ERK pathway inhibitor U0126 after exposed to HS-5-CM for 48 h (×100). Mean±SD.n=3.**P<0.01vsblank group;##P<0.01vsHS-5-CM-48 h group.
图5MAPK/ERK信号通路受抑对HS-5-CM促A549细胞迁移能力的影响
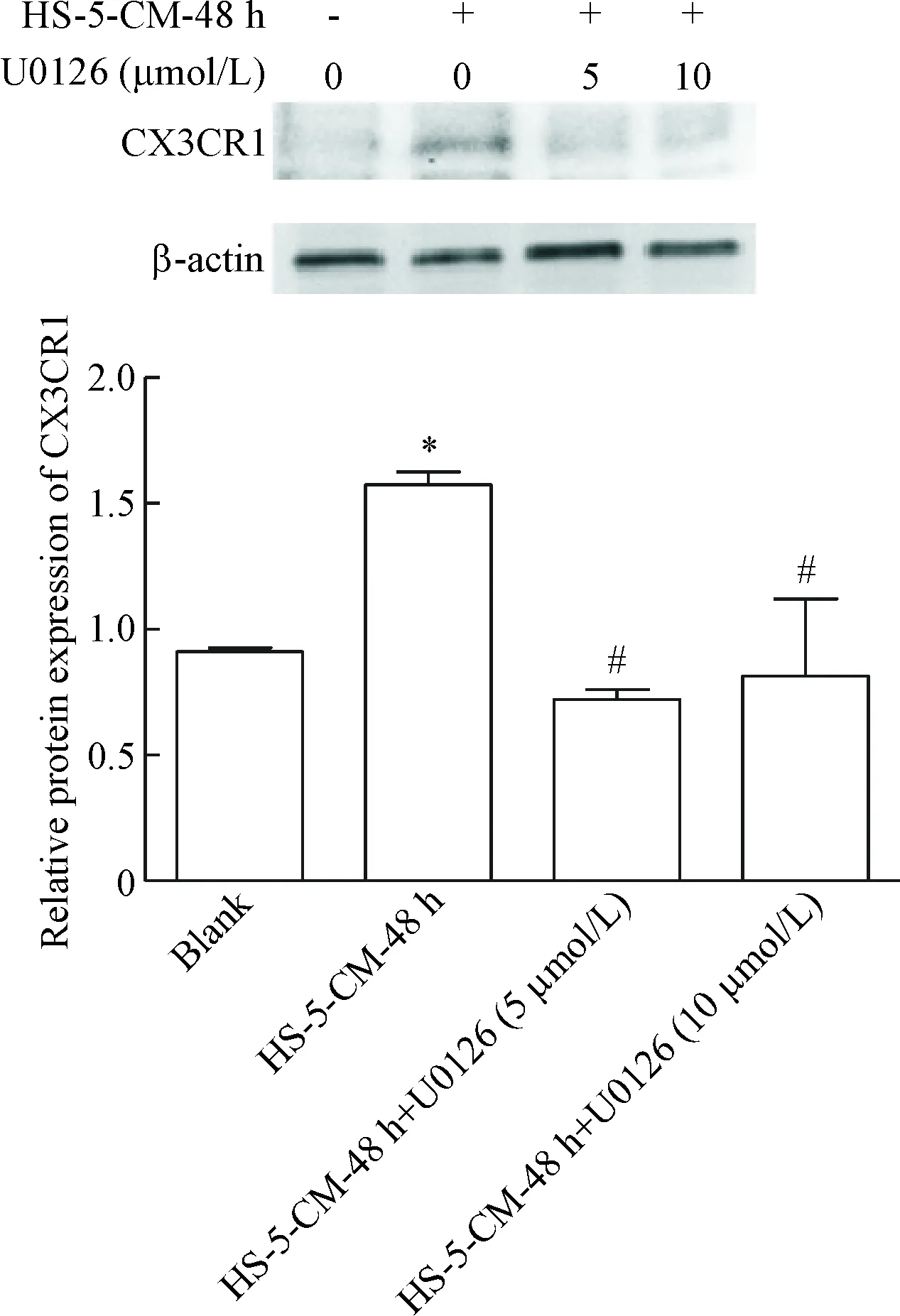
Figure 6. The protein expression of CX3CR1 in the A549 cells treated with MAPK/ERK inhibitor U0126 after exposed to HS-5-CM for 48 h. Mean±SD.n=3.*P<0.05vsblank group;#P<0.015vsHS-5-CM-48 h group.
图6MAPK/ERK通路抑制剂对A549中CX3CR1表达的影响
另外,CX3CR1是一种多功能的趋化因子受体,已被证实能参与调控多种肿瘤的生物学效应。但MSCs介导的CX3CR1是否在骨微环境中影响肺癌的发生发展目前还不清楚。本研究证实,在骨髓基质细胞促进A549细胞迁移的过程中,CX3CR1的表达有所上升,在使用MAPK/ERK通路抑制剂影响骨髓基质细胞对A549细胞的作用后,CX3CR1的表达下调,说明,CX3CR1可能参与骨髓基质细胞对A549细胞的调控过程,但具体机制有待进一步探讨。
综上所述,本研究说明了HS-5细胞可以促进A549细胞的增殖和迁移,其机制可能涉及MAPK/ERK通路的活化和CX3CR1的表达变化。这可为我们进一步研究趋化因子受体在肿瘤微环境中的作用提供方向,同时为临床肺癌治疗和预后判断提供一些帮助。
致谢:衷心感谢分子肿瘤学实验室何通川老师、翁亚光老师、张彦老师、罗进勇老师、唐敏老师、左国伟老师等在实验过程中给予的指导帮助,感谢郭杨柳师兄、李亚师兄、范梦恬师姐等给予我悉心的疑难指导。
[参考文献]
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[2] Francisci S, Minicozzi P, Pierannunzio D, et al. EUROCARE-5 Working Group Survival patterns in lung and pleural cancer in Europe 1999-2007: results from the EUROCARE-5 study[J]. Eur J Cancer, 2015, 51(15):2242-2253.
[3] Paget S. The distribution of secondary growths in cancer of the breast. 1889 [J] . Cancer Metastasis Rev, 1989, 8(2):98-101.
[4] Nemeth K, Keane-Myers A, Brown JM, et al. Bone marrow stromal cells use TGF-β to suppress allergic responses in a mouse model of ragweed-induced asthma [J]. Proc Natl Acad Sci U S A, 2010, 107(12):5652-5657.
[5] Kufareva I. Chemokines and their receptors: insights from molecular modeling and crystallography[J]. Curr Opin Pharmacol, 2016, 30:27-37.
[6] Zlotnik A, Yoshie O. Chemokines: a new classification system and their role in immunity[J]. Immunity, 2000, 12(2):121-127.
[7] Yao X, Qi L, Chen X . Expression of CX3CR1 associates with cellular migration, metastasis, and prognosis in human clear cell renal cell carcinoma[J]. Urol Oncol, 2013, 32(2):162-170.
[8] Lv CY, Zhou T, Chen W. Preliminary study correlating CX3CL1/CX3CR1 expression with gastric carcinoma and gastric carcinomaperineural invasion[J]. World J Gastroenterol, 2014, 20(15):4428-4432.
[9] Liu JF, Tsao YT, Hou CH. Fractalkine/CX3CL1 induced intercellular adhesion molecule-1-dependent tumor metastasis through the CX3CR1/PI3K/Akt/NF-κB pathway in human osteosarcoma[J]. Oncotarget, 2016, 8(33):54136-54148.
[10] Zhang MH, Hu YD, Xu Y, et al. Human mesenchymal stem cell enhance autophagy of lung carcinoma cells against apoptosis during serum deprivation [J]. Int J Oncol, 2013, 42(4):1390-1398.
[11] Tian LL, Yue W, Zhu F, et al. Human mesenchymal stem cells play a dual role on tumor cell growthinvitroandinvivo[J]. J Cell Physiol, 2011, 226(7):1860-1867.
[12] Gomes CM. The dual role of mesenchymal stem cells in tumor progression[J]. Stem Cell Res Ther, 2013, 4(2):42.
[13] Windus LC, Glover TT, Avery VM. Bone-stromal cells up-regulate tumourigenic markers in a tumour-stroma 3D model of prostate cancer[J]. Mol Cancer, 2013, 12:112.
[14] Karnoub AE, Dash AB, Yo AP, et al .Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J]. Nature, 2007, 449(7162):557-563.
[15] Song B, Kim B, Choi SH, et al. Mesenchymal stromal cells promote tumor progression in fibrosarcoma and gastric cancer cells[J]. Korean J Pathol, 2014, 48(3):217-224.

