PGRN基因沉默对人非小细胞肺癌A549细胞增殖及迁移的影响*
孙艳婷, 陈思成, 李 汪, 李具琼, 朱 颖, 施 琼△
(1重庆医科大学检验医学院, 临床诊断教育部重点实验室, 重庆 400016; 2新乡医学院, 河南 新乡 453000)
肺癌是近年来最常见的恶性肿瘤之一[1],根据组织学和病理学分型可分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC),其中,非小细胞肺癌约占肺癌总数的85%,是最常见的肺癌类型。非小细胞肺癌的病理分型包括肺腺癌、 肺鳞癌和大细胞肺癌[2]。最新统计数据表明约有26%的肿瘤患者因肺癌死亡[3],肺癌死亡率在我国一直居高不下,其治疗效果有限。因此,探讨非小细胞肺癌发生发展的机制尤为重要,并有可能为临床提供新的治疗策略。
颗粒蛋白前体(progranulin, PGRN)属于生长因子家族中的分泌型糖蛋白[4],在损伤修复[4]、急性肺损伤/成人呼吸窘迫综合征[5]、骨关节炎[6]和肿瘤发展进程[7]中发挥着重要作用。据研究报道,PGRN可以促进乳腺癌[8]、肝癌[9]、膀胱癌[7]和结直肠癌[10]等多种肿瘤的发生,而目前的报道中尚未有关于PGRN在非小细胞肺癌中的作用及机制研究。本实验采用高表达PGRN的非小细胞肺癌细胞株A549为研究对象,通过转染小干扰RNA(small interfering RNA, siRNA)特异性干扰PGRN基因的表达,以研究PGRN基因沉默对A549细胞增殖及迁移的影响,并初步探讨其分子机制,为非小细胞肺癌的治疗提供新的实验依据。
材 料 和 方 法
1 细胞株与试剂
人非小细胞肺癌细胞株A549以及人正常支气管上皮(human bronchial epithelial,HBE)细胞株由重庆医科大学教育部临床检验诊断学重点实验室保存。
DMEM 高糖培养基购自Hyclone;澳洲胎牛血清购自Gibco; TRIzol和Lipofectamine 2000均购自Invitrogen;特异性干扰PGRN基因的小干扰RNA(PGRN-small interfering RNA, PGRN-siRNA)和无意义小干扰RNA(scrambled siRNA, sc-siRNA)均购自上海吉玛基因化学技术有限公司;逆转录试剂和qPCR反应相关试剂均购自TaKaRa; qPCR引物由上海百力格公司合成;Transwell小室购自Corning;1%结晶紫染液、MTT以及台盼蓝试剂均购自Sigma;蛋白裂解液、BCA蛋白浓度测定试剂盒和Western blot检测相关试剂购自碧云天生物技术有限公司;聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜和化学发光试剂盒购自Millipore;羊抗人PGRN 抗体购自R & D Systems; 鼠抗人Bcl-2、Bax和细胞周期蛋白D1(cyclin D1)抗体及兔抗人增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体购自Santa Cruz;兔抗人细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2)、磷酸化ERK1/2(phosphorylated ERK1/2, p-ERK1/2)、蛋白激酶B(protein kinase B, Akt)和磷酸化Akt(phosphorylated Akt, p-Akt)抗体购自CST;抗β-肌动蛋白(β-actin)抗体及辣根过氧化物酶标记的兔抗羊、羊抗兔和羊抗鼠IgG(II 抗)购自北京中杉金桥生物公司。
2 方法
2.1细胞培养 将细胞置于DMEM培养液(含10%胎牛血清)中,在37 ℃、5% CO2的无菌恒温培养箱中培养。当细胞密度达满视野后,用0.25%的胰蛋白酶消化后离心,并用新鲜培养液重悬、传代。取对数生长期细胞进行实验。
2.2siRNA转染及实验分组 将处于对数生长期的A549细胞用0.25%的胰酶消化、离心、重悬,并以每孔2×105的密度铺于6孔板中。当细胞生长至80%融合时,将PGRN-siRNA和sc-siRNA分别转染至A549细胞中。转染24~48 h后,提取细胞总RNA,用于后续qPCR检测;转染48~72 h后,提取细胞总蛋白,用于后续的Western blot检测。sc-siRNA的模板链序列为 5’-UUCUCCGAACGUGUCACGUTT-3’,反义链序列为5’-ACGUGACACGUUCGGAGAATT-3’;PGRN-siRNA的模板链序列为 5’-GCUUCCAAAGAUCAGGUAATT-3’,反义链序列为 5’-UUACCUGAUCUUUGGAAGCTT-3’。转染实验分3组 :(1)空白对照(control)组,即未转染任何siRNA的A549细胞;(2)sc-siRNA组,即转染了sc-siRNA 的A549细胞;(3)PGRN-siRNA组,即转染了PGRN-siRNA的A549细胞。
2.3qPCR法检测细胞中PGRN的mRNA 表达 TRIzol法提取各组细胞的总RNA,逆转录成cDNA后进行qPCR扩增。以β-actin为内参照,检测各组细胞中PGRN mRNA的表达水平。PGRN的上游引物序列为 5’-AGCAGGGAGGAGAGTGATTT-3’,下游引物序列为 5’-GGGTAGCGCTCAGACTACAG-3’;内参照β-actin的上游引物序列为 5’-CCACGAAACTACCTTCAACTCC-3’,下游引物序列为 5’-GTGATCTCCTTCTGCATCCTGT-3’。PCR反应体系为10 μL,反应条件为: 95 ℃预变性3 min; 95 ℃变性10 s、59 ℃退火30 s、72 ℃延伸30 s,共40个循环。目的基因的相对表达水平用2-ΔΔCt法计算。实验重复3次。
2.4Western blot法检测PGRN以及增殖和凋亡相关蛋白的表达 提取各组细胞的总蛋白,用BCA 法测定蛋白浓度。蛋白的上样量均为250 μg,计算出蛋白上样体积。SDS-PAGE分离目的蛋白,恒流(210 mA)电转至PVDF膜,5% BSA封闭2 h,加入羊抗人PGRN,鼠抗人Bcl-2、Bax和cyclin D1,兔抗人PCNA、 ERK1/2、p-ERK1/2、Akt和p-Akt单克隆抗体(稀释比例为 1∶1 000),4 ℃过夜; TBST洗膜后室温孵育相应的 II 抗(稀释比例为1∶5 000),TBST 洗膜后化学发光显影。采用 Quantity One软件分析条带的灰度值,用目的条带与内参照β-actin条带灰度值之比表示蛋白的相对表达水平。实验重复3次。
2.5MTT法检测细胞活力 转染48 h后消化、离心并重悬细胞,将 2 000个细胞铺于96孔板中,每组设置5个复孔。培养24、48和60 h后在相应的时点取出细胞培养板,每孔加入10 μL MTT,4 h后用酶标仪在492 nm 波长处检测各孔的吸光度(A)。实验重复3次。
2.6活细胞计数法检测细胞增殖能力 将A549细胞接种于6孔板中,当转染24 h后各组细胞融合 90% 时,用0.25%的胰蛋白酶消化,离心后重悬,将0.4% 台盼蓝染液按1∶1比例加入细胞悬液中。用牛鲍计数板充池后在显微镜下计数,并算出活细胞数目。实验重复3次。
2.7结晶紫染色检测细胞增殖能力 将A549细胞接种于6孔板中,当转染24 h后各组细胞融合 90% 时,用PBS轻柔冲洗3次,加入400 μL甲醛,室温放置20 min,弃去甲醛并用PBS冲洗3次,加入400 μL结晶紫溶液,染色20 min后,再用PBS冲洗3次,于通风处风干,并在显微镜下拍照。实验重复3次。
2.8划痕实验检测细胞迁移能力 将A549细胞接种于6孔板中,当转染24 h后各组细胞融合 90% 时, 用 10 μL小枪头行“十”字划线 ; PBS冲洗3次后换新鲜培养液,置于孵箱中继续培养;此后在显微镜下分别于0 h和48 h于同一位点拍照。划痕愈合率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。实验重复3次。
2.9Transwell实验检测细胞迁移能力 将处理24 h后的各组细胞消化、离心后用普通DMEM培养液(不含血清)重悬,在24孔板的下室中加入700 μL 含 10% 胎牛血清的完全 DMEM培养基,上室加入400 μL含有10 000个细胞的悬液,每组设置3个复孔。24 h后取出,清洗小室,固定并染色。显微镜下计数,至少观察10个视野,计数后取平均值。实验重复3次。
3 统计学处理
采用SPSS 20.0和GraphPad软件对实验数据进行统计分析。计量资料用均数±标准差(mean±SD)表示。采用t检验进行两组间比较,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 PGRN在A549细胞中的表达高于正常支气管上皮细胞
qPCR结果显示,非小细胞肺癌A549细胞中PGRN的mRNA表达水平显著高于正常支气管上皮细胞(P<0.01),见图1A;Western blot结果显示,A549细胞中PGRN的蛋白表达水平较HBE细胞明显升高(P<0.01),见图1B。这一结果表明,PGRN有可能是促进肺癌发生发展的指标。
2 PGRN-siRNA抑制A549细胞中PGRN mRNA 和蛋白的表达
qPCR结果显示,PGRN-siRNA组中PGRN的mRNA表达水平均较空白对照组和阴性对照组显著降低(P<0.01),见图2A;Western blot结果显示,PGRN-siRNA组A549细胞中PGRN蛋白的表达水平与空白对照组和阴性对照组相比显著降低(P<0.01),见图2B。这一结果表明,PGRN-siRNA转染能有效干扰A549细胞中PGRN的mRNA和蛋白表达。
3 PGRN 表达下调可抑制A549细胞的活力和增殖能力
MTT实验结果显示,0 h时各处理组细胞的A值无明显差异;而24 h、48 h和60 h时,PGRN-siRNA组A549细胞中的A值比空白对照和阴性对照组均明显降低(P<0.01),见图3A。活细胞计数和结晶紫染色结果显示,PGRN-siRNA组A549细胞的活细胞数比空白对照和阴性对照组均显著降低(P<0.01),见图3B、C。这一结果说明干扰PGRN基因可以抑制A549细胞的活力和增殖能力。
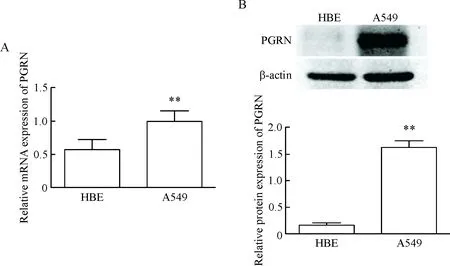
Figure 1. The expression levels of PGRN in the A549 cells and HBE cells. A: the mRNA expression of PGRN was detected by qPCR; B: the protein expression was determined by Western blot. Mean±SD.n=3.**P<0.01vsHBE group.
图1HBE细胞和A549细胞中PGRN的mRNA和蛋白表达水平
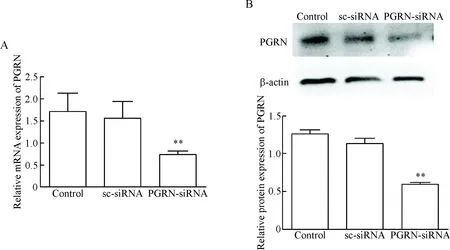
Figure 2. Transfection with PGRN-siRNA decreased PGRN expression in the A549 cells. A: the mRNA expression of PGRN was detected by qPCR; B: the protein expression was determined by Western blot. Mean±SD.n=3.**P<0.01vscontrol group.
图2A549细胞转染PGRN-siRNA后PGRN的mRNA和蛋白表达水平
4 PGRN表达下调可抑制A549细胞的迁移
划痕愈合实验结果显示,空白对照组48 h的划痕愈合率与阴性对照组比较,差异无统计学显著性;而PGRN-siRNA组与阴性对照组相比其划痕愈合率显著降低(P<0.01),见图4A。Transwell实验结果显示,PGRN-siRNA组中A549细胞穿过小室膜的细胞数明显低于空白对照组和阴性对照组(P<0.01),见图4B。以上结果说明干扰PGRN基因可以明显抑制A549细胞的迁移能力。
5 PGRN 表达下调影响增殖相关蛋白PCNA和cyclin D1 以及凋亡相关蛋白 Bcl-2和Bax的表达
Western blot结果显示,转染PGRN-siRNA 48 h后PGRN-siRNA组中PCNA、cyclin D1和Bcl-2的蛋白表达水平与空白对照组和阴性对照组相比明显减少(P<0.01),而Bax的蛋白表达水平较空白对照组和阴性对照组明显升高(P<0.01),见图5A。这提示转染PGRN-siRNA特异性干扰PGRN表达后,可以抑制A549细胞的增殖并促进细胞凋亡。
6 PGRN 表达下调对PI3K/Akt和MAPK/ERK信号通路相关蛋白的影响
Western blot检测结果显示,将PGRN-siRNA转染至A549细胞中48 h后PGRN-siRNA组中p-ERK1/2和p-Akt较阴性对照组和空白对照组均明显降低(P<0.01),见图5B。以上结果说明PI3K/Akt和MAPK/ERK信号通路可能参与PGRN调节非小细胞肺癌发生发展的过程。
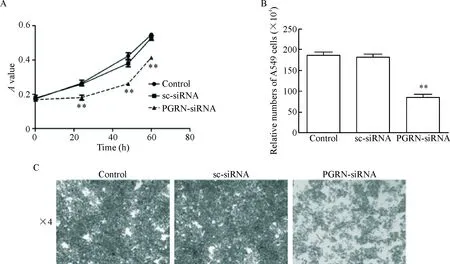
Figure 3. The effect of PGRN-siRNA on the viability and proliferation ability of the A549 cells. A: the cell viability was measured by MTT assay; B and C: the proliferation ability was detected by living cell counting and crystal violet staining. Mean±SD.n=3.**P<0.01vscontrol group.
图3干扰PGRN基因对A549细胞活力和增殖的影响
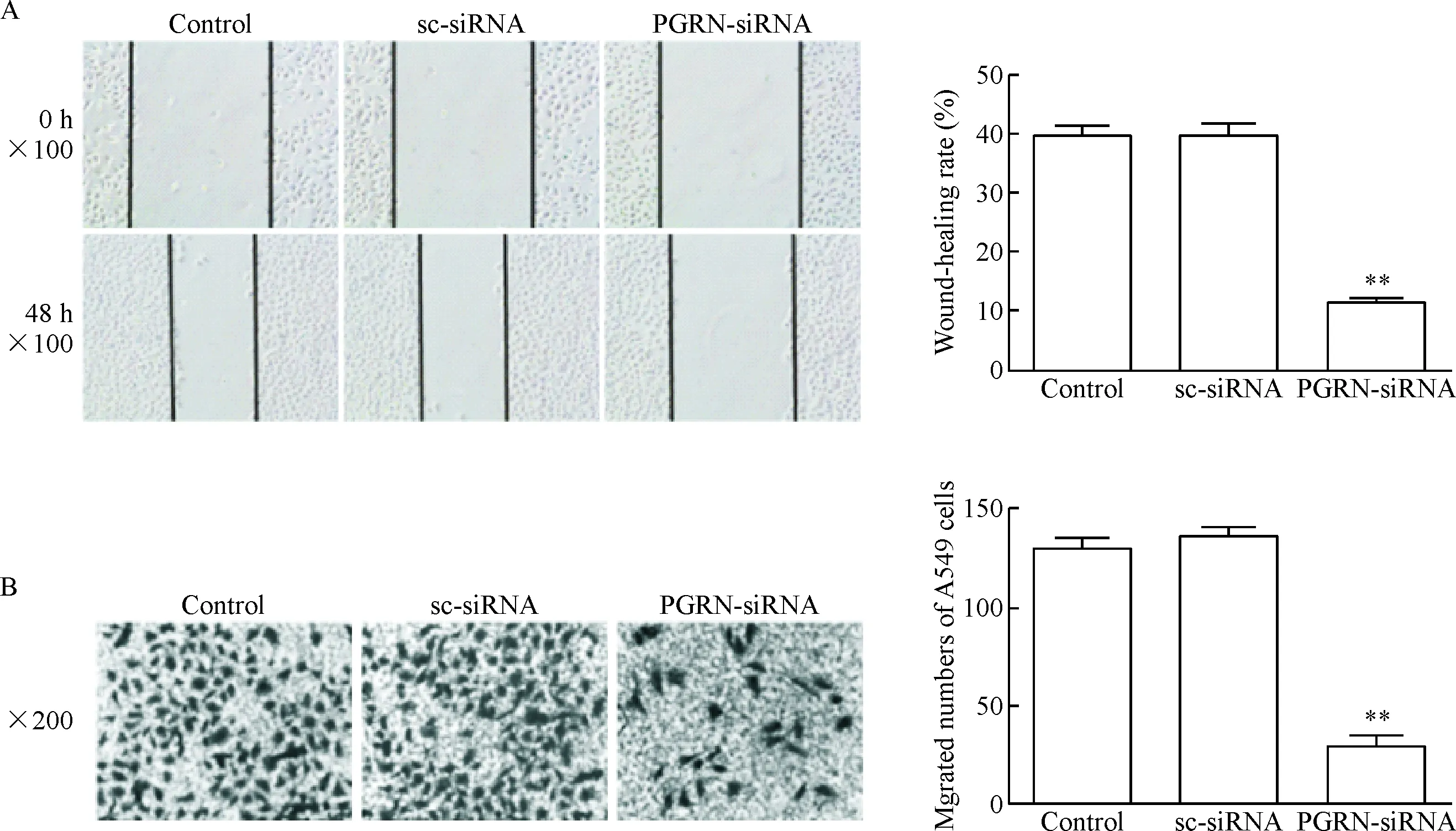
Figure 4. The migration ability was detected by wound-healing (A) and Transwell (B) assays in the A549 cells transfected with PGRN-siRNA or sc-siRNA. Mean±SD.n=3.**P<0.01vscontrol group.
图4干扰PGRN基因对A549细胞迁移能力的影响
讨 论
肺癌在我国的发病率近年来呈逐年上升的趋势,其死亡率也在逐年增加。肺癌的发生发展是一个多因素参与的复杂过程。目前临床上针对非小细胞肺癌的常用治疗手段为手术治疗辅助以放化疗,近年来小分子靶向药物治疗也广泛应用于临床。但是由于非小细胞肺癌具有隐匿性的特点,发病初期症状不明显,很多患者确诊时已是病程晚期,耽误了最佳治疗时期,使得治疗效果不佳[11]。随着人们对非小细胞肺癌研究的不断深入,生长因子家族在其发生发展中的作用被广泛认知。血管内皮生长因子C(vascular endothelial growth factor-C,VEGF-C)[12]、表皮生长因子[13]和转化生长因子[14]等均在非小细胞肺癌的发展进程中发挥着重要的作用。近年来发现PGRN也属于生长因子家族中的一员[4],它被证实在多种肿瘤中发挥着重要作用,如在肝癌中可以促进肝癌细胞的增殖和侵袭[15],在乳腺癌、卵巢癌和结直肠癌[10,16-17]中也有报道。研究发现这种促肿瘤效应可能与p44/42 MAPK和Akt信号通路的激活有关[6],但是具体作用机制不明。而PGRN在非小细胞肺癌中的作用以及具体作用机制也尚未见报道。
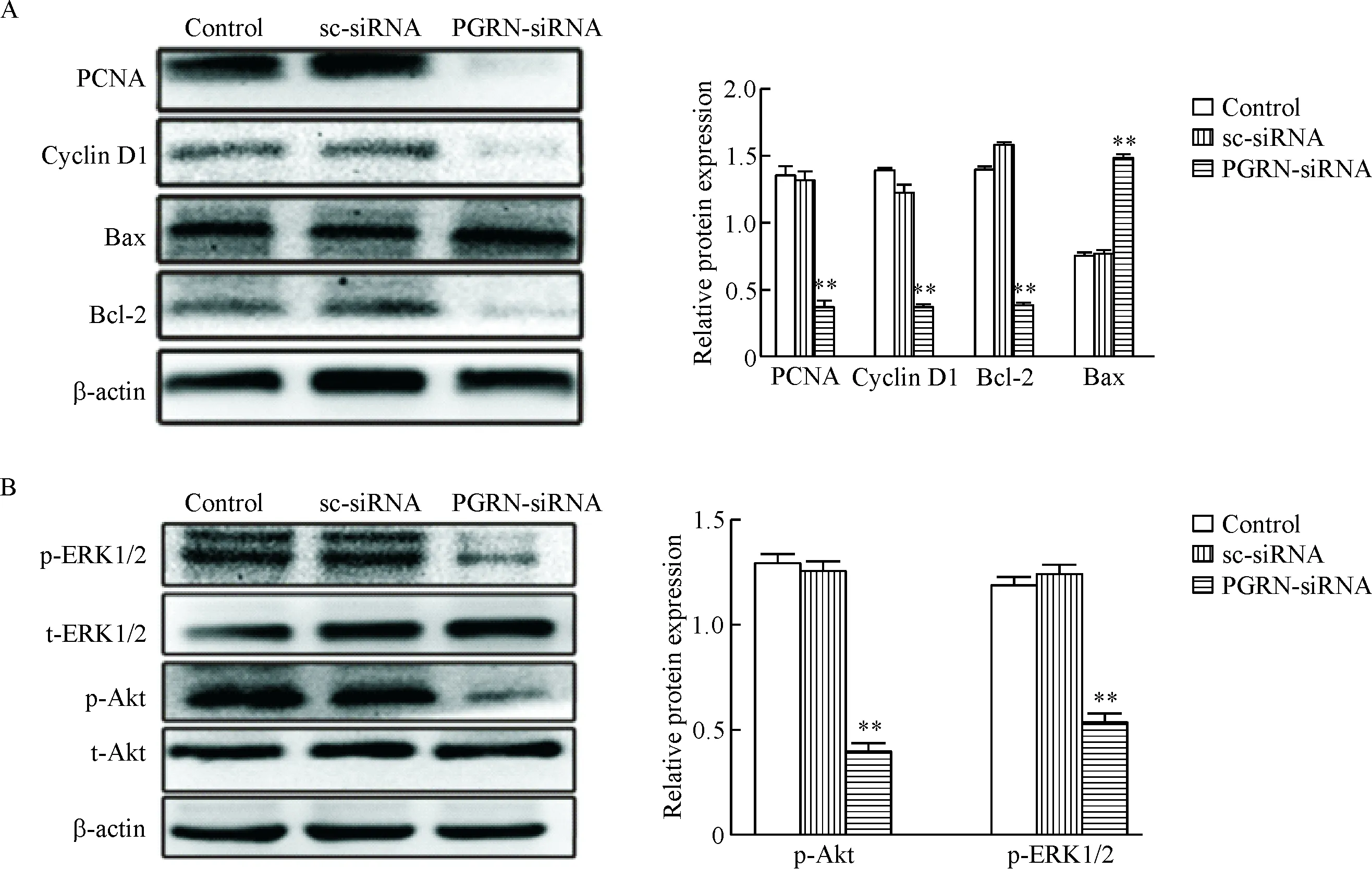
Figure 5. The effect of PGRN-siRNA on proliferation- and apoptosis-related factors and the protein levels of p-ERK1/2 and p-Akt in the A549 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图5干扰PGRN基因对A549细胞增殖和凋亡相关蛋白以及磷酸化ERK1/2和磷酸化Akt的蛋白表达的影响
本研究发现,与正常支气管上皮细胞株相比,PGRN的mRNA和蛋白水平在非小细胞肺癌细胞株A549中有明显的高表达,推测PGRN可能会参与非小细胞肺癌的发生发展。基于此本研究采用小干扰RNA特异性干扰A549细胞株中PGRN的表达,MTT实验检测到干扰PGRN后A549细胞株的活力显著降低;活细胞计数实验和结晶紫染色实验结果显示干扰PGRN后A549细胞株的增殖能力显著降低;而且,划痕愈合实验和Transwell实验表明干扰PGRN后A549细胞株的迁移能力显著降低;Western blot结果显示,在A549细胞株中特异性干扰PGRN的表达后,PCNA和cyclinD1的表达明显下降,在凋亡相关蛋白中,促凋亡蛋白Bax表达显著增加且抑凋亡蛋白Bcl-2表达明显降低。本实验表明,PGRN确实与非小细胞肺癌的发生发展有关。此外,本研究还发现,PGRN基因沉默后,A549细胞株中p-Akt和p-ERK1/2蛋白水平明显降低。这一实验结果说明 PI3K/Akt和MAPK/ERK 信号通路可能与PGRN调节非小细胞肺癌发生发展的过程有关。
综上所述,本实验证实PGRN基因沉默能够显著抑制非小细胞肺癌细胞株A549的增殖和迁移并促进细胞凋亡,这一作用机制可能与PI3K/Akt和MAPK/ERK信号通路的阻断有关。本实验为非小细胞肺癌的临床治疗提供了一个新的潜在靶点。但是PGRN的具体作用机制还有待于进一步研究探讨。
[参考文献]
[1] Wei S, Tian J, Song X, et al. Causes of death and competing risk analysis of the associated factors for non-small cell lung cancer using the Surveillance, Epidemiology, and End Results database[J]. J Cancer Res Clin Oncol, 2018, 144(1):145-155.
[2] Grabowski J, Glode A. Ramucirumab: a vacular endothelial growth factor receptor-2 inhibitor with activity in seve-ral malignancies[J]. Am J Health Syst Pharm, 2016, 73(13):957-968.
[3] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1):7-30.
[4] He Z, Bateman A. Progranulin (granulin-epithelin precursor, PC-cell-derived growth factor, acrogranin) me-diates tissue repair and tumorigenesis[J]. J Mol Med (Berl), 2003, 81(10):600-612.
[5] 尚立群, 张永庆, 苗 毅, 等. 过表达PGRN抑制LPS诱导的肺泡上皮细胞损伤[J]. 中国病理生理杂志, 2017, 33(5):877-883.
[6] Tang W, Lu Y, Tian QY, et al. The growth factor progranulin binds to TNF receptors and is therapeutic against inflammatory arthritis in mice[J]. Science, 2011, 332(6028):478-484.
[7] Monami G, Gonzalez EM, Hellman M, et al. Proepithelin promotes migration and invasion of 5637 bladder cancer cells through the activation of ERK1/2 and the formation of a paxillin/FAK/ERK complex[J]. Cancer Res, 2006, 66(14):7103-7110.
[8] Tangkeangsirisin W, Hayashi J, Serrero G. PC cell-derived growth factor mediates tamoxifen resistance and promotes tumor growth of human breast cancer cells[J]. Cancer Res, 2004, 64(5):1737-1743.
[9] Frampton G, Invernizzi P, Bernuzzi F, et al. Interleukin-6-driven progranulin expression increases cholangiocarcinoma growth by an Akt-dependent mechanism[J]. Gut, 2012, 61(2):268-277.
[10] Yang D, Wang LL, Dong TT, et al. Progranulin promotes colorectal cancer proliferation and angiogenesis through TNFR2/Akt and ERK signaling pathways[J]. Am J Cancer Res, 2015, 5(10):3085-3097.
[11] 许亚萍, 马胜林, 季永领, 等. 非小细胞肺癌脑转移不同治疗方法的疗效分析[J]. 中华放射医学与防护杂志, 2009, 29(1):71-74.
[12] Saintigny P, Kambouchner M, Ly M, et al. Vascular endothelial growth factor-C and its receptor VEGFR-3 in non-small-cell lung cancer: concurrent expression in cancer cells from primary tumour and metastatic lymph node[J]. Lung Cancer, 2007, 58(2):205-213.
[13] Nowicki-Osuch K, Li Y, Challinor M, et al. EINCR1 is an EGF inducible lincRNA overexpressed in lung adenocarcinomas[J]. PLoS One, 2017, 12(7):e0181902.
[14] Xu Y, Lou Z, Lee SH. Arctigenin represses TGF-β-induced epithelial mesenchymal transition in human lung cancer cells[J]. Biochem Biophys Res Commun, 2017, 493(2):934-939.
[15] Cheung ST, Wong SY, Leung KL, et al. Granulin epithelin precursor overexpression promotes growth and invasion of hepatocellular carcinoma[J]. Clin Cancer Res, 2004, 10(22):7629-7636.
[16] Lu R, Serrero G. Inhibition of PC cell-derived growth factor (PCDGF, epithelinygranulin precursor) expression by antisense PCDGF cDNA transfection inhibits tumorigenicity of the human breast carcinoma cell line MDA-MB-468[J]. Proc Natl Acad Sci U S A, 2000, 97(8):3993-3998.
[17] Liu Y, Xi L, Liao G, et al. Inhibition of PC cell-derived growth factor (PCDGF)/granulin-epithelin precursor (GEP) decreased cell proliferation and invasion through downregulation of cyclin D and CDK4 and inactivation of MMP-2[J]. BMC Cancer, 2007, 7:22.

