下调XBP1基因表达对脑胶质瘤细胞活力和凋亡的影响*
周林裕, 谢万福, 代永庆, 包志军, 胡 骁, 包春燕
(1西安交通大学医学院附属3201医院神经外科, 陕西 汉中 723000; 2西安交通大学第一附属医院神经外科, 陕西 西安 710061; 3西安交通大学医学院附属3201医院产科, 陕西 汉中 723000)
脑胶质瘤是常见的起源于神经外胚层的中枢神经系统恶性肿瘤,恶性程度高、死亡率高及治愈率低,目前多采用外科治疗与放化疗相结合的疗法,但治疗效果并不理想[1-2]。胶质瘤的发病由多种原癌基因和抑癌基因的功能和结构异常引起,是一种多基因的异常疾病。从分子生物学角度研究脑胶质瘤的发病机制具有重要意义。X盒结合蛋白1(X-box binding protein 1,XBP1)是一种重要的转录因子,因能结合于靶基因启动子序列的X盒而得名[3]。XBP1基因与肝癌和乳腺癌等人类多种肿瘤的发生有密切联系[4-5]。XBP1过表达可促进乳腺癌的生长和增殖[6],且与人食管鳞状细胞癌淋巴结转移相关[7]。然而,XBP1基因在脑胶质瘤中的研究较少。有研究发现,缺氧环境可上调XBP1的表达,沉默其表达可降低细胞活力和糖酵解,机制与上调过氧化氢有关,而过表达XBP1反之,可作为脑胶质瘤候选的分子靶点[8-9],但其对肿瘤细胞生物学特性的影响及机制研究的还未清楚。RNA干扰(RNA interference,RNAi)是由双链RNA诱导的、高度保守的、同源mRNA高特异性降解的现象,作为一种有效的基因阻断技术,对研究基因功能是较好的途径,目前已得到广泛应用[10-12]。本研究中首先检测了XBP1基因在脑胶质瘤组织和瘤旁组织的表达情况,接着通过RNAi技术抑制其表达,观察细胞活力、周期及凋亡的变化,并进一步研究对其增殖相关蛋白增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、凋亡相关蛋白B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)和Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、周期相关蛋白细胞周期素D1(cyclin D1)及磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(serine/protein kinase B,PKB;又称Akt)信号通路的影响,为脑胶质瘤的分子诊断及靶向治疗提供理论依据。
材 料 和 方 法
1 标本及细胞来源
44例脑胶质瘤组织及相应的瘤旁组织(距离肿瘤1 cm以上)来源于2014年3月~2016年7月西安交通大学医学院第一附属医院神经外科患者,其中男性26例,女性18例,年龄10~66岁,平均年龄36.9岁。所有肿瘤组织经过病理证实,且有完整的临床资料,所有患者术前均未行放疗和化疗。组织标本切除后置于-80 ℃冰箱保存。所有样品的采集均经过患者和家属及医院的伦理学通过。人脑胶质瘤U251细胞株购自中国科学院细胞库。
2 主要试剂和仪器
RPMI-1640培养基、TRIzol和LipofectamineTM2000转染试剂盒均购自Invitrogen;胎牛血清购自HyClone;CCK-8试剂盒购自Promega;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒购自北京天根;膜联蛋白V-FITC(annexin V-FITC)/碘化丙啶(propidium iodide,PI)试剂盒购自碧云天生物技术研究所;抗XBP1、PCNA、Bcl-2、 Bax、cyclin D1、PI3K和磷酸化Akt(phosphorylated, p-Akt)抗体均购自Abcam。酶标仪和流式细胞仪均购自Bio-Rad;荧光定量PCR仪购自Bioneer。
3 方法
3.1qPCR检测脑胶质瘤组织中XBP1的mRNA表达 TRIzol法提取脑胶质瘤及瘤旁组织中的总RNA,逆转录成cDNA,以GAPDH作为内参照,cDNA为模板,按照试剂盒的操作说明进行PCR扩增。Oligo 7.0软件设计XBP1和GAPDH的qPCR引物,所有引物由上海生工合成。XBP1的上游引物序列为5’-CCTGGTTGCTGAAGAGGAGG-3’, 下游引物序列为5’-CCATGGGGAGATGTTCTGGAG-3’;GAPDH的上游引物序列为5’-ATGACCCCTTCATTGACC-3’,下游引物序列为5’-GAAGATGGTGATGGGATTTC-3’。 PCR扩增条件为:95 ℃ 5 min;95 ℃ 30 s、60 ℃ 35 s,共40个循环;72 ℃延伸15 min,4 ℃保存。实验数据采用2-ΔΔCt法进行统计。
3.2细胞培养 U251细胞在37 ℃、5% CO2、95%饱和湿度的培养箱中用含有10%胎牛血清、100 mg/L链霉素和1×105U/L青霉素的RPMI-1640细胞培养基传代培养。实验为生长至对数期的细胞。
3.3siRNA转染及分组 以每孔5×104将生长至对数期的U251细胞接种至6孔细胞培养板中,置于37 ℃、5% CO2环境中用含有10%胎牛血清的RPMI-1640细胞培养基培养24 h,细胞生长至80%~90%融合进行转染。细胞转染按照LipofectamineTM2000转染说明进行操作。细胞分为正常对照(control)组(细胞无特殊处理),阴性对照(negative control-siRNA,NC-siRNA)组(转染不具有任何干扰作用的siRNA)和XBP1-siRNA组(转染干扰XBP1表达的siRNA)。
3.4Western blot实验 收集转染48 h的3组细胞,用qPCR检测3组细胞中XBP1的mRNA表达,检测方法同3.1;Western blot法检测XBP1的蛋白表达,操作步骤如下:细胞加入3~5倍预冷RIPA细胞裂解液制成匀浆,离心后取上清。取少量蛋白样品BCA试剂盒检测蛋白浓度。每泳道30 μg蛋白样品经10%的SDS-PAGE分离,转移至硝酸纤维素膜上,5%的脱脂奶粉封闭,4 ℃孵育抗XBP1、PCNA、Bcl-2、Bax、cyclin D1、PI3K、p-Akt(1∶1 000稀释)和GAPDH(1∶5 000稀释)抗体过夜,充分洗膜后加入辣根过氧化物酶标记的羊抗鼠IgG,再次洗膜后置于暗室中显影、定影。
3.5CCK-8实验检测细胞活力 收集转染48 h的3组细胞,每孔细胞中加入10 μL CCK-8试剂,37 ℃孵育4 h。空白对照孔调零,酶标仪检测各孔吸光度(A570)。实验重复3次。计算细胞存活率。细胞相对活力(%)=实验组细胞A值/空白对照组细胞A值×100%。
3.6流式细胞术测定细胞周期分布 取转染48 h的3组细胞,吸出原有培养基,磷酸缓冲液洗涤细胞后胰蛋白酶消化2~5 min,细胞浓度调整为1.0×109/L,75% 4 ℃预冷的乙醇固定细胞48 h,离心弃上清,磷酸缓冲液重悬细胞,加入50 μL RNase (0.5 g/L),37 ℃水浴30 min,磷酸缓冲液洗涤后重悬细胞,加入50 μL PI (1 g/L),4 ℃避光反应30 min,流式细胞术测定细胞周期,观察G1期、S期和G2期细胞各占的百分比,观察是否存在凋亡细胞及其所占比例。
3.7细胞凋亡检测 收集转染48 h的3组细胞,预冷的磷酸缓冲液洗涤细胞,0.25%的胰蛋白酶消化细胞,细胞密度调整为1×109/L,加入10 μL的annexin V-FITC,室温暗室染色15 min,上机前5 min加入10 mg/L的PI染液5 μL,流式细胞术检测细胞的凋亡情况。
4 统计学处理
所有实验数据采用SPSS 21.0软件进行分析,计量资料用均数±标准差(mean±SD)表示,两组比较用独立样本t检验,多组间差异比较采用单因素方差分析,多重比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 XBP1在脑胶质瘤组织中的表达
qPCR检测XBP1 mRNA在脑胶质瘤组织中的表达,结果显示,XBP1在脑胶质瘤组织中的mRNA表达显著高于瘤旁组织(P<0.05),见图1。

Figure 1. The mRNA expression of XBP1 in the brain glioma tissues. Mean±SD.n=44.*P<0.05vsperi-tumo-rous.
图1XBP1mRNA在脑胶质瘤组织中的表达
2 转染XBP1-siRNA后的U251细胞XBP1的表达
qPCR检测转染XBP1-siRNA后U251细胞XBP1的mRNA表达,Western bloting检测蛋白表达,结果显示,NC-siRNA组XBP1的mRNA及蛋白表达与control组差异无统计学显著性,而XBP1-siRNA组XBP1的mRNA及蛋白表达均显著低于control组和NC-siRNA组(P<0.05),见图2。
3 下调XBP1表达降低U251细胞活力
CCK-8法检测细胞活力的结果显示,NC-siRNA组的细胞存活率与control组比较差异无统计学显著性,而XBP1-siRNA组的细胞存活率显著低于control组和NC-siRNA组(P<0.05),见图3。
4 下调XBP1表达阻滞U251细胞周期并促进细胞凋亡
流式细胞术检测细胞周期及细胞凋亡,结果显示,NC-siRNA组的G0/G1期、S期和G2/M期细胞及细胞凋亡率与对照组比较差异无统计学显著性,而XBP1-siRNA组的G0/G1期细胞显著高于control组和NC-siRNA组,S期细胞显著低于control组NC-siRNA组,细胞凋亡率显著高于control组NC-siRNA组(P<0.05),见图4。
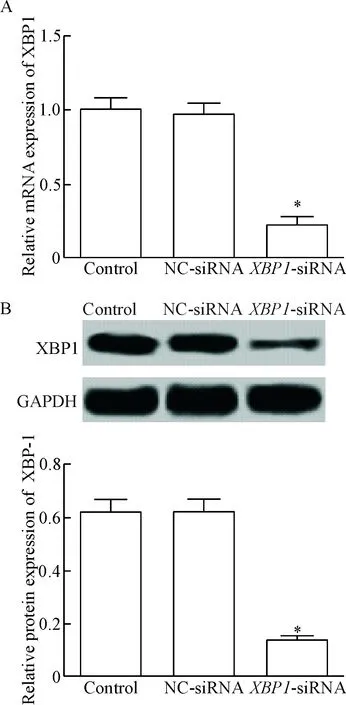
Figure 2. The mRNA (A) and protein (B) expression of XBP1 in the U251 cells transfected withXBP1-siRNA. Mean±SD.n=3.*P<0.05vscontrol group.
图2转染XBP1-siRNA后U251细胞XBP1的表达

Figure 3. The effect of down-regulation of XBP1 expression on the viability of U251 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3下调XBP1表达对U251细胞活力的影响
5 下调XBP1对PCNA、cyclin D1、Bcl-2和Bax蛋白表达的影响
Western blot检测增殖相关蛋白PCNA、凋亡相关蛋白Bcl-2和Bax及细胞周期蛋白cyclin D1的蛋白表达,结果显示,NC-siRNA组PCNA、cyclin D1、Bcl-2和Bax蛋白表达与control组差异无统计学显著性,XBP1-siRNA组PCNA、cyclin D1和Bcl-2蛋白表达显著低于control组和NC-siRNA组(P<0.05),Bax蛋白表达显著高于control组和NC-siRNA组(P<0.05),见图5。
6 下调XBP1表达抑制PI3K/Akt信号通路
Western blot检测PI3K/Akt信号通路PI3K和p-Akt的蛋白水平,结果示,NC-siRNA组PI3K和p-Akt的蛋白水平与control组比较差异无统计学显著性;XBP1-siRNA组PI3K和p-Akt的蛋白水平均显著低于control组和NC-siRNA组(P<0.05),见图6。
讨 论
脑胶质瘤是常见的颅内肿瘤,具有易复发及侵袭性的特性,由于其生长部位的特殊性,手术及放化疗药物均很难达到预期效果,而使脑胶质瘤成为神经系统难以治疗疾病之一[13-14]。肿瘤的发生是一个多阶段、多因素的复杂过程,包括抑癌基因、癌基因、DNA损伤修复基因的表观遗传变异及突变。XBP1是一个重要的内质网信号通路中的转录因子,属于ATF/CREB转录因子家族中一员,参与未折叠蛋白反应[15-16]。研究表明,在多种肿瘤中XBP1有高表达,影响肿瘤的发生发展[17-18],抑制XBP1的表达可降低肿瘤的发生及发展[19-20],如抑制人多发性骨髓瘤中XBP1的表达可促进细胞的凋亡[21]。脑胶质瘤中XBP1的表达显著高于在正常脑组织中的表达,XBP1可通过上调抗氧化分子对胶质瘤的抗氧化应激损伤起保护作用,抑制其表达并联合使用活性氧诱导剂三氧化二砷可协同治疗脑胶质瘤[22-23]。XBP1对脑胶质瘤潜在的作用还未清楚。
为了研究XBP1在脑胶质瘤中的生物学特性,本研究首先检测了脑胶质瘤组织相对于瘤旁组织的表达情况,发现脑胶质瘤组织中XBP1的表达显著高于瘤旁组织。关于抑制XBP1表达对脑胶质瘤生物学特性的影响研究还未清楚。因此,通过RNA干扰技术抑制脑胶质瘤细胞中XBP1的表达,检测细胞活力、周期及凋亡的变化,发现XBP1的表达受到抑制后细胞活力显著降低,细胞凋亡增加,且发生G1期阻滞。细胞增殖、凋亡和周期受到多种基因的调控。PCNA为增殖期细胞特异性表达的核蛋白,特异性S期的标志,其表达与合成与细胞增殖率、肿瘤细胞的生长和侵袭能力及DNA合成密切相关,已在多种肿瘤中作为检测细胞增殖的标志[24-25]。Cyclin D1是G1期细胞周期素,主要促进细胞通过G1/S检查点,作为在肿瘤的发生及发展过程中正调控细胞周期的重要因子发挥作用,目前已在多种肿瘤中被证实是检测预后的重要指标[26-27]。细胞凋亡是细胞在内源及外源信号刺激后所发生的一种程序性死亡过程,在众多疾病,尤其是肿瘤的发生发展及转归过程中具有重要作用。Bcl-2家族在细胞凋亡过程中发挥重要作用,其家族成员的比率对细胞凋亡起关键作用,尤其是Bcl-2/Bax的比例是启动细胞凋亡的关键因素。Bcl-2是Bcl-2家族的抑凋亡基因,Bax是Bcl-2家族的促凋亡基因。Bcl-2和Bax可以通过形成异源或同源二聚体调节细胞凋亡。当Bcl-2表达减少而Bax表达增加,促进细胞凋亡,反之则抑制细胞凋亡[28-30]。本研究发现,XBP1的表达受到抑制后,PCNA、Bcl-2和cyclin D1蛋白表达下调,Bax蛋白表达上调。这提示抑制XBP1表达降低细胞活力、诱导细胞凋亡及阻滞细胞周期的方式是下调PCNA、Bcl-2和cyclin D1表达,上调Bax表达。
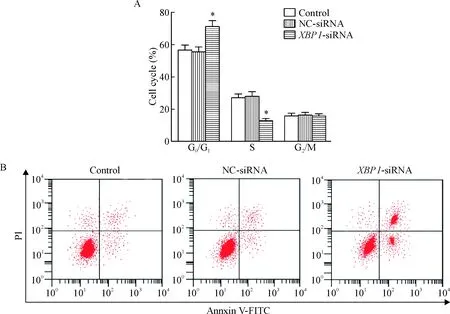
Figure 4. Effects of down-regulation of XBP1 expression on cell cycle and apoptosis of the U251 cells. A: the quantitative analysis of the cell cycle distribution; B: the images of flow cytometry for detecting the cell apoptosis. Mean±SD.n=3.*P<0.05vscontrol group.
图4下调XBP1表达对U251细胞周期及凋亡的影响
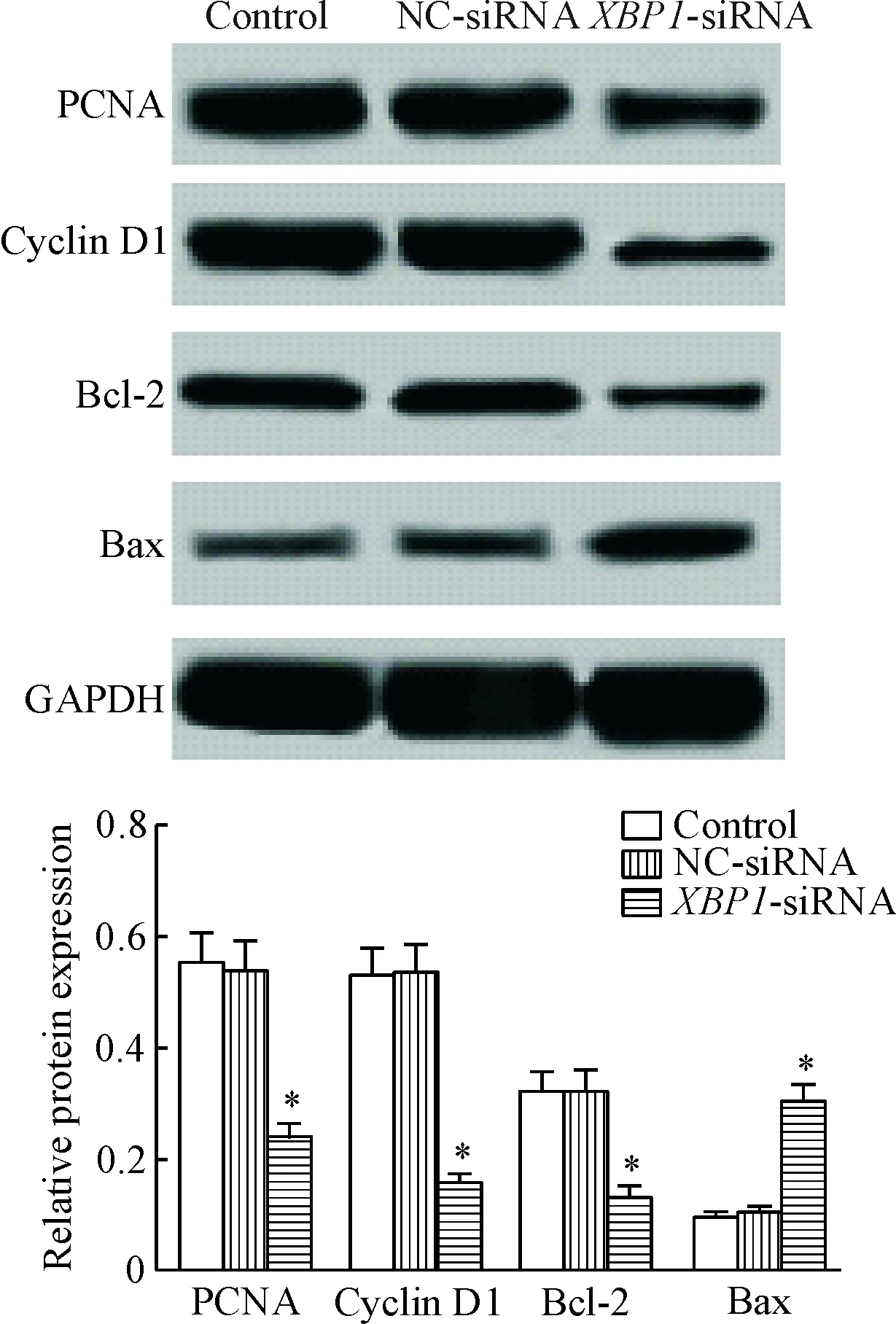
Figure 5. The effect of down-regulation of XBP1 on the protein expression of PCNA, Bcl-2, Bax and cyclin D1. Mean±SD.n=3.*P<0.05vscontrol group.
图5下调XBP1对PCNA、Bcl-2、Bax和cyclinD1蛋白表达的影响

Figure 6. The effect of down-regulation of XBP1 expression on PI3K/Akt signaling pathway. Mean±SD.n=3.*P<0.05vscontrol group.
图6下调XBP1表达对PI3K/Akt信号通路的影响
PI3K/Akt信号通路是一个经典的细胞信号转导通路,在肿瘤发生及发展过程中有重要作用,其通路中相关的分子及基因表达异常可引起肿瘤细胞的增殖、凋亡及侵袭的异常[31]。在多种肿瘤中 PI3K/Akt信号通路处于激活状态,如胃癌、脑胶质瘤和卵巢癌等,其激活可促进肿瘤的发生及发展[32-34]。脑胶质瘤中抑制PI3K/Akt信号通路可抑制肿瘤细胞的增殖及促进其凋亡[35-36]。PI3K在细胞中广泛存在,其激活可促进细胞的增殖、分化和抑制细胞凋亡,通过激活磷酸化的Akt抑制或激活下游靶蛋白而发挥抗凋亡作用。XBP1是否可通过调控PI3K/Akt信号通路影响脑胶质瘤细胞的生物学特性还未可知。因此,本研究检测了PI3K/Akt信号通路PI3K和p-Akt的蛋白水平,发现抑制XBP1基因表达可显著降低PI3K和p-Akt的蛋白水平。
综上所述,XBP1基因在脑胶质瘤中高表达,抑制其表达可通过下调PI3K/Akt信号通路降低肿瘤细胞的增殖,阻滞细胞于G1期,并促进细胞的凋亡;其抑制细胞增殖、诱导细胞凋亡及阻滞细胞周期的机制是下调PCNA、Bcl-2和cyclin D1表达,上调Bax表达。本研究为进一步探讨XBP1在脑胶质瘤中的生物学特性提供了实验数据,可能是脑胶质瘤治疗的一个理想分子靶点,其它的生物学特性及在体内实验的作用值得进一步深入探讨。
[参考文献]
[1] Wang K, Wang X, Zou J, et al. miR-92b controls glioma proliferation and invasion through regulating Wnt/beta-catenin signaling via Nemo-like kinase[J]. Neuro Oncol, 2013, 15(5):578-588.
[2] 张国荣. 复发脑胶质瘤的影像诊断与治疗进展[J]. 立体定向和功能性神经外科杂志, 2015, 47(1):55-58.
[3] Cubillos-Ruiz JR, Silberman PC, Rutkowski MR, et al. ER stress sensor XBP1 controls anti-tumor immunity by disrupting dendritic cell homeostasis[J]. Cell, 2015, 161(7):1527-1538.
[4] Olivares S, Henkel AS. Hepatic Xbp1 gene deletion promotes endoplasmic reticulum stress-induced liver injury and apoptosis[J]. J Biol Chem, 2015, 290(50):30142-30151.
[5] Gambella M, Rocci A, Passera R, et al. High XBP1 expression is a marker of better outcome in multiple myeloma patients treated with bortezomib[J]. Haematologica, 2014, 99(2):e14-e16.
[6] Hasegawa D, Calvo V, Avivar-Valderas A, et al. Epithelial Xbp1 is required for cellular proliferation and differentiation during mammary gland development[J]. Mol Cell Biol, 2015, 35(9):1543-1556.
[7] Xia T, Tong S, Fan K, et al. XBP1 induces MMP-9 expression to promote proliferation and invasion in human esophageal squamous cell carcinoma[J]. Am J Cancer Res, 2016, 6(9):2031-2040.
[8] Liu Y, Hou X, Liu M, et al. XBP1 silencing decreases glioma cell viability and glycolysis possibly by inhibiting HK2 expression[J]. J Neurooncol, 2016, 126(3):455-462.
[9] Liu Y, Zhang X, Liang Y, et al. Targeting X box-binding protein-1 (XBP1) enhances sensitivity of glioma cells to oxidative stress.[J]. Neuropathol Appl Neurobiol, 2011, 37(4):395-405.
[10] Li R, Yang HQ, Xi HL, et al. Inhibition of CDH17 gene expression via RNA interference reduces proliferation and apoptosis of human MKN28 gastric cancer cells[J]. Int J Oncol, 2017, 50(1):15-22.
[11] 张传海, 桂 阳, 郭凤林, 等.EGFR基因knockdown对肝癌细胞 MHCC-97H 侵袭迁移能力的影响[J]. 安徽医科大学学报, 2017, 52(8):1133-1137.
[12] 李天客, 陈 中, 包 阳, 等. RNA干扰SBF2对人口腔癌细胞株SCC15增殖、凋亡及侵袭的影响[J]. 中国老年学杂志, 2016, 36(21):5260-5262.
[13] 何 露, 温创宇, 王慧慧, 等. 土槿皮乙酸诱导脑胶质瘤细胞株 U87 阻滞于 M 期并发生凋亡[J]. 中国病理生理杂志, 2016, 32(9):1574-1578.
[14] Pyonteck SM, Akkari L, Schuhmacher AJ, et al. CSF-1R inhibition alters macrophage polarization and blocks glioma progression[J]. Nat Med, 2013, 19(10): 1264-1272.
[15] Bettigole SE, Glimcher LH. Novel roles for XBP1 in hematopoietic development[J]. Cell Cycle, 2016, 15(13):1653-1654.
[16] Gregor MF, Misch ES, Yang L, et al. The role of adipocyte XBP1 in metabolic regulation during lactation[J]. Cell Rep, 2013, 3(5):1430-1439.
[17] Cubillos-Ruiz JR, Bettigole SE, Glimcher LH. Molecular pathways: immunosuppressive roles of IRE1α-XBP1 signaling in dendritic cells of the tumor microenvironment[J]. Clin Cancer Res, 2016, 22(9):2121-2126.
[18] Chen W, Zhou J, Wu K, et al. Targeting XBP1-mediated β-catenin expression associated with bladder cancer with newly synthetic Oridonin analogues[J]. Oncotarget, 2016, 7(35):56842-56854
[19] Bujisic B, De Gassart A, Tallant R, et al. Impairment of both IRE1 expression and XBP1 activation is a hallmark of GCB DLBCL and contributes to tumor growth[J]. Blood, 2017, 129(17):2420-2428.
[20] Duan Q, Ni L, Wang P, et al. Deregulation of XBP1 expression contributes to myocardial vascular endothelial growth factor-A expression and angiogenesis during cardiac hypertrophyinvivo[J]. Aging cell, 2016, 15(4):625-633.
[21] Leung-Hagesteijn C, Erdmann N, Cheung G, et al. Xbp1s-negative tumor B cells and pre-plasmablasts me-diate therapeutic proteasome inhibitor resistance in multiple myeloma[J]. Cancer Cell, 2013, 24(3):289-304.
[22] 王 宇. 抑制XBP1基因增强胶质瘤细胞对三氧化三砷敏感性的实验研究[D]. 哈尔滨医科大学, 2012.
[23] Bandey I, Chiou SH, Huang AP, et al. Progranulin promotes temozolomide resistance of glioblastoma by orchestrating DNA repair and tumor stemness[J]. Oncogene, 2015, 34(14):1853-1864.
[24] 胡文龙, 吴平平, 耿书国, 等. 人脐带间充质干细胞分泌白细胞介素 6 促进骨肉瘤细胞增殖和迁移[J]. 中国病理生理杂志, 2016, 32(2):201-207.
[25] Goellner EM, Smith CE, Campbell CS, et al. PCNA and Msh2-Msh6 activate an Mlh1-Pms1 endonuclease pathway required for Exo1-independent mismatch repair[J]. Mol Cell, 2014, 55(2):291-304.
[26] Pestell RG. New roles of cyclin D1[J]. Am J Pathol, 2013, 183(1):3-9.
[27] French JD, Ghoussaini M, Edwards SL, et al. Functional variants at the 11q13 risk locus for breast cancer regulate cyclin D1 expression through long-range enhancers[J]. Am J Human Genetics, 2013, 92(4):489-503.
[28] Czabotar PE, Lessene G, Strasser A, et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy[J]. Nat Rev Mol Cell Biol, 2014, 15(1): 9-63.
[29] 惠 毅, 闫曙光, 王晓龙. 乌梅丸对溃疡性结肠炎大鼠结肠上皮细胞凋亡和 Bcl-2/Bax 蛋白表达的影响[J]. 中华中医药学刊, 2016, 34(1):149-151.
[30] Jiang H, Zhao PJ, Su D, et al. Paris saponin I induces apoptosis via increasing the Bax/Bcl-2 ratio and caspase3 expression in gefitinibresistant nonsmall cell lung cancerinvitroandinvivo[J]. Mol Med Rep, 2014, 9(6):2265-2272.
[31] McMullen JR, Boey EJ, Ooi JY, et al. Ibrutinib increases the risk of atrial fibrillation, potentially through inhibition of cardiac PI3K-Akt signaling[J]. Blood, 2014, 124(25):3829-3830.
[32] Cao W, Yang W, Fan R, et al. miR-34a regulates cisplatin-induce gastric cancer cell death by modulating PI3K/AKT/survivin pathway[J]. Tumor Biol, 2014, 35(2):1287-1295.
[33] 汲乾坤, 李建斌, 范阳华, 等. 下调CENP-W对人脑胶质瘤U87细胞的影响[J]. 中国病理生理杂志, 2017, 33(2):263-270.
[34] Wang W, Ren F, Wu Q, et al. MicroRNA-497 suppresses angiogenesis by targeting vascular endothelial growth factor A through the PI3K/Akt and MAPK/ERK pathways in ovarian cancer[J]. Oncol Rep, 2014, 32(5):2127-2133.
[35] Cai H, Xue Y, Li Z, et al. Roundabout4 suppresses glioma-induced endothelial cell proliferation, migration and tube formationinvitroby inhibiting VEGR2-mediated PI3K/AKT and FAK signaling pathways[J]. Cell Physiol Biochem, 2015, 35(5):1689-1705.
[36] Moon SH, Kim DK, Cha Y, et al. PI3K/Akt and Stat3 signaling regulated by PTEN control of the cancer stem cell population, proliferation and senescence in a glioblastoma cell line[J]. Int J Oncol, 2013, 42(3):921-928.

