人参二醇组皂苷对再生障碍性贫血小鼠造血组织MAPK/ERK信号通路的诱导作用*
张爱萍, 高瑞兰, 尹利明, 罗梅宏, 成 志, 夏乐敏, 郑智茵△
(1上海市宝山区中西医结合医院, 上海 201999; 2浙江中医药大学附属第一医院, 浙江 杭州 310006;3浙江中医药大学附属第二医院, 浙江 杭州 310003)
再生障碍性贫血(aplastic anemia,AA)简称再障,是血液系统疾病中常见难治病之一。流行病学上,东南亚国家再障的发病率较发达国家明显增加,欧洲国家再障的发病率为0.2/106,而在中国再障的发病率约为欧美的3倍[1]。目前再障的治疗主要包括免疫抑制剂治疗(如环孢素)、促进造血治疗(如雄激素)、造血干细胞移植等,但现实中造血干细胞移植受HLA匹配供者来源少、费用昂贵等限制,而常用西药免疫抑制剂和雄激素等常因诸多不良反应而无法长期使用。因此,寻求安全有效的新的治疗方法和中药新药很有必要。
再障的发病机制涉及多种信号通路,其中细胞内丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路可能是涉及再障发生和发展比较重要的信号转导通路。本实验室前期采用双向电泳质谱分析法对再障小鼠骨髓有核细胞总蛋白分析后也发现,膜联蛋白A1的表达水平异常上升;膜联蛋白A1是一种钙依赖的磷脂结合多功能蛋白,可以调节脂多糖诱导的信号通路和MAPK/ERK信号通路,提示MAPK/ERK信号通路的异常可能与再障的发病机制有关。人参二醇组皂苷(pana-xadiol saponins,PDS)是本项目组自行从中药人参中提取的有效成分,本实验室前期研究表明PDS能够有效地促进再障模型小鼠骨髓造血功能恢复及刺激造血祖细胞增殖[2]。临床上用PDS治疗慢性再障的疗效显著,能够部分代替雄激素[3]。此外,我们已报道PDS可能通过恢复再障模型小鼠T细胞比例失衡状态而参与免疫调节[4],但PDS对再障小鼠MAPK/ERK信号通路的诱导作用尚未见报道。本文通过观察PDS对免疫介导型再障小鼠骨髓造血功能及脾脏调节性T细胞的影响,探索其对再障小鼠骨髓细胞MAPK/ERK信号通路蛋白激酶及对脾脏调节性T细胞的诱导作用,试图验证PDS 治疗再障的有效性及可能的作用机制。
材 料 和 方 法
1 实验动物和药物
近交系BALB/c小鼠(H2d, MLSb),雌雄兼用,8~10周龄,体重17~20 g,作为受者。DBA/2小鼠(H2d, MLSa),8~10周龄,雌雄兼用,作为供者。以上动物均购自浙江中医药大学实验动物中心,动物合格证编号为SCXK(沪)2013-0016。
PDS干燥粉剂由浙江中医药大学附属第一医院血研所提供,批号为20130316;阳性对照药环孢素A(ciclosporin A,CsA)由杭州中美华东制药公司生产,批号为H10960221。药物均在临用前用生理盐水配制,现配现用。
2 主要试剂和仪器
TEMED和NC膜(Promega);Western marker(Bio-Rad);抗β-actin抗体(Signalway Antibody);丙烯酰胺、N,N’-亚甲双丙烯酰胺和Tris(Sangon);抗MEK1/2、p-MEK1/2(Ser221)、ERK1/2和p-ERK1/2(Thr202/Tyr204)单克隆抗体(CST);辣根过氧化物酶标记的山羊抗兔IgG(联科公司);ECL试剂盒(Biological Industries);FITC标记的抗鼠CD4抗体(CD4-FITC)、PE标记的抗鼠CD25抗体(CD25-PE)、APC标记的抗鼠Foxp3抗体(Foxp3-APC)以及相应的同型阴性对照抗体(eBioscience)。PENTRA 80血液分析仪(ABX);电泳仪、垂直电泳装置、转膜装置和全自动凝胶成像系统(Bio-Rad);流式细胞仪(BD);显微镜及倒置显微镜(Olympus)。
3 方法
3.1按照本研究所建立的方法[5]制备免疫介导的再障小鼠模型 将[60Co]-γ射线5.0 Gy (1 Gy/min,5 min)全身照射BALB/c小鼠5 min,照射后4 h 内经小鼠尾静脉输入DBA/2小鼠胸腺和淋巴结混合细胞悬液(浓度为5×109/L)0.2 mL。
3.2PDS治疗后外周血细胞计数的检测 实验分6组,包括正常(normal)组,再障模型(AA)组,PDS低、中、高剂量治疗组(PDS 20、40、80 mg·kg-1·d-1),环孢素组(CsA, 50 mg·kg-1·d-1)阳性对照组,每组10只。各组小鼠经不同药物连续灌胃治疗14 h后,尾静脉取血,用血液分析仪检测各组小鼠的白细胞(white blood cells,WBC)、血红蛋白(hemoglobin,Hb)和血小板(platelet,PLT)计数。
3.3骨髓病理切片的制作 取各组小鼠双侧股骨,置于苦味酸-多聚甲醛固定液中固定,稀盐酸脱钙,常规石蜡包埋后切片,HE染色,中性塑胶封片,显微镜下观察骨髓造血组织增生情况。
3.4Western blot法检测蛋白水平 收集各组小鼠骨髓细胞,提取细胞总蛋白,测定蛋白含量,SDS-PAGE,转膜(4 ℃、100 V电压、70 min),封闭1 h, I 抗孵育(兔抗鼠MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2抗体,均1∶1 000稀释),4 ℃过夜,加入II抗(辣根过氧化物酶标记的抗兔IgG,1∶3 000稀释),37 ℃孵育1 h,ECL反应,Quantity One软件进行灰度值分析,并以小鼠肌动蛋白β-actin条带为内参照进行蛋白上样量的校正,进行半定量分析。
3.5免疫组织化学(SP法)实验 小鼠股骨经常规脱水,石蜡包埋并切片,灭活内源性酶,热修复抗原,加入 I 抗(抗MEK1/2抗体,1∶100稀释;抗p-MEK1/2抗体,1∶50稀释;抗ERK1/2抗体,1∶200稀释;抗p-ERK1/2抗体,1∶400稀释)37 ℃孵育1 h,加入 II 抗(辣根过氧化物酶连接的抗兔IgG,1∶50稀释)37 ℃孵育1 h,DAB显色,苏木苏复染,光学显微镜下观察,免疫反应阳性细胞将显示为棕黄色胞质浓染,细胞核不着色,阳性细胞密度(positive cell density,PCD)=阳性细胞数/阳性细胞面积,提示蛋白表达强度。
3.6流式细胞术 收集各组小鼠脾脏,制备脾脏单个细胞悬液,收集细胞数20 000个/管,在FSC-SCC散点图上选定T淋巴细胞群,以CD4和SSC设门选择CD4+细胞分析CD25和Foxp3表达,采用流式细胞仪进行检测,应用CellQuest软件分析各组小鼠脾脏中调节性T细胞占CD4+细胞比例。
4 统计学处理
数据用SPSS 17.0统计软件进行处理分析,定量资料用均数±标准差(mean±SD)描述,多组间比较采用方差分析,有差异者进一步两两比较采用SNK法,以P<0.05为差异有统计学意义。
结 果
1 PDS升高再障小鼠外周血细胞计数
与正常对照组比较,再障模型组小鼠外周血WBC、Hb和PLT计数均明显减少(P<0.05),符合再障的血象特点。与模型组比较,PDS低、中、高剂量治疗组的WBC、Hb和PLT计数均明显升高(P<0.05);其中,PDS高剂量组的作用最明显,WBC、Hb和PLT计数均显著高于PDS中剂量组(P<0.05)。阳性对照药环孢素治疗后外周血象也明显高于再障模型组(P<0.05),但其作用不如PDS高剂量组,见表1。
表1PDS治疗后各组小鼠外周血象计数的比较
Table 1. Diffrent doses of PDS elevated the peripheral blood hemoglobin (Hb) concentration and cell counts in the AA mice (Mean±SD.n=10)
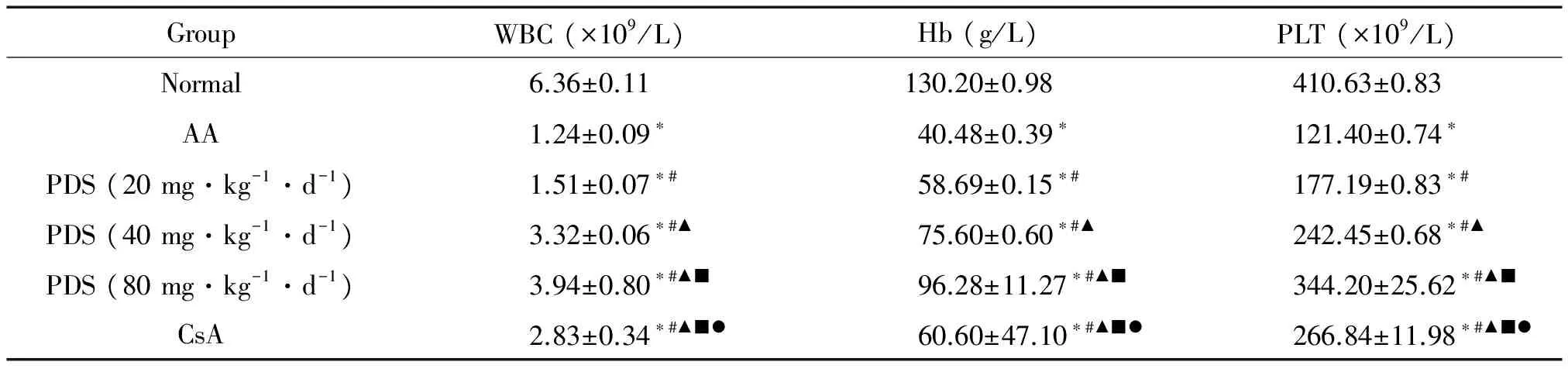
GroupWBC(×109/L)Hb(g/L)PLT(×109/L)Normal6.36±0.11130.20±0.98410.63±0.83AA1.24±0.09∗40.48±0.39∗121.40±0.74∗PDS(20mg·kg-1·d-1)1.51±0.07∗#58.69±0.15∗#177.19±0.83∗#PDS(40mg·kg-1·d-1)3.32±0.06∗#▲75.60±0.60∗#▲242.45±0.68∗#▲PDS(80mg·kg-1·d-1)3.94±0.80∗#▲■96.28±11.27∗#▲■344.20±25.62∗#▲■CsA2.83±0.34∗#▲■●60.60±47.10∗#▲■●266.84±11.98∗#▲■●
*P<0.05vsnormal group;#P<0.05vsAA group;▲P<0.05vsPDS (20 mg·kg-1·d-1) group;■P<0.05vsPDS (40 mg·kg-1·d-1) group;●P<0.05vsPDS (80 mg·kg-1·d-1) group.
2 PDS减轻再障小鼠骨髓抑制,促进造血功能恢复
镜下可见,正常组小鼠骨髓增生活跃,造血细胞量丰富,分布均匀,骨髓造血组织结构完整,未见明显的脂肪组织。再障模型组骨髓增生极度低下,造血细胞量明显减少,出现大量空白区,被脂肪组织代替,造血细胞量显著减少,符合再障的骨髓病理学特征。PDS低剂量组可见网状造血组织增生,造血细胞数量较模型组逐渐增加,脂肪组织减少。PDS中、高剂量组可见骨髓增生程度明显好转,三系均有明显增生,少量非造血组织及脂肪细胞,造血组织基本结构明显修复。环孢素治疗组可见骨髓增生程度好转,造血细胞数量均有少量回升,脂肪组织较模型组减少,见图1。
3 Western blot实验结果
Western blot实验结果显示,再障模型组小鼠骨髓细胞MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白水平明显下降,与正常小鼠组相比差异显著(P<0.05)。各治疗组与模型组比较,骨髓细胞MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白水平均有不同程度升高(P<0.05),见图2、表2。
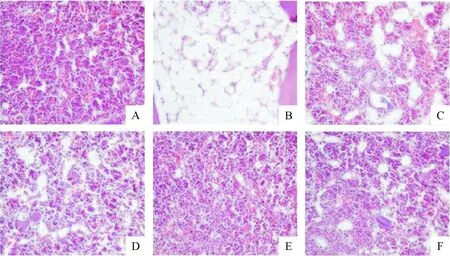
Figure 1. PDS attenuated myelosuppression status in the AA mice (HE staining, ×200). A: normal group; B: AA group; C: PDS (20 mg·kg-1·d-1) group; D: PDS (40 mg·kg-1·d-1) group; E: PDS (80 mg·kg-1·d-1) group; F: CsA group.
图1PDS治疗后各组小鼠骨髓病理切片观察
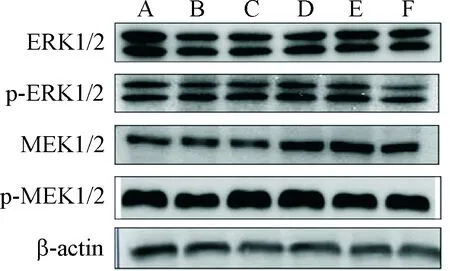
Figure 2. PDS up-regulated the protein levels of MEK1/2, p-MEK1/2, ERK1/2 and p-ERK1/2 in the bone marrow cells of AA mice determined by Western blot. A: normal group; B: AA group; C: PDS (20 mg·kg-1·d-1) group; D: PDS (40 mg·kg-1·d-1) group; E: PDS (80 mg·kg-1·d-1) group; F: CsA group.
图2Westernblot检测PDS对再障小鼠骨髓细胞MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白水平的影响
4 免疫组织化学实验结果
免疫组化结果显示,与正常对照组比较,模型组骨髓切片MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白的表达均微弱,明显低于正常对照组(P<0.05)。PDS中、高剂量组小鼠骨髓切片MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白的表达逐渐增强,阳性强度均高于模型组(P<0.05),其中PDS高剂量组的作用最明显(P<0.05),见图3、表3。
5 PDS提高再障小鼠脾脏中调节性T细胞的比例
与正常对照组小鼠相比,再障模型组小鼠脾脏中CD4+细胞比例和CD4+CD25+Foxp3+/CD4+细胞比例明显下降(P<0.05),符合再障免疫异常特点。与模型组比较,PDS低、中、高剂量治疗组的脾脏中CD4+细胞比例和CD4+CD25+Foxp3+/CD4+细胞比例均明显升高(P<0.05);PDS高剂量组的作用最明显,脾脏中CD4+细胞比例和CD4+CD25+Foxp3+/CD4+细胞比例显著高于再障模型组(P<0.05),其作用与阳性对照药环孢素相近,见表4。
表2Westernblot检测PDS对再障小鼠骨髓细胞MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白水平的影响
Table 2. PDS up-regulated the protein levels of MEK1/2, p-MEK1/2, ERK1/2 and p-ERK1/2 in bone marrow cells of AA mice determined by Western blot (Mean±SD.n=5)
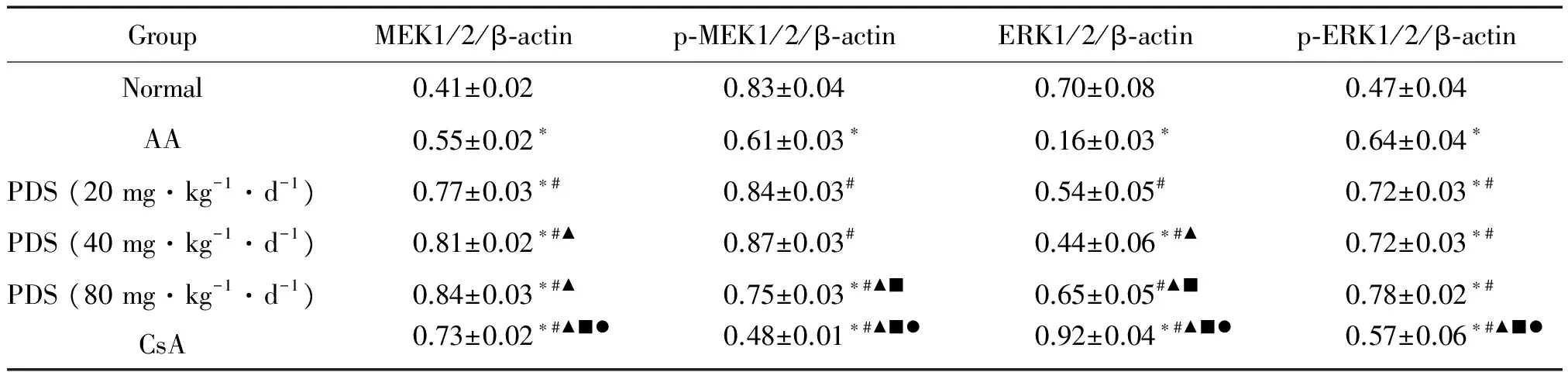
GroupMEK1/2/β⁃actinp⁃MEK1/2/β⁃actinERK1/2/β⁃actinp⁃ERK1/2/β⁃actinNormal0.41±0.020.83±0.040.70±0.080.47±0.04AA0.55±0.02∗0.61±0.03∗0.16±0.03∗0.64±0.04∗PDS(20mg·kg-1·d-1)0.77±0.03∗#0.84±0.03#0.54±0.05#0.72±0.03∗#PDS(40mg·kg-1·d-1)0.81±0.02∗#▲0.87±0.03#0.44±0.06∗#▲0.72±0.03∗#PDS(80mg·kg-1·d-1)0.84±0.03∗#▲0.75±0.03∗#▲■0.65±0.05#▲■0.78±0.02∗#CsA0.73±0.02∗#▲■●0.48±0.01∗#▲■●0.92±0.04∗#▲■●0.57±0.06∗#▲■●
*P<0.05vsnormal group;#P<0.05vsAA group;▲P<0.05vsPDS (20 mg·kg-1·d-1) group;■P<0.05vsPDS (40 mg·kg-1·d-1) group;●P<0.05vsPDS (80 mg·kg-1·d-1) group.

Figure 3. PDS up-regulated the protein levels of MEK1/2, p-MEK1/2, ERK1/2 and p-ERK1/2 in the bone marrow of AA mice tested by immunohistochemistry (×400). 1: normal group; 2: AA group; 3: PDS (20 mg·kg-1·d-1) group; 4: PDS (40 mg·kg-1·d-1) group; 5: PDS (80 mg·kg-1·d-1) group; 6: CsA group; A: MEK1/2; B: p-MEK1/2; C: ERK1/2; D: p-ERK1/2.
图3免疫组织化学法观察PDS上调再障小鼠骨髓MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2的蛋白水平
表3免疫组织化学法检测PDS上调再障小鼠骨髓MEK1/2、p-MEK1/2、ERK1/2、p-ERK1/2的蛋白水平
Table 3. PDS up-regulated the protein levels of MEK1/2, p-MEK1/2, ERK1/2 and p-ERK1/2 in the bone marrow of AA mice tested by immunohistochemistry (cells/0.01 mm2. Mean±SD.n=5)

GroupMEK1/2p⁃MEK1/2ERK1/2p⁃ERK1/2Normal18.06±0.7114.54±0.7518.78±0.4117.84±0.56AA9.84±0.84∗8.74±0.65∗12.18±0.75∗12.78±0.57∗PDS(20mg·kg-1·d-1)10.56±0.65∗9.14±0.56∗12.84±1.03∗13.96±1.10∗#PDS(40mg·kg-1·d-1)14.92±0.48∗#▲12.52±0.61∗#▲14.54±0.69∗#▲15.10±0.93∗#PDS(80mg·kg-1·d-1)19.02±0.69∗#▲■15.06±1.40#▲■18.66±0.59#▲■18.36±0.47#▲■CsA13.80±0.68∗#▲■●14.70±0.60#▲■14.10±1.12∗#▲●15.16±0.76∗#●
*P<0.05vsnormal group;#P<0.05vsAA group;▲P<0.05vsPDS (20 mg·kg-1·d-1) group;■P<0.05vsPDS (40 mg·kg-1·d-1) group;●P<0.05vsPDS (80 mg·kg-1·d-1) group.
讨 论
MAPK是哺乳动物细胞内广泛存在的一类丝/苏氨酸蛋白激酶,是调控细胞增殖和凋亡信号转导的关键酶,可被诸多细胞外刺激信号,如炎症因子和细菌复合物等以磷酸化方式激活,将胞外的刺激信号传递至胞核内,参与细胞的生长、增殖、分化、黏附及凋亡等[6]。近年来研究发现,MAPK信号通路与多种疾病的发生密切相关,尤其与再障的发病密切相关。国内施海涛等[7]和吴雷等[8]研究表明,慢性AA患者骨髓基质细胞内MEK1/2和p-ERK1/2蛋白表达水平较正常对照组下降,CAA患者骨髓基质细胞内p-P38和p-JNK蛋白表达水平较正常对照组上升。由此可见,MAPK信号通路中相关蛋白表达水平异常与再障的发生发展有着密不可分的联系。
表4PDS提高再障小鼠脾脏中调节性T细胞的比例
Table 4. Different doses of PDS increased the proportion of CD4+CD25+Foxp3+Treg cells of the spleen in the AA mice (%. Mean±SD.n=10)
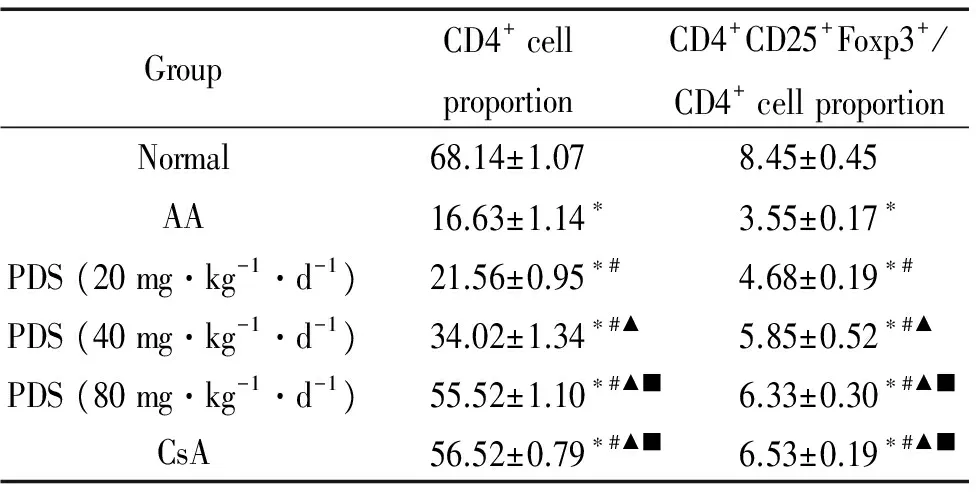
GroupCD4+cellproportionCD4+CD25+Foxp3+/CD4+cellproportionNormal68.14±1.078.45±0.45AA16.63±1.14∗3.55±0.17∗PDS(20mg·kg-1·d-1)21.56±0.95∗#4.68±0.19∗#PDS(40mg·kg-1·d-1)34.02±1.34∗#▲5.85±0.52∗#▲PDS(80mg·kg-1·d-1)55.52±1.10∗#▲■6.33±0.30∗#▲■CsA56.52±0.79∗#▲■6.53±0.19∗#▲■
*P<0.05vsnormal group;#P<0.05vsAA group;▲P<0.05vsPDS (20 mg·kg-1·d-1) group;■P<0.05vsPDS (40 mg·kg-1·d-1) group;●P<0.05vsPDS (80 mg·kg-1·d-1) group.
CD4+CD25+Foxp3+T细胞即调节性T细胞(Treg细胞)是一组具有抑制自身免疫反应、阻止损伤性免疫病理发生和维持机体免疫平衡作用的T细胞,近年来研究表明,其在再生障碍性贫血发病中起重要作用。Solomon等[17]研究证实再障患者Treg细胞显著低于正常人群,提示Treg细胞缺乏与再障发病密切相关。
人参二醇组皂苷可显著刺激人和小鼠骨髓多种造血祖细胞的增殖,有效改善再障小鼠外周血象,并通过调节脾脏中Treg细胞比例变化而参与免疫功能调节。我们已报道PDS治疗慢性再障的临床研究,结果显示疗效良好,具有改善骨髓抑制,加快骨髓造血功能恢复,升高外周血白细胞及血小板数,促进骨髓粒系和巨核系造血祖细胞增殖作用[18]。本实验通过构建免疫介导的再障小鼠模型,研究PDS治疗再障,促进骨髓造血功能的恢复是否涉及MAPK/ERK信号通路相关蛋白的表达水平的变化。通过免疫组化及Western blot法检测再障小鼠骨髓组织和细胞MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白激酶的表达水平。结果提示再障小鼠骨髓组织和细胞MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白的表达均低于正常小鼠组,且有显著差异;各治疗组小鼠骨髓细胞组织和细胞MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白表达水平较模型组有不同程度地上升,其中PDS中、高剂量治疗组与再障模型组比较差异有统计学意义,提示再障的发生可能与MEK1/2、ERK1/2蛋白激酶低表达及其磷酸化水平下降有关。由此我们推测,MEK1/2及p-MEK1/2蛋白下调后可能导致ERK1/2和p-ERK1/2蛋白水平降低,使信号从胞质转导至胞核的过程出现障碍,其下游转录因子如AP-1、NF-κB、c-Jun、c-Fos等作用减弱,使造血干/祖细胞的增殖、分化能力下降,对抗造血干/祖细胞凋亡作用减弱,从而引发了再障的发生。采用不同剂量PDS治疗再障模型小鼠14 d后,骨髓组织和细胞MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白的表达水平均有不同程度地上升,以PDS高剂量组最为显著。由此推测,PDS可能通过诱导上调骨髓造血组织和细胞MAPK/ERK信号通路的多种蛋白激酶,加快骨髓造血功能恢复,刺激造血干/祖细胞增殖和分化,从而升高外周血象,这可能是PDS促进再障造血功能恢复的作用机制之一。另外本实验也发现,PDS能够提高再障模型小鼠脾脏中调节性T细胞比例,提示PDS可能对再障模型小鼠的免疫功能有一定的调节作用。
综上所述, MAPK/ERK信号通路在再障发病中起重要作用, 尤其是在造血干细胞增殖分化与凋亡方面起重要作用。因此,对MAPK/ERK信号通路进行深入研究有利于探讨再障的发病机制并为优化治疗提供新的思路和方法。
[参考文献]
[1] Kook H, Risitano AM, Zeng W, et al. Changes in T-cell receptor VB repertoire in aplastic anemia: effects of diffe-rent immunosuppressive regimens[J]. Blood, 2002, 99(10):3668-3675.
[2] 方桂伦, 高瑞兰, 林筱洁, 等. 人参二醇促骨髓CD34+造血细胞增殖和分化的研究[J]. 中国实验血液学杂志, 2007, 15(4):776-779.
[3] Lin XJ, Yin LM, Gao RL, et al. The effects of panaxadiol saponins on megakaryocytic maturation and immune function in a mouse model of immune thrombocytopenia[J]. Exp Hematol, 2015, 43(5):364-373.
如今,随着新课程改革的逐渐深入,要求高中数学课堂可以更加地突出学生的主体位置,因此探究式教学的引入是势在必行的.探究式教学的显著特点是教学对象面向全体学生,借助问题来延伸和扩展教学内容,通过不断激励学生最终提升学生的综合水平.笔者将结合多年的教学经验,对其应用策略进行阐述.
[4] 郑智茵, 尹利明,高瑞兰,等. 人参二醇组皂苷提取物对再生障碍性贫血小鼠免疫调节作用的研究[J]. 中国药理学通报, 2015, 31(6):790-795.
[5] Yin LM, Jiang HF, Wang X, et al. Effects of sodium copper chlorophyllin on mesenchymal stem cell function in aplastic anemia mice[J]. Chin J Integr Med, 2013, 19(5):360-366.
[6] Kim EK, Choi EJ. Pathological roles of MAPK signaling pathways in human disease[J]. Biochim Biophys Acta, 2010, 1802(4):396-405.
[7] 施海涛, 王金环, 孙岸弢, 等. 补肾生血法对慢性再生障碍性贫血患者信号转导MAPK通路的影响[J]. 中医药学报, 2011, 39(4):49-52.
[8] 吴 雷,孙岸弢,梁正贤,等. 补髓生血颗粒对慢性再障患者骨髓单个核细胞MEK表达的影响[J]. 中医药信息, 2011, 28(3):67-69.
[9] Qiu C, Xie Q, Zhang D, et al. GM-CSF induces cyclin D1 expression and proliferation of endothelial progenitor cells via PI3K and MAPK signaling[J]. Cell Physiol Biochem, 2014, 33(3):784-795.
[10] Tang CH, Tsai CC. CCL2 increases MMP-9 expression and cell motility in human chondrosarcoma cells via the Ras/Raf/MEK/ERK/NF-κB signaling pathway[J]. Biochem Pharmacol, 2012, 83(3):335-344.
[11] Shimada H, Rajagopalan LE. Rho-kinase mediates lysophosphatidic acid-induced IL-8 and MCP-1 production via p38 and JNK pathways in human endothelial cells [J]. FEBS Lett, 2010, 584(13):2827-2832.
[12] Kuroda S, Tashiro H, Igarashi Y, et al. Rho inhibitor prevents ischemia-reperfusion injury in rat steatotic liver[J]. J Hepatol, 2012, 56(1):146-152.
[13] Shi L, Wang S, Zangari M, et al. Over-expression of CKS1B activates both MEK/ERK and JAK/STAT3 signaling pathways and promotes myeloma cell drug-resistance[J]. Oncotarget, 2010, 1(1):22-33.
[14] Luchetti F, Betti M, Canonico B, et al. ERK MAPK activation mediates the antiapoptotic signaling of melatonin in UVB-stressed U937cells[J]. Free Radic Biol Med, 2009, 46(3):339-351.
[15] De Luca A, Maiello MR, D’Alessio A, et al. The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways: role in cancer pathogenesis and implications for therapeutic approaches[J]. Expert Opin Ther Targets, 2012, 16(Suppl 2):17-27.
[16] Zhou RQ, Wu JH, Gong YP, et al. Transcription factor SCL/TAL1 mediates the phosphorylation of MEK/ERK pathway in umbilical cord blood CD34+stem cells during hematopoietic differentiation[J]. Blood Cells Mol Dis, 2014, 53(1-2):39-46.
[17] Solomon EE, Rezvani K, Mielke S, et al. Deficient CD4+CD25+FOXP3+T regulatory cells in acquired aplastic anemia[J]. Blood, 2007, 110(5):1603-1606.
[18] Kuang YM, Zhu Y, Gao RL, et al. Clinical study of Pai-Neng-Da capsule in the treatment of chronic aplastic anemia[J]. Chin J Integr Med, 2016, 22(2):124-129.

