皮质酮抑制LPS诱导的小鼠巨噬细胞NLRP3表达及与XO的关系*
吴 玲, 田泽丹, 陈 楠, 胡 薇, 周成富, 杜 权
(重庆医科大学附属第二医院麻醉科, 重庆 400010)
在围手术期,机体针对组织损伤和感染应激发生炎症反应,适度的炎症反应有利于机体发挥防御能力,当丧失局部控制或激发全身反应时,即发生全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体是一种存在于细胞质中的多蛋白复合物,是介导炎症反应的关键复合体,主要由NLRP3、含胱天蛋白酶募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)和caspase-1前体组成。当宿主受到微生物刺激或者内源性损伤刺激信号时,NLRP3被激活,通过ASC招募caspase-1前体组装成活化的炎症小体,产生有活性的caspase-1,剪切白细胞介素(interleukin, IL)-1β和IL-18的前体使其成熟,发挥促炎作用[1-2],其中NLRP3的表达水平是决定NLRP3炎症小体活性的主要因素。皮质酮(corticosterone,CORT)是应激时下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴的最终直接产物,通过调控炎症作用而维持内环境的稳定[3],但皮质酮对炎症的调控是否与介导NLRP3的表达降低有关,尚不明确。近年来国内外相关研究报道称多种结构各异的分子可激活NLRP3炎症小体,它们均能促进信号分子活性氧簇(reactive oxygen species,ROS)的产生,后者可能是它们活化NLRP3炎症小体的共同主要机制[4-6],而且目前较为认可的是线粒体来源的ROS[7-8]。已有研究指出,黄嘌呤氧化酶(xanthine oxidase,XO)主要介导线粒体ROS的产生[9],所以假设CORT是通过XO调控巨噬细胞内NLRP3炎症小体的活化。本研究拟构建NLRP3炎症小体的活化模型,探讨XO对CORT调控细菌脂多糖(lipopolysaccharide,LPS)诱导的小鼠巨噬细胞RAW 264.7内NLRP3炎症小体的影响,进一步为探讨CORT发挥抗炎作用的机制进行深入研究,以提供调控炎症的新靶点。
材 料 和 方 法
1 实验材料
小鼠巨噬细胞株RAW 264.7由重庆医科大学感染实验室惠赠。LPS、别嘌呤醇(allopurinol,XO拮抗剂)和CORT均购自Sigma;抗黄嘌呤氧化酶抗体购自Abcam;抗NLRP3抗体购自CST;抗GAPDH抗体购自Bioworld;抗caspase-1抗体购自ImmunoWay;RNAiso Plus、Prime Script RT reagent Kit和SYBR Premix Ex Taq 均购自TaKaRa;NLRP3、XO和GAPDH的mRNA引物由TaKaRa合成;胎牛血清(fetal bovine serum,FBS)和抗生素购自HyClone;DMED培养基购自Gibco。
2 方法
2.1细胞培养、构建炎症模型 RAW 264.7细胞系培养于含10% FBS和1%抗生素(100 mg/L青霉素和100 mg/L链霉素)的DMED培养基中,置于37 ℃、5% CO2的细胞培养箱中培养。待细胞处于对数生长期时,加入LPS致最终浓度为1 mg/L,使细胞形态变成多角形,伸出伪足数量明显增多,构建成熟的炎症模型。
2.2CORT浓度梯度的设置 分别用浓度为100、300、500、700和900 μg/L的CORT预处理巨噬细胞1 h,再构建炎症模型(1 mg/L LPS),1 h后提取细胞总蛋白为实验对象。
2.3药物预处理及时间梯度的分组设置 LPS组细胞在构建炎症模型后0、0.5、1、1.5和2 h提取细胞成分,0 h为对照(control)组;CORT+LPS组细胞加入CORT致最终浓度为700 μg/L预处理1 h,构建炎症模型后于0.5、1、1.5和2 h提取细胞成分;allopurinol+LPS组细胞加入allopurinol至最终浓度为250 mg/L预处理1 h,构建炎症模型后于0.5、1、1.5和2 h提取细胞成分。
2.4Western blot法检测NLRP3、caspase-1和XO蛋白的表达 按细胞总蛋白提取试剂盒提取各组细胞的总蛋白,BCA法测定蛋白浓度。经过高温变性使蛋白性质稳定,各孔分别加入样品蛋白30 μg,经过电泳、湿转将蛋白转移至PVDF膜上,在TBST缓冲液(含5%脱脂奶粉)中于室温封闭1 h,分别按说明书加入相应稀释浓度的Ⅰ抗于4 ℃孵育过夜,TBST漂洗3次,再加入相应稀释浓度的Ⅱ抗于室温孵育1 h,TBST漂洗3次,ECL法显影蛋白印迹,实验重复3次。
2.5Real-time PCR法检测NLRP3和XO mRNA的表达 弃各组细胞的培养上清,无菌无酶的PBS缓冲液清洗贴壁细胞3次,加入1 mL RNAiso Plus,吹打40~60次,使细胞充分裂解,动作轻柔,按RNAiso说明书提取各组细胞总RNA,使A260/A280均在1.8~2.0之间。按逆转录试剂盒说明书进行逆转录及扩增。PCR扩增条件为95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,40个循环。采用2-ΔΔCt法行PCR产物相对定量分析,实验重复3次。引物采用Primer Premier 5.0软件设计,序列见表1。
3 统计学处理
实验结果以均数±标准差(mean±SD)表示。采用SPSS 11.0统计学软件对数据进行分析,多组间均数比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
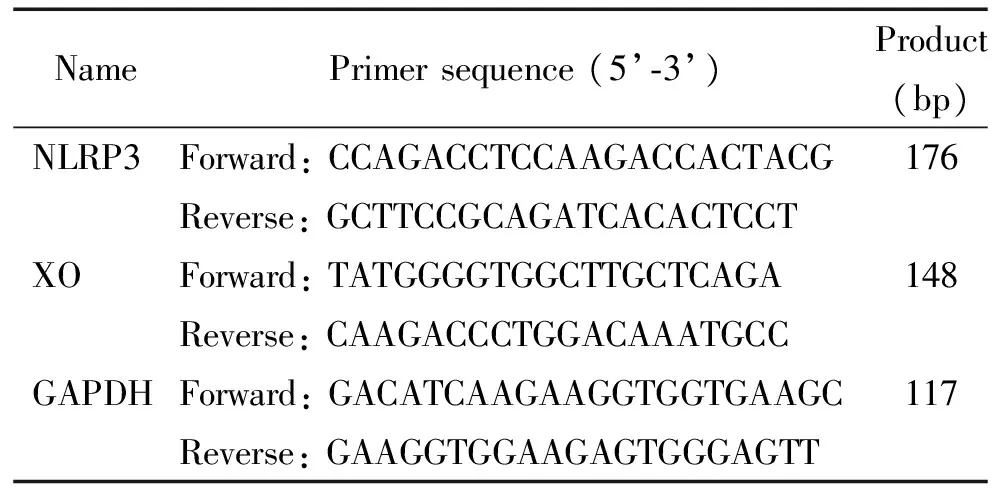
表1 引物序列
结 果
1 LPS诱导NLRP3的表达
1.1LPS上调NLRP3的蛋白表达 1 mg/L的LPS处理巨噬细胞,在0.5 h~2 h间NLRP3的表达水平均有不同程度增加,相比对照组差异有统计学意义(P<0.05或P<0.01),于2 h表达量最高,见图1。

Figure 1. The protein levels of NLRP3 in the RAW 264.7 cells treated with LPS at 1 mg/L. Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group.
图1LPS(1mg/L)刺激巨噬细胞后不同时点NLRP3蛋白水平的变化
1.2LPS上调NLRP3的mRNA表达 在LPS刺激后1 h~2 h NLRP3的mRNA表达水平高于对照组(P<0.05或P<0.01),0.5 h的mRNA表达水平稍增加,但差异无统计学显著性,见图2。
2 CORT对NLRP3和caspase-1的蛋白表达的影响
当CORT低于300 μg/L时,NLRP3的蛋白水平与对照组相比显著上调(P<0.05);当CORT高于700 μg/L时,NLRP3的蛋白表达明显减少(P<0.05),并同步减少cleaved caspase-1的蛋白水平(P<0.05),见图3。
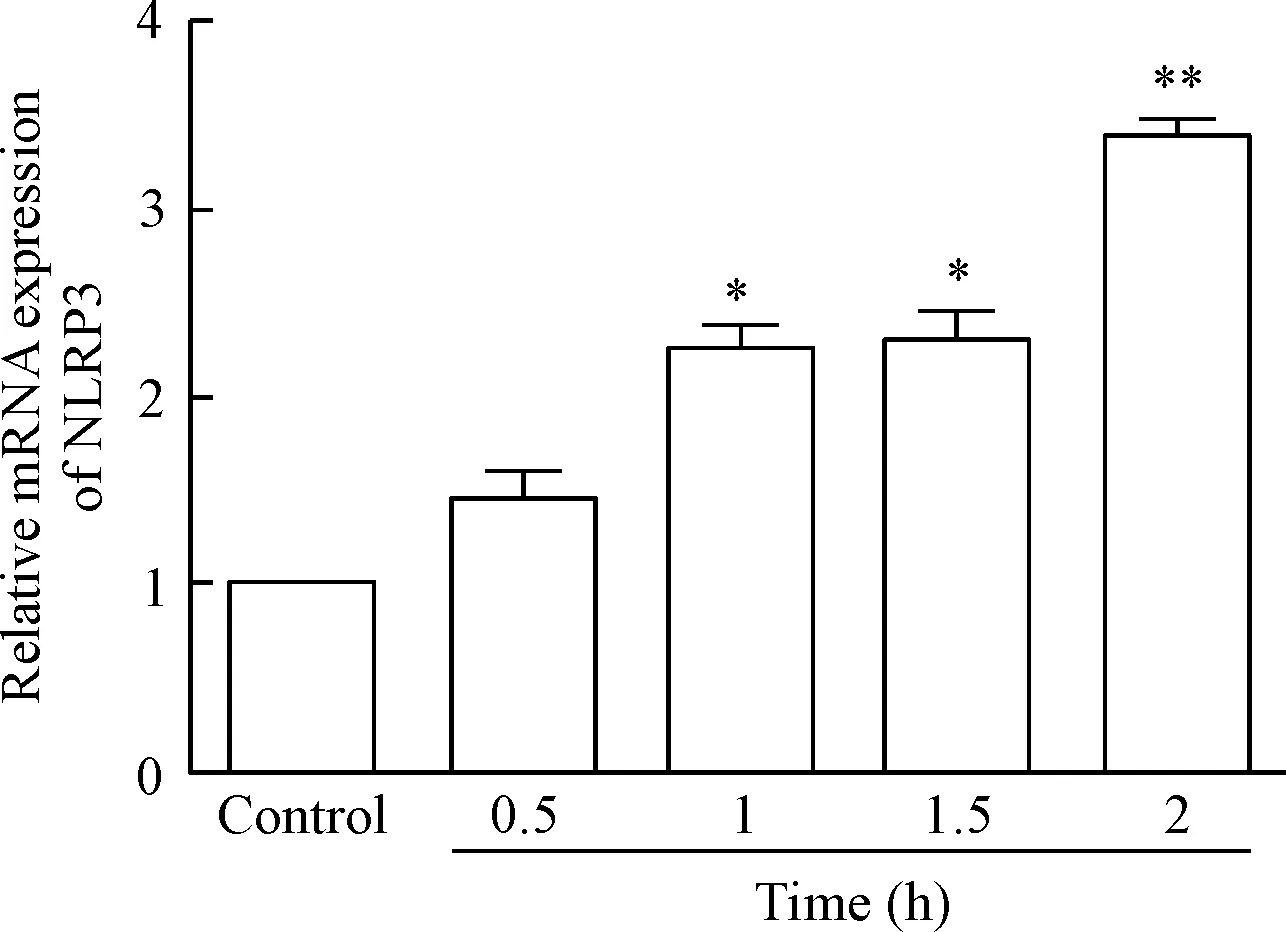
Figure 2. The mRNA expression of NLRP3 in the RAW 264.7 cells treated with LPS at 1 mg/L. Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group.
图2LPS(1mg/L)刺激巨噬细胞后不同时点NLRP3mRNA的相对表达情况
3 CORT下调NLRP3表达的同时抑制XO的表达
3.1CORT使NLRP3和XO的蛋白表达减少 与LPS组相比,CORT逐渐降低NLRP3的蛋白表达水平(P<0.05或P<0.01),至2 h表达量最低;在CORT作用后1.5 h和2 h XO的蛋白表达亦减少(P<0.05),于2 h最低,见图4。
3.2CORT下调NLRP3和XO的mRNA表达 在CORT+LPS作用后0.5 h至2 h,NLRP3的mRNA表达与LPS组相比显著下调(P<0.01);XO在1.5 h和2 h的mRNA表达亦显著下调(P<0.05),见图5。
4 Allopurinol减少NLRP3的表达
4.1Allopurinol减少NLRP3的蛋白表达 在allopurinol+LPS处理后,NLRP3在1 h至2 h的蛋白表达量相比LPS组显著降低(P<0.01),见图6。
4.2Allopurinol下调NLRP3的mRNA表达 在allopurinol+LPS处理后1 h至2 h,NLRP3的mRNA表达水平低于LPS组(P<0.01),见图7。
讨 论
在发生急性炎症的早期,机体启动促炎和抗炎2种机制,决定着炎症的发生、发展和转归,巨噬细胞等炎症细胞渗出是炎症反应最主要的特征,它作为重要的天然免疫细胞,在炎症调控中发挥着重要的作用。本研究以小鼠巨噬细胞RAW 264.7作为实验对象,用脂多糖构建炎症模型,结果表明在炎症发生的2 h内,NLRP3表达增强,于2 h反应最活跃。NLR作为重要的胞内模式识别受体,激活后形成炎症小体复合物,而NLRP3的表达水平是决定NLRP3炎症小体活性的主要因素。本实验证明LPS可激活巨噬细胞内的NLRP3炎症小体通路,促进炎症的发生,与已有研究结果一致[10-11],构建了由LPS激活NLRP3炎症小体的模型。机体在围术期受到应激时,HPA轴被激活,释放糖皮质激素,可显著抑制LPS介导的鼠巨噬细胞炎症反应,而CORT作为啮齿类动物最主要的内源性糖皮质激素,发挥抗炎作用与介导炎症小体的表达降低有关。本研究选用0~900 μg/L皮质酮主要是为了观察不同应激条件下皮质酮的免疫调控作用。Dhabhar等[12]研究指出,50 μg/L CORT等同于机体在应激时产生的生理皮质酮水平,对巨噬细胞产生免疫刺激作用,在一定程度上对机体在早期适应急性应激作出了解释。本研究结果说明,低于300 μg/L的CORT促进炎症小体的释放以刺激机体的免疫功能,但700 μg/L时反而抑制作用最明显,发挥强效的抗炎作用。
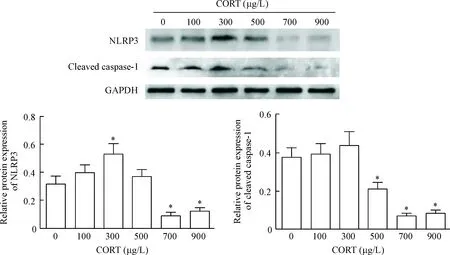
Figure 3. The protein levels of NLRP3 and caspase-1 in the RAW 264.7 cells treated with CORT at different concentrations. Mean±SD.n=6.*P<0.05,P<0.01vs0 μg/L.
图3不同浓度的CORT与LPS(1mg/L)刺激细胞后NLRP3和cleavedcaspase-1蛋白水平的变化
Figure 4. The protein levels of NLRP3 and XO in the RAW 264.7 cells treated with CORT and LPS. Mean±SD.n=6.*P<0.05,**P<0.01vsLPS group.
图4CORT(700μg/L)与LPS(1mg/L)作用于巨噬细胞后各时点NLRP3和XO蛋白水平的变化
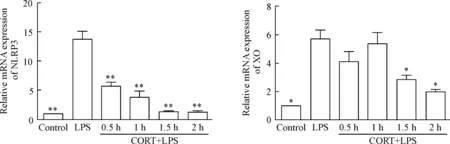
Figure 5. The mRNA expression of NLRP3 and XO in the RAW 264.7 cells treated with CORT and LPS. Mean±SD.n=6.*P<0.05,**P<0.01vsLPS group.
图5CORT(700μg/L)与LPS(1mg/L)作用于巨噬细胞后各时点NLRP3和XO的mRNA相对表达情况
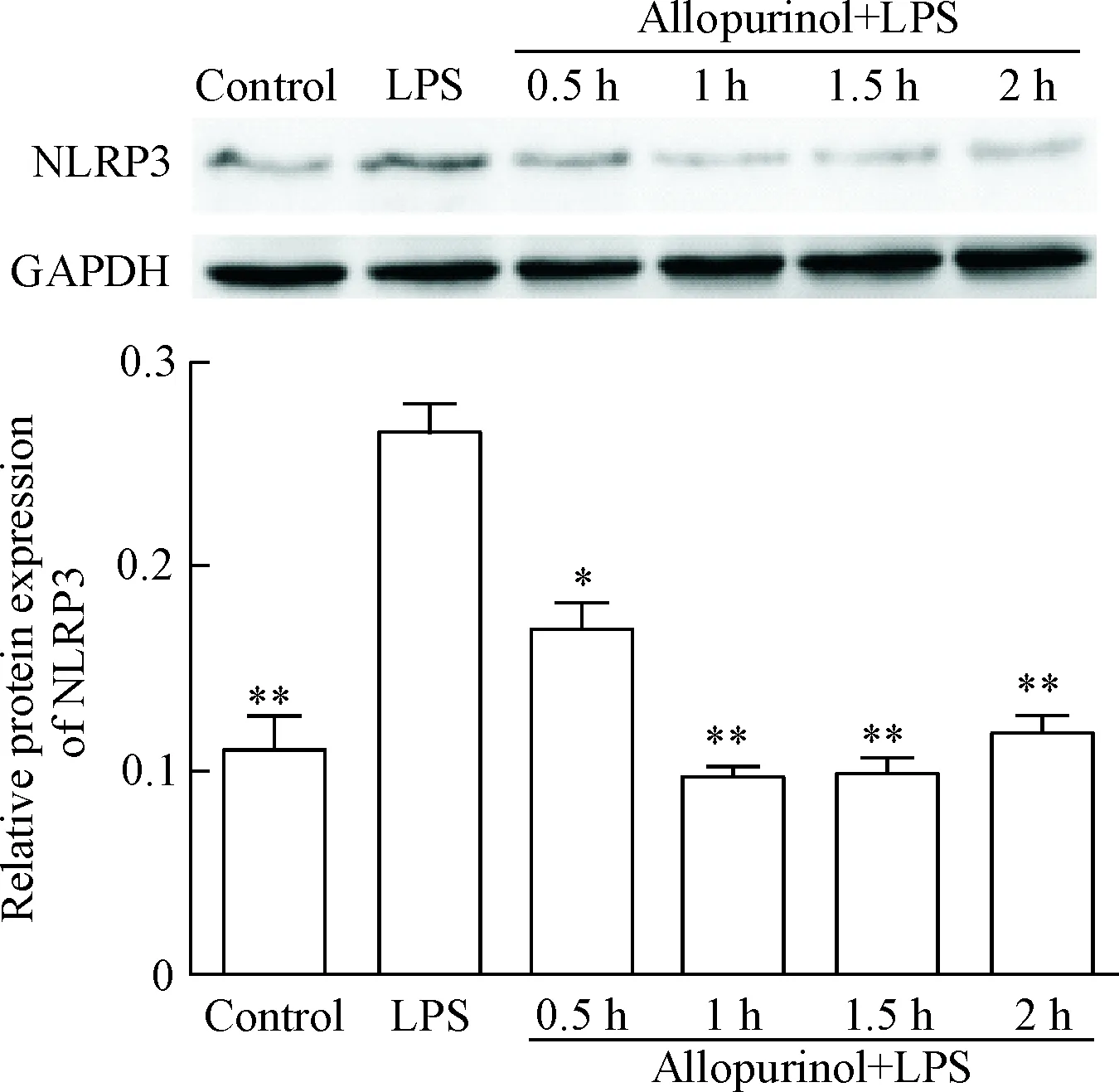
Figure 6. The protein levels of NLRP3 in the RAW 264.7 cells treated with allopurinol and LPS. Mean±SD.n=6.*P<0.05,**P<0.01vsLPS group.
图6Allopurinol(250mg/L)预处理及LPS刺激巨噬细胞后不同时点NLRP3蛋白水平的变化

Figure 7. The mRNA expression of NLRP3 in the RAW 264.7 cells treated with allopurinol and LPS. Mean±SD.n=6.**P<0.01vsLPS group.
图7Allopurinol(250mg/L)预处理及LPS刺激巨噬细胞后不同时点NLRP3的mRNA相对表达情况
CORT通过抑制NLRP3炎症小体的活性发挥抗炎作用,但调控炎症小体的机制复杂不清,目前国内外相关研究较少。现研究已证实多种途径可激活NLRP3炎症小体,如细胞内的ROS、组织蛋白酶B(cathepsin B)和胞内蛋白激酶R等,其中细胞内ROS在LPS活化的NLRP3炎症小体中发挥着重要的作用[13-15],ROS可直接促硫氧还原蛋白互动蛋白与NLRP3结合,进而激活NLRP3并组装成活化的炎症小体,促进炎症反应的发生[16],尤其与线粒体ROS关系密切。Ives等[9]研究表明,XO介导线粒体ROS的产生,并调节巨噬细胞内NLRP3炎症小体的激活及促炎因子的剪切。因此,本实验假设在调控炎症反应的小鼠巨噬细胞中,CORT下调NLRP3炎症小体的活性与抑制XO的表达水平有关。本实验结果表明,较高浓度CORT(高于700 μg/L)在炎症发生的2 h内下调NLRP3的表达,减轻LPS诱导的鼠巨噬细胞炎症反应,同时抑制XO的表达水平,可见较高浓度CORT(高于700 μg/L)对LPS诱导的鼠巨噬细胞内NLRP3表达的抑制作用。XO的拮抗剂allopurinol使NLRP3的表达水平降低,说明NLRP3的表达与XO有关。
本研究初步确认,较高浓度CORT能抑制LPS诱导的小鼠巨噬细胞内NLRP3的表达,后者与XO有关,而CORT的抑制作用可能与其下调XO的表达水平有关。此结果进一步说明XO作为线粒体ROS的工具酶,介导了LPS诱导的小鼠巨噬细胞内NLRP3炎症小体的表达,而皮质酮通过调控XO抑制NLRP3炎症小体的活化,后续有待于进一步在人巨噬细胞中加以验证。本研究阐释了内源性糖皮质激素发挥抗炎效应的机制,为炎症的干预措施提供了新工具。
[参考文献]
[1] Horng T. Calcium signaling and mitochondrial destabilization in the triggering of the NLRP3 inflammasome[J]. Trends Immunol, 2014, 35(6):253-261.
[2] Jo EK, Kim JK, Shin DM, et al.Molecular mechanisms regulating NLRP3 inflammasome activation[J].Cell Mol Immunol, 2016, 13(2):148-159.
[3] Zinni M, Zuena AR, Marconi V, et al. Maternal exposure to low levels of corticosterone during lactation protects adult rat progeny against TNBS-induced colitis: a study on GR-mediated anti-inflammatory effect and prokineticin system[J]. PLoS One, 2017, 12(3):1-17.
[4] Tschopp J, Schroder K. NLRP3 inflammasome activation: the convergence of multiple signaling pathways on ROS production[J]. Nat Rev Immunol, 2010, 10(3): 210-215.
[5] Abais JM, Xia M, Zhang Y, et al. Redox regulation of NLRP3 inflammasomes: ROS as trigger or effector[J]. Antioxid Redox Signal, 2015, 22(13):1111-1129.
[6] 张 涵, 马 晶, 张云凌, 等. 肺炎支原体经ROS激活NLRP3炎性体诱导RAW 264.7细胞分泌IL-1β[J]. 中国病理生理杂志, 2015, 31(12):2244-2248.
[7] Heid ME, Keyel PA, Kamga C, et al. Mitochondrial reactive oxygen species induces NLRP3-dependent lysosomal damage and inflammasome activation[J]. J Immunol, 2013, 191(10): 5230-5238.
[8] Wu J, Yan Z, Schwartz DE, et al. Activation of NLRP3 inflammasome in alveolar macrophages contributes to mechanical stretch-induced lung inflammation and injury[J]. J Immunol, 2013, 190(7):3590-3599.
[9] Ives A, Nomura J, Martinon F, et al. Xanthine oxidoreductase regulates macrophage IL-1β secretion upon NLRP3 inflammasome activation[J]. Nat Commun, 2015, 6: 6555.
[10] Xiao HB, Wang CR, Liu ZK, et al. LPS induces pro-inflammatory response in mastitis mice and mammary epithelial cells: Possible involvement of NF-κB signaling and OPN[J]. Pathol Biol, 2015, 63(1):11-16.
[11] Li X, Zhong F. Nickel induces interleukin-1β secretion via the NLRP3-ASC-caspase-1 pathway[J]. Inflammation, 2014, 37(2):457-466.
[12] Dhabhar FS, Viswanathan K. Short-term stress experienced at time of immunization induces a long-lasting increase in immunologic memory[J]. Am J Physiol Regul Integr Comp Physiol, 2005, 289(3):738-744.
[13] Orlowski GM, Colbert JD, Sharma S, et al. Multiple cathepsins promote pro-IL-1β synthesis and NLRP3-mediated IL-1β activation[J]. J Immunol, 2015, 195(4):1685-1697.
[14] Lu B, Nakamura T, Inouye K, et al. Novel role of PKR in inflammasome activation and HMGB1 release[J]. Nature, 2012, 488(7413):670-674.
[15] Ren JD, Wu XB, Jiang R, et al. Molecular hydrogen inhibits lipopolysaccharide-triggered NLRP3 inflammasome activation in macrophages by targeting the mitochondrial reactive oxygen species[J]. Biochim Biophys Acta, 2016, 1863(1):50-55.
[16] Ye X, Zuo D, Yu L, et al. ROS/TXNIP pathway contri-butes to thrombin induced NLRP3 inflammasome activation and cell apoptosis in microglia[J]. Biochem Biophys Res Commun, 2017, 485(2):499-505.

