异常早幼粒细胞Auer小体发生率的影响因素分析
张景逍,张金彪,张晗钰,翟文燕,王晓静
河北省沧州中西医结合医院实验诊断科,河北沧州 061000
急性早幼粒细胞白血病(APL)属急性髓细胞白血病(AML),作为AML中的特殊亚型,APL患者骨髓中常见数量不等的Auer小体,其Auer小体的检出率及总体数量也同样大于其他类型的AML[1]。与此同时,APL患者骨髓异常早幼粒细胞发生Auer小体的概率在个体之间存在差异,引发这一现象的原因至今尚不清楚。因此本文对APL患者的Auer小体发生率进行研究,结合细胞形态学、分子生物学、细胞遗传学和免疫学做出分析,结合相关临床知识探索APL患者Auer小体发生率与其他临床指标的关联,并希望引入Auer小体发生率的概念以帮助临床判断患者预后。
1 资料与方法
1.1一般资料 收集2018年5月至2020年5月河北省沧州中西医结合医院确诊的APL患者共38例,每一例患者的诊断均符合《血液病诊断及治疗标准》[2]中APL的相关诊断标准,38例患者中男性18例、女性20例,年龄13~64岁,中位年龄41.5岁,其中PML/RARα融合基因长链型(L型)24例,短链型(S型)14例,融合基因剪接体相对表达量(PML/ABL)为3.24%~80.23%,初诊白细胞计数(WBC)为0.2×109/L~107.5×109/L、血红蛋白(Hb)为48~129 g/L、血小板计数(PLT)为6×109/L~122×109/L,异常细胞群流式表达率:CD13为48.41%~99.6%、CD33为77.9%~99.68%、CD117为38.70%~96.10%、CD38为13.20%~99.31%、CD64为10.66%~93.18%、CD56为0.00%~80.01%(阳性率15.8%)、HLA-DR为0.00%~33.00%(阳性率26.3%)。将患者按照不同PML/RARα融合基因类型(L型和S型)、CD56(阴性组和阳性组)、HLA-DR(阴性组和阳性组)、性别(男/女)、年龄(1组为50岁及50岁以下;2组为50岁以上)进行分组。
1.2仪器与试剂 Olympus CX31显微镜(日本奥林巴斯株式会社);瑞氏-吉姆萨复合染液:试剂A,瑞氏-吉姆萨染液(北京雷根生物技术有限公司);试剂B,磷酸盐缓冲液(北京雷根生物技术有限公司)。
1.3方法
1.3.1骨髓涂片制备 选择临床采集标本中薄厚均匀的骨髓涂片进行瑞氏染色,A液覆盖标本膜,静置5 min后加入B液混匀,A液与B液比例约2∶1,静置45 min,自然风干。
1.3.2Auer小体发生率计数 取38例患者骨髓涂片镜下观察,4名骨髓形态学检测人员每人在油镜下不同部位分别观察500个异常早幼粒细胞,计数发生了Auer小体的细胞比例,求得平均值作为患者Auer小体发生率,38例标本最终计数结果为0.00%~29.25%,中位数为1.00%。
1.4统计学处理 采用Excel2010进行数据的录入与整理,运用SPSS25.0软件进行统计学分析;不符合正态分布的计量资料用M(P25,P75)表示,组间比较采用秩和检验;相关性分析采用Spearman相关;采用简单线性回归对Auer小体发生率的影响因素进行单因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1不同临床资料患者Auer小体发生率的差异性分析 不同性别、年龄、HLA-DR表达的患者Auer小体发生率比较,差异无统计学意义(P>0.05),不同CD56表达、PML/RARα融合基因类型的患者Auer小体发生率比较,差异有统计学意义(P<0.05),其中CD56阴性组的Auer小体发生率高于阳性组(P<0.05),L型PML/RARα融合基因的Auer小体发生率高于S型(P<0.05),见表1。
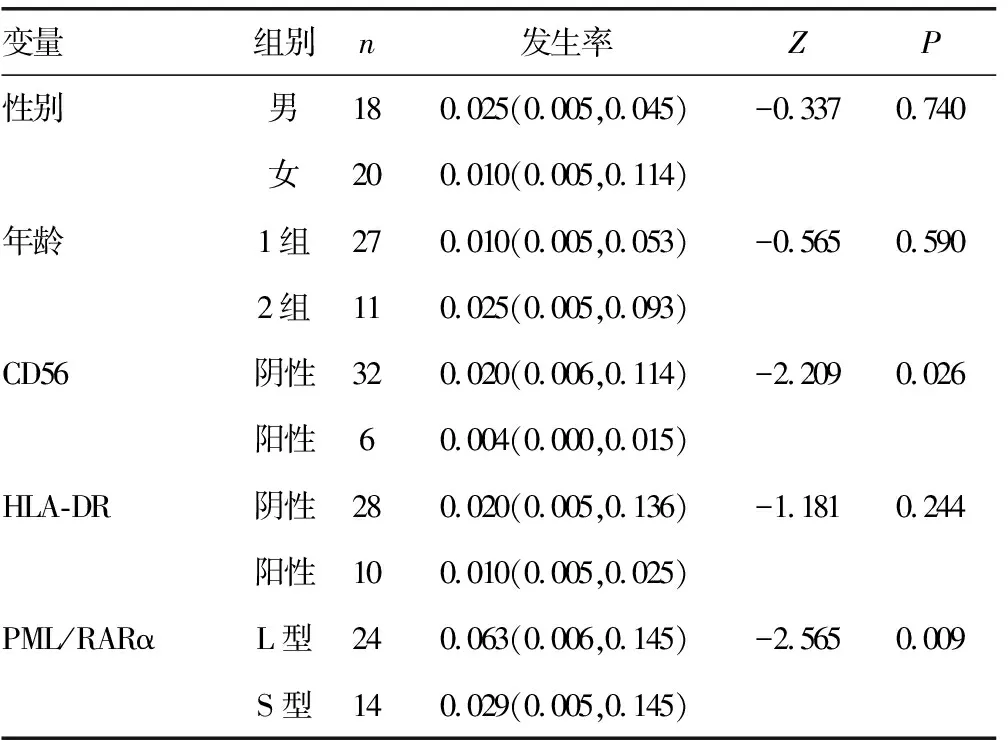
表1 不同患者Auer小体发生率的差异性分析[M(P25,P75)]
2.2各项指标与Auer小体发生率的相关性分析 将患者初诊WBC、各项流式表达率(CD13、CD33、CD117、CD64、CD38)、PML/ABL、Hb、PLT共9项指标分别和Auer小体发生率做相关性分析,结果显示仅WBC与Auer小体发生率呈负相关(P<0.05),r为-0.376,见表2。
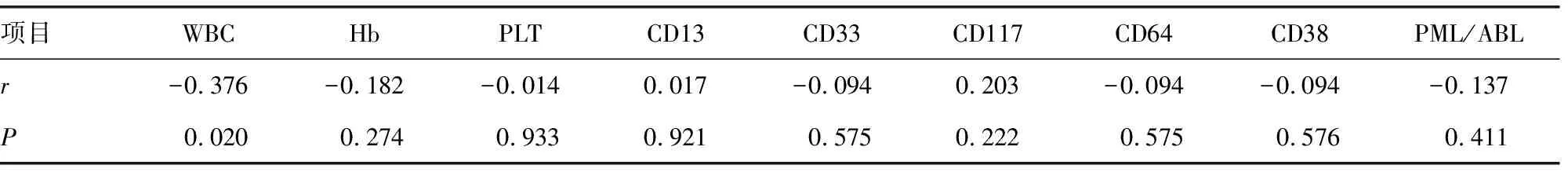
表2 各项指标与Auer小体发生率的相关性分析结果
2.3影响Auer小体发生率的单因素回归分析 将Auer小体发生率作为因变量,相关性分析中有统计学意义的指标(WBC)作为自变量进行简单线性回归分析。结果显示,WBC进入了回归方程,回归模型有统计学意义(P<0.05),可认为初诊WBC是Auer小体发生率的影响因素,回归方程为:Y=-0.001X+0.079,说明WBC每增加一个单位,整体样本的Auer小体发生率平均降低0.1%,见表3。
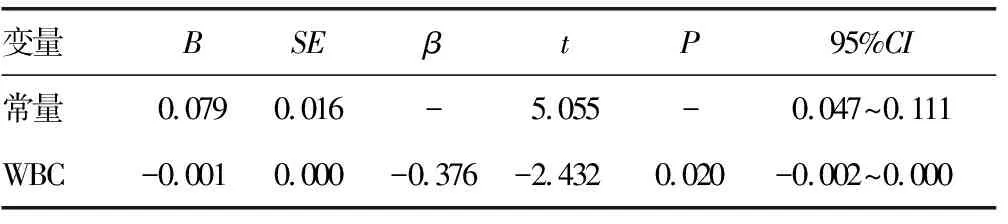
表3 影响Auer小体发生率的单因素回归分析
3 讨 论
Auer小体于1906年由美国医师John Auer首先发现,日常工作中常见由嗜苯胺蓝颗粒融合而成的杆状Auer小体,此外还可见呈针尖状或卵圆状等形状的Auer小体[3],在骨髓形态学中Auer小体的出现标志着该细胞起源于白血病的克隆,可见于AML患者中的原始和幼稚细胞,其在AML中有较高的特异性[4]。自Auer小体被发现以来,在早期HASSAN等[5]认为Auer小体的出现是白血病预后较好的重要指标,但近年来我国学者胡忠利等[6]研究的结论表明,Auer小体的出现与AML患者预后无关,学者们对此的结论并不完全一致,目前为止,Auer小体的阳性对临床的帮助也仅限于对骨髓增生异常综合征(MDS)分型的判断,其对临床的指导意义尚未被完全发掘。
APL患者中的异常早幼粒细胞通常全部表达CD123、CD13、CD33、CD38和CD64,约96%的患者表达CD117和CD9,CD15、CD56和CD11b阳性率分别为37.1%、24.7%和20.0%,CD34和HLA-DR的阳性率分别为10.7%和7.0%[7]。本研究将阳性率100.0%的抗原与Auer小体发生率做相关性分析,结果显示,与Auer小体发生率均不存在相关性(P>0.05),其他抗原中HLA-DR的表达与Auer小体发生率无关(P>0.05),但CD56阴性的APL患者Auer小体发生率高于CD56阳性患者,差异有统计学意义(P<0.05)。白血病细胞CD56抗原属于超免疫球蛋白之一,是人类天然免疫系统的重要组成部分,其不但介导细胞与细胞的相互作用,还可能参与细胞介导的毒性反应[8],在AML中CD56可作为判断患者预后的指标之一,CD56阳性的APL患者尽管总体存活期与阴性患者比较差异无统计学意义(P>0.05),但缓解持续时间和无病生存期更短,预后、疗效更差[9]。本研究虽得到了CD56阴性的APL患者Auer小体发生率高于CD56阳性患者的结论,但在实际工作中只收集到了患者白血病细胞群的CD56表达率,未收集到患者CD56阳性细胞群CD56的表达强度,因此APL患者中Auer小体的发生率是否受CD56表达强度的影响还需进一步探索。
APL特征性的遗传改变为t(15;17),存在早幼粒细胞白血病α融合基因,PML/RARα融合基因分为3种亚型,即长链型(L型;bcr1)、变异型(V型;bcr2)与短链型(S型;bcr3),其中L型异常早幼粒细胞形态多为典型多颗粒型且免疫表型多为典型APL特点,S型无明显特殊性,但V型异常早幼粒细胞形态多为细颗粒型,部分患者会表达CD34[10]。本次对L型和S型融合基因的差异性研究发现,L型融合基因的APL患者Auer小体发生率高于S型患者,差异有统计学意义(P<0.05),其原因可能是由于某一种基因序列在L型患者中的重复性不同于S型,从而导致Auer小体多发,此假设还需进一步验证。
APL患者初诊的WBC、Hb、PLT是临床判断患者危险程度的指标,根据APL诊疗指南中的危险分层标准将初诊WBC<10×109/L且PLT>40×109/L的患者分为低危组;WBC≤10×109/L且PLT≤40×109/L的患者分为中危组;WBC>10×109/L的患者分为高危组[11],本研究显示Hb与PLT两项指标与患者Auer小体发生率均无相关性,但初诊WBC与Auer小体发生率呈负相关(P<0.05),r为-0.376,同时将WBC引入线性回归分析中得出回归方程为:Y=-0.001X+0.079,本研究可得出WBC与Auer小体发生率呈负相关,但是因样本量较小,还需更大的样本量对回归方程进行修正。
综上所述,本研究中与APL患者Auer小体发生率有关的因素分别为CD56的表达、初诊WBC与PML/RARα融合基因类型,CD56阴性患者Auer小体发生率高于阳性患者;PML/RARα融合基因L型患者Auer小体发生率高于S型患者;WBC越低Auer小体的发生率越高。既往有研究表明,S型融合基因患者的预后较L型更差[12],CD56阳性的APL患者预后不良[13];也有研究表明,初诊WBC高的患者较WBC低的患者预后不良[14]。本研究结果显示,一般情况下APL患者Auer小体发生率低提示预后不良,具体生存曲线分析及如何划分Auer小体发生率的界限来判断患者预后还需进一步研究。APL患者的初诊Auer小体发生率有望作为评估临床其他指标与患者预后的参考指标。

