糖尿病前期患者循环miR-103b表达、临床意义及靶基因功能研究*
罗宇霖, 方 丹, 刘钰熙, 贺朝晖, 吴剑波△, 罗 茂△
(西南医科大学 1药物研究中心, 2临床医学系, 3药学院药理学系心血管药理实验室, 四川 泸州 646000)
糖尿病前期(pre-diabetes mellitus, pre-DM)即糖调节受损(impaired glucose regulation,IGR),包括空腹血糖调节受损(impaired fasting glucose,IFG)和糖耐量减退(impaired glucose tolerance,IGT)。糖尿病前期是发展为2型糖尿病(type 2 diabetes mellitus,T2DM)的过渡阶段,也是血管病变的独立高危因素[1]。微小RNA(microRNA,miRNA,miR)是一类内源性的、非编码小RNA,在人体生命活动中具有广泛的调控功能[2]。研究表明,T2DM胰岛素抵抗和糖代谢紊乱过程伴随大量异常表达的miRNAs,其中miR-103与胰岛素抵抗及糖代谢密切相关[3]。Trajkovski等[3]研究发现,T2DM肝病患者、ob/ob小鼠及肥胖小鼠肝脏中高水平miR-103与胰岛素抵抗指数呈正相关;Plé等[4]利用深度测序挖掘正常人血小板mi-RNAs,发现血小板内富含miR-103,占测序所得mi-RNAs总量第3位,然而机理尚不清楚;最近研究揭示,循环miR-103及其靶标分泌型卷曲相关蛋白4(secreted frizzled-related protein 4,SFRP4)是调节糖尿病胰岛素信号传导及炎症反应的关键因子,其中血清SFRP4可能是糖尿病超前诊断的标志物[5]。
循环miRNAs作为一种非创伤性检测标志物,具有样本易于采集、保存期长及检测手段简便等特点,临床应用价值显著[6]。目前血浆/血清miRNAs在肿瘤和心血管病等疾病中的应用研究已取得重要进展,但糖尿病前期循环miRNAs疾病标志物研究尚属起步[6]。本课题组前期研究结果揭示,2型糖尿病前期患者血小板miR-103b可负调控体内葡萄糖耐受及靶标SFRP4 mRNA和蛋白表达水平,提示miR-103b是潜在的新型2型糖尿病前期诊断标志物[7]。然而,miR-103b基因特征及其靶基因功能研究仍不清楚,并且,其它循环系统如血清中miR-103b是否也与2型糖尿病前期诊断密切相关,以及循环miR-103b表达变化与临床意义,这些问题仍待进一步深入探讨。研究循环血清中miR-103b表达水平、临床意义及其靶基因功能,将可为临床寻求2型糖尿病早期诊断标志物提供新的理论依据。
材 料 和 方 法
1 材料
1.1材料 Mir-XTMmiRNA 第一链合成试剂盒和SYBR® RT-qPCR 试剂盒(Clontech);PrimeScriptTMRT(Perfect Real Time)试剂盒和SYBR Premix Ex Taq II (TaKaRa);TRIzols(Invitrogen);无RNA酶水(天根生化科技有限公司);无酶枪头和EP管(Axygen);无水乙醇、氯仿和异丙醇(成都科龙化工);PCR引物由Invitrogen公司合成。5804R高速冷冻离心机(Eppendorf);CFX96 Touch 实时荧光定量PCR仪(Bio-Rad);ND-1000微量紫外可见分光光度计(NanoDrop); -80 ℃超低温冰箱(Thermo)。
1.2样本收集 根据2013年美国糖尿病协会糖尿病诊疗中对糖尿病的诊断标准,从2015年9月~2016年5月于我院附属医院内分泌科就诊患者中选取pre-DM患者(pre-DM组)48例,男22例,女26例,平均年龄(62.21±10.30)岁;糖尿病无并发症(noncomplicated diabetes mellitus,NCDM)患者(NCDM组)47例,男23例,女24例,平均年龄(60.46±11.14)岁;另于我院体检者中选取健康志愿者(control组)50例,男25例,女25例,平均年龄(59.45±9.84)岁,各组年龄和性别差异比较无统计学显著性。排除标准:无糖尿病家族病史;糖尿病合并心血管疾病、高血压病或其它影响miRNA表达的慢性疾病;已服用糖尿病治疗药物6个月以上者;合并其它影响糖代谢疾病者,如甲状腺功能亢进、库欣综合征等;吸烟、酗酒者。以上标本收集均通过西南医科大学附属医院伦理委员会批准并取得患者知情同意。
2 方法
2.1血液标本的收集和处理 使用内含促凝剂的真空采血管对所有满足以上条件的受试者在清晨进行空腹采集静脉血5 mL,室温静置60 min,待血液自然凝集后,立即将上层血清分装于1.5 mL EP管保存于-80 ℃冰箱待用。
2.2血清总RNA的提取 145 例标本各取500 μL的血清,按TRIzols试剂盒说明书提供的方法提取总RNA。总RNA溶于40 μL的无RNA 酶水,使用NanoDrop 1000检测总RNA的浓度,采用A260/A280判断所提取RNA的质量。
2.3血清中miR-103b的检测 应用试剂盒制备cDNA模板。分别以U6为内参照检测miR-103b的表达水平。应用SYBR Premix Ex Taq II进行real-time PCR检测。miR-103b的上游引物序列为5’-ACACTCCAGCTGGGTCATAGCCCTGTACAATG-3’,下游引物序列为5’-CTCAACTGGTGTCGTGGA-3’;U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGAATTTGCGT-3’。引物扩增条件为:95 ℃预变性10 min; 95 ℃变性10 s, 50 ℃~ 60 ℃复性20 s, 72 ℃延伸30 s,共40个循环; 72 ℃延伸3 min, 60 ℃到95 ℃绘制熔解曲线。应用2-ΔΔCt法计算miR-103b的表达量,每个样品重复3次。
2.4靶基因的预测及生物信息学分析 应用在线软件miRBase(http://www. mirbase.org/)获得miR-103b的染色体定位和物种保守性等基本信息,采用MEME 4.11.2(http://meme.nbcr.net/)软件对其保守性进行分析。结合miRanda(http://www.microrna.org/microrna/home.do)、TargetScan 7.1(http://www.target scan.org/) 和PicTar(http://www.pictar.org/)中的靶基因预测结果,分析其中交集结果并提交miTarBase(http://mirtarbase.mbc.nctu.edu.tw/)与已证实的靶基因形成靶基因集合,用于后续分析。并通过DAVID基因注释软件数据库对靶基因集合的功能进行富集分析。利用KEGG数据库中Pathway子数据库(http://www.genome.j/kegg/pathway.html)对hsa-miR-103b的靶基因进行信号转导通路富集分析。
3 统计学分析
所有数据采用SPSS 16.0 统计软件进行数据统计。年龄和生化指标等数据采用均数±标准差(mean±SD)表示,各组间比较用单因素方差分析,两两比较采用SNK-q检验,以P<0.05 为差异有统计学意义。miR-103b在pre-DM中的诊断价值采用受试者工作特征(receiver-operating characteristic, ROC)曲线来描述。
结 果
1 各组人群基线资料的比较
各组间性别、年龄和体质指数(body mass index, BMI)经比较无显著差异(P>0.05)。生化测定结果显示,control组、pre-DM组和NCDM组间的空腹血糖(fasting plasma glucose, FPG)、餐后2 h血糖(2 h postprandial plasma glucose, 2hPG)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)和糖化血红蛋白(hemoglobin A1c,HbA1c)差异有统计学意义(P<0.05),并呈梯度升高,而高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)在3组间差异无统计学显著性(P>0.05),见表1。
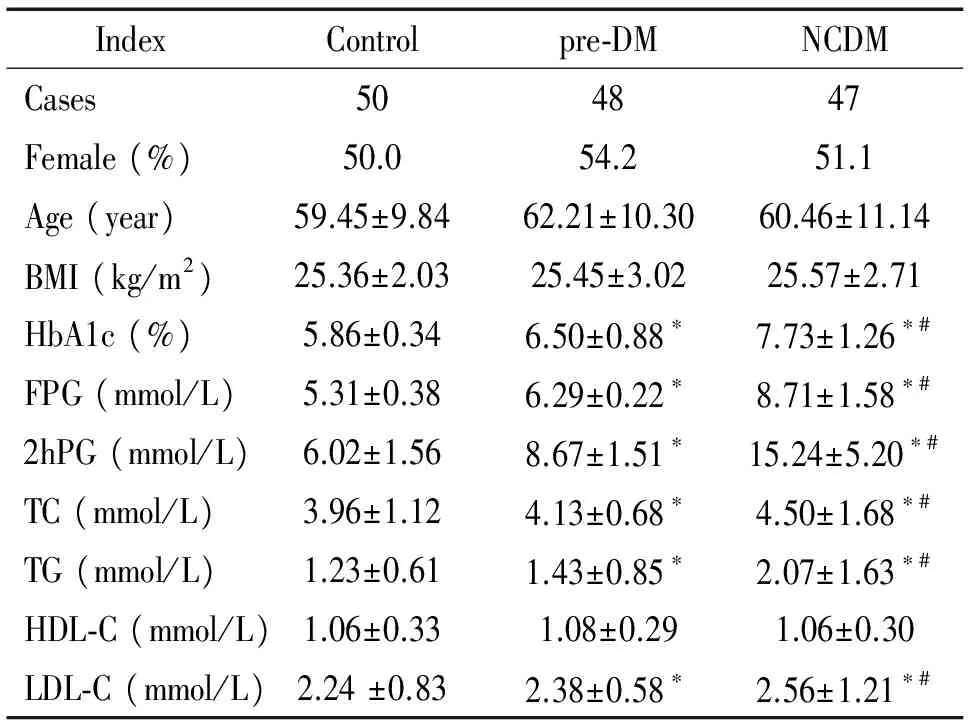
表1 各组人群基线资料比较
*P<0. 05vscontrol group;#P<0. 05vspre-DM group.
2 miR-103的基因定位及保守性分析
由miRbase数据库获得的序列信息可知,miR-103家族在包括人在内的10个物种(人、猩猩、野猪、小鼠、褐家鼠、斑马鱼、安乐蜥、鸭嘴兽、大棕蝠和海七鳃鳗)中具有高度的保守性,采用MEME 4.11.2(http://meme.nbcr.net/)对其保守性与进化关系进行分析,结果表明,miR-103在不同生物中的保守性极高,例如在猩猩、野猪、小鼠、褐家鼠、海七鳃鳗、斑马鱼和鸭嘴兽7个物种间序列均相同,见图1;大棕蝠miR-103序列的前22个碱基与前7个物种相同。hsa-miR-103b定位于人染色体5q34,miR-103在不同物种中的高度保守性,提示其在生物体内可能具有重要的生物学功能,见表2。
3 血清中miR-103b含量的测定
运用real-time PCR检测control组、pre-DM组和NCDM组血清中miR-103b的表达水平,结果显示,与control组相比,pre-DM组和NCDM组循环血清中miR-103b的水平呈下降趋势,差异具有统计学意义(P<0.05);与pre-DM组相比,NCDM组血清中miR-103b表达进一步降低(P<0.05),表明miR-103b血清水平下降可能与糖尿病的发生发展病变进程相关,见图2。

Figure 1. The conservation analysis of miR-103 in different species by MEME 4.11.2.
图1不同物种miR-103的保守性分析
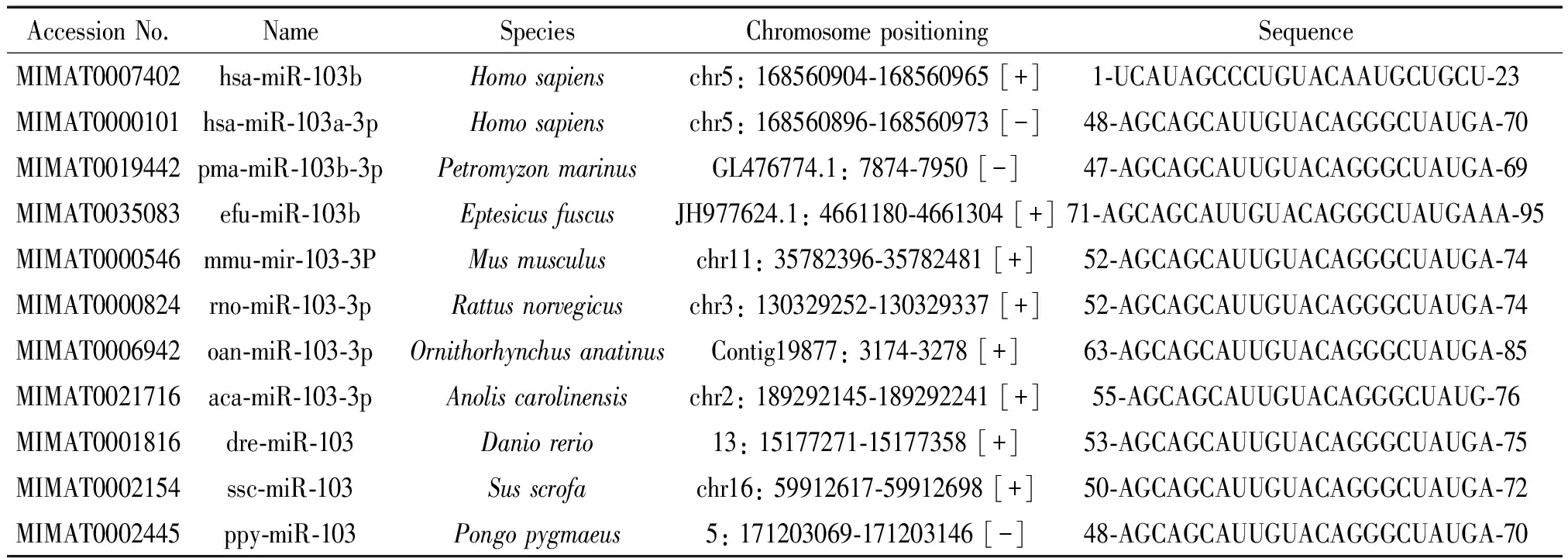
表2 不同物种miR-103的序列同源性分析
The detailed information of miR-103 family in different species. All the data was obtained from miRbase.

Figure 2. The serum level of miR-103b in the 3 groups. Mean±SD.*P<0.05vscontrol group;#P<0.05vspre-DM group.
图2Real-timePCR检测各组血清中miRNA-103b的表达
4 miR-103b靶基因预测及功能分析
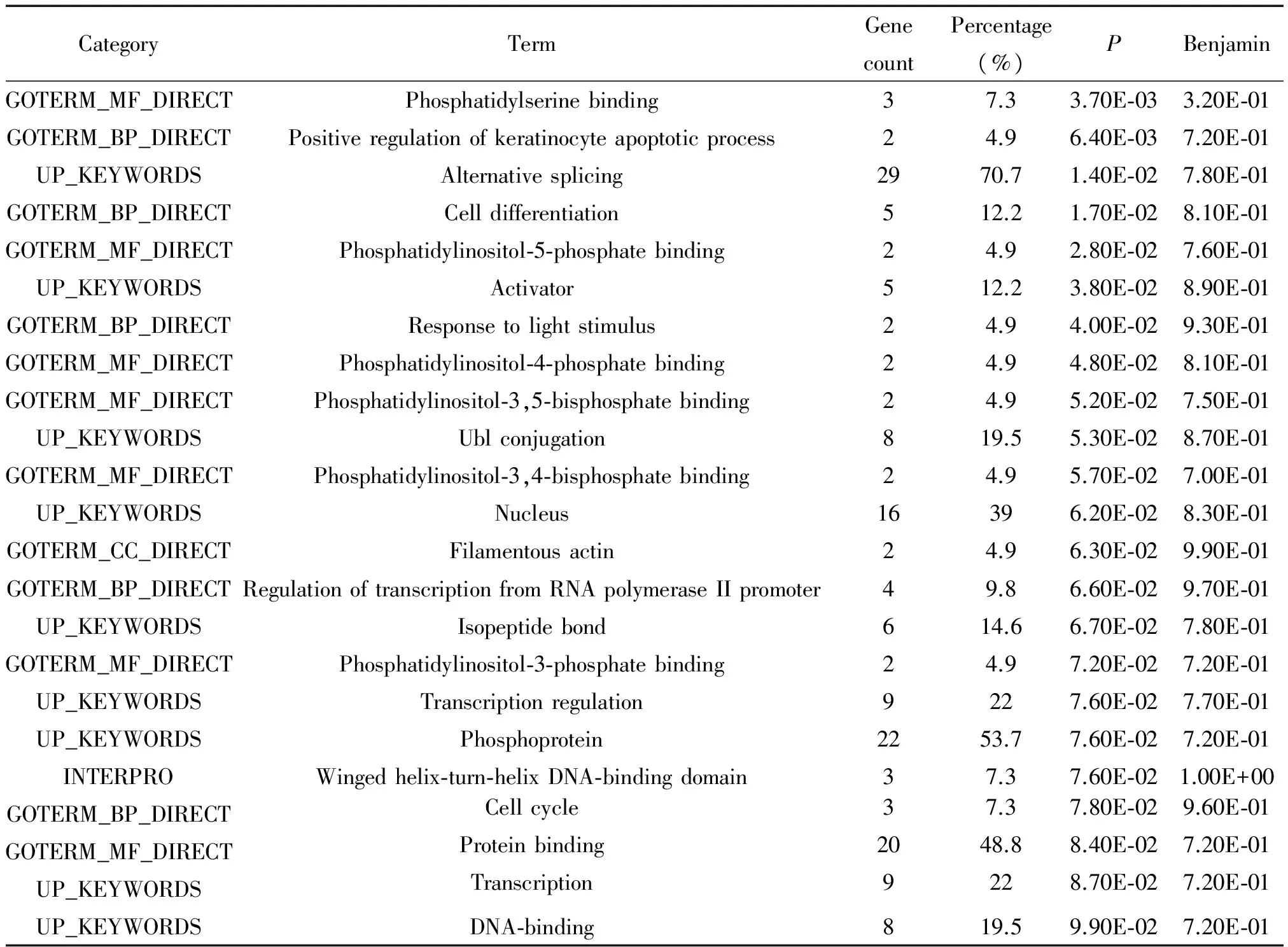
通过TargetScan、miRanda和PicTar三大靶基因预测软件对miR-103b进行靶基因预测,分别为2 327、8 945和737个,取三者预测数据的交集,合计预测靶基因与已在miTarbase数据库中验证的靶基因共53个,见表3。通过进一步应用DAVID 数据库和GO数据库对靶基因功能进行富集分析, 结果显示,从分子功能看, miR-103b的靶基因能调节蛋白质的结合,转录以及通过与PIP3结合激活下游信号通路;从生物学过程看,miR-103b的靶基因主要参与蛋白质氨基酸的磷酸化、RNA聚合酶II启动子转录的调控及DNA依赖的转录调节;参与细胞周期、细胞生长增殖和细胞凋亡;信号转导通路则富集于MAPK信号通路、Ras信号通路、Wnt信号通路和胰岛素信号通路;另外还涉及细胞周期过程和脂肪酸代谢过程中的通路,见表4。以上数据库分析提示miR-103b可能参与糖尿病早期糖脂代谢异常、胰岛素抵抗和随后糖尿病血管病变发生发展等过程相关靶基因的调控。
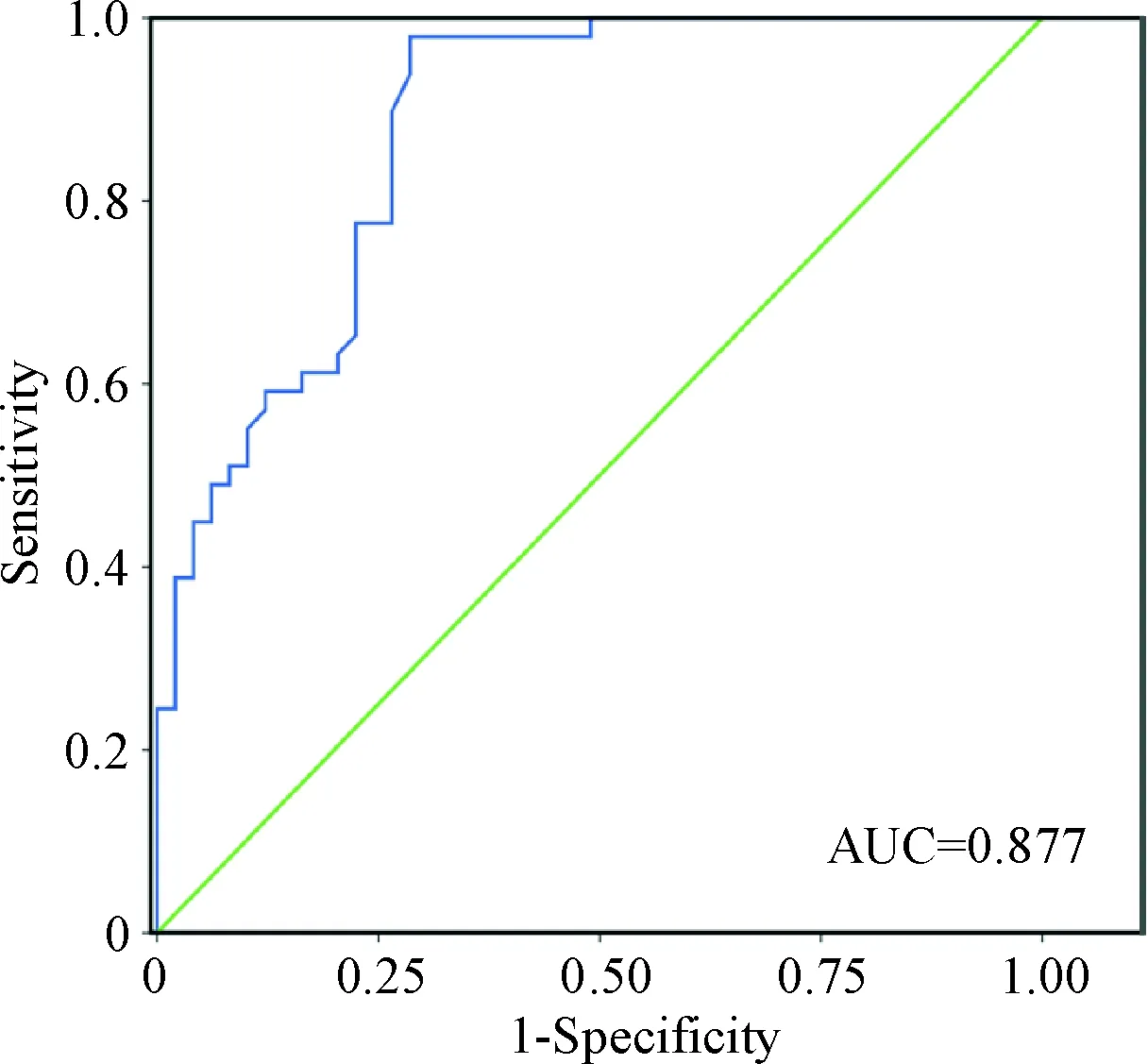
5 miR-103b对糖尿病前期的诊断价值
通过ROC曲线分析miR-103b对pre-DM患者诊断的准确性,用循环血清中miR-103b的相对定量值(临界值为1.633)进行糖尿病前期诊断时的灵敏度为89.8%,特异度为73.5%,曲线下面积(area under the curve,AUC)为0.877 (95% CI 0.809~0.944),见图3。一般认为0.7 表3 预测的has-miR-103b靶基因 表4 hsa-miR-103b 预测靶基因DAVID富集分析 Figure 3. ROC curve analysis for discrimination between the cases of pre-DM group (n=48) and control group (n=50). 图3ROC曲线评价血清miR-103b对糖尿病前期的诊断价值 糖尿病是因胰岛素抵抗或者胰岛素敏感性降低引起的以高血糖为特征的慢性代谢性紊乱疾病[1]。2型糖尿病占全部糖尿病病例的90%。根据国际糖尿病联合会统计,至2013年,全球有3.82亿人患有糖尿病,并将在2035年增长至5.92亿人[8]。近期研究报道,以前糖尿病标准化的评估方式如FPG、OGTT和HbA1c不仅存在一定的局限性还可能漏诊许多DM病例,事实上,在糖耐量受损患者确诊为糖尿病前,已经出现了异常的病理状态如胰岛素抵抗,胰岛B细胞受损甚至已累及其它重要的器官,如眼和肾[8]。研究显示,糖尿病患者产生的胰岛细胞和胰岛素靶组织中miRNA会发生病理性地改变,可特异、敏感、稳定地反映在循环中,甚至在DM患者尚未出现明显临床症状前,循环miRNA可能就已出现异常改变,提示循环miRNA有望作为DM早期诊断的特异性生物学标志物[9]。 研究显示,miRNA能调节多种代谢途径包括胰岛素分泌、葡萄糖稳态以及糖脂代谢[10-14]。本研究提示正常个体、pre-DM患者和DM患者有各自特异性的miRNA表达谱。hsa-miR-103作为microRNA家族中重要的一员,位于人染色体5q34,本文通过生物信息分析miR-103b的碱基序列在各物种间具有高度的保守性在生物体内具有重要的生物学功能。研究发现miR-103不仅在子宫内膜癌、卵巢癌、白血病、胰腺癌和膀胱癌等多种肿瘤中发挥调控作用,且在糖脂代谢和糖尿病的病理进程等方面有着潜在的作用[15]。Trajkovski等[3]研究显示DM2肝病患者、ob/ob小鼠及肥胖小鼠肝脏中高水平miR-103与胰岛素抵抗指数呈正相关,研究进一步发现沉默肥胖糖尿病小鼠miR-103/107的表达,导致小窝蛋白1的表达上调,从而使肝脏葡萄糖输出减少,改善胰岛素敏感性。本研究组前期研究[7]显示2型糖尿病前期患者血小板miR-103b可负调控体内葡萄糖耐受及靶标SFRP4 mRNA和蛋白表达水平,提示miR-103b可成为诊断早期糖尿病的临床标记物。综上所述,miR-103可作为糖尿病肥胖及胰岛素信号传导的关键调节因子。本研究在pre-DM组和DM组中均检测到miR-103表达,而与对照组相较,pre-DM组与NCDM组循环血清中miR-103b表达呈明显下降趋势,NCDM组血清中miR-103b较control组显著降低,提示miR-103b表达下降是糖尿病发生发展的对抗因素,从而进一步证实miR-103b可能参与糖代谢。为验证miR-103b的诊断价值,本研究进一步运用SPSS 16.0对miR-103b诊断能力作ROC曲线进行评价。ROC曲线显示,miR-103b在pre-DM组诊断价值较高,其AUC达到0.877。结果提示循环血清中miR-103b对pre-DM患者具有较高的诊断价值,是诊断糖尿病前期灵敏性和特异性较好的临床标志物。 胰岛素抵抗作为糖尿病的始动因素,而研究证实miR-103在胰岛素抵抗发生发展进程中扮演重要角色[3]。目前,已有大量研究发现信号通路转导与胰岛素抵抗密切相关[16-18]。本文通过对hsa-miR-103b的靶基因进行功能富集分析和信号转导通路富集分析,发现hsa-miR-103b的靶基因主要富集于MAPK 信号通路、Wnt信号通路、Insulin信号通路、细胞周期、细胞凋亡等信号通路,另外还涉及细胞周期过程、脂肪酸代谢过程的通路中。pre-DM患者与T2DM患者通常会代偿性地增强胰岛B细胞分泌胰岛素的效力,随着病情的发展,胰岛B细胞破坏后诱发氧化应激和炎症反应,从而激活MAPK信号通路,MAPK信号通路激活后促进外周胰岛素抵抗,抑制胰岛素的合成与分泌、促进胰岛细胞的凋亡。Wnt信号通路是调控细胞生长、发育和分化的关键通路之一。研究发现,Wnt信号通路不仅能够抑制机体脂肪细胞的生成,还能调节胰岛B细胞的形态和功能[19],结合本研究组前期研究成果,我们推测miR-103b可抑制FRP中SFRP4表达,影响细胞周期素(cyclin)等下游靶标的表达,从而调控胰岛细胞的生长与增殖。InsR/IRS/AKT作为传统的胰岛素信号传递通路,其下游靶基因的活化及InsR与其它分子或基因间的相互作用都会影响糖脂代谢与胰岛素的敏感性。综上所述,miR-103b通过调控这些通路中靶基因的表达, 进而影响到细胞的增殖和凋亡, 改变细胞对胰岛素的敏感性。 综合上述研究结果提示,循环血清中miR-103b表达水平降低有可能成为前期糖尿病和糖尿病病理性进展的一个重要的生物标志物,对糖尿病发作的早期诊断和预防有一定的指示作用,至于血清中miR-103b表达差异在疾病发生中的具体调控机制有待进一步研究。有理由相信,随着miRNAs 在糖尿病研究领域的广泛深入,血清miRNAs应用于诊断早期糖尿病可提高对其的诊治水平,改善预后。 [参考文献] [1] Liddy CE, Cullen-Arseneau P, Merizzi S, et al. “An ounce of prevention”: a primary care based prevention program for pre-diabetic population[J]. Can J Diabetes, 2013, 37(1):12-17. [2] 谭晓勇, 罗 茂, 卢培林, 等. miR-30c调控PAI-1对血管内皮细胞活力和迁移的影响[J]. 中国病理生理杂志, 2016, 32(12):2199-2204. [3] Trajkovski M, Hausser J, Soutschek J, et al. MicroRNAs 103 and 107 regulate insulin sensitivity[J]. Nature, 2011, 474(7353):649-653. [4] Plé H, Landry P, Benham A, et al. The repertoire and features of human platelet microRNAs[J]. PLoS One, 2012, 7(12):e50746. [5] Mahdi T, Hänzelmann S, Salehi A, et al. Secreted frizzled-related protein 4 reduces insulin secretion and is overexpressed in type 2 diabetes[J]. Cell Metab, 2012, 16(5):625-633. [6] 廖于峰, 戴金华, 茅奇峰, 等. 循环miRNA-141对前列腺癌的诊断和预后价值研究[J]. 中国病理生理杂志, 2014, 30(10):1887-1890. [7] Luo M, Li R, Deng X, et al. Platelet-derived miR-103b as a novel biomarker for the early diagnosis of type 2 diabetes[J]. Acta Diabetol, 2015, 52(5):943-949. [8] Kim EK, Sang GL, Choi YH, et al. Association between diabetes-related factors and clinical periodontal parameters in type-2 diabetes mellitus[J]. BMC Oral Health, 2013, 13(1):1-8. [9] Tang X, Muniappan L, Tang G, et al. Identification of glucose-regulated miRNAs from pancreatic β cells reveals a role for miR-30d in insulin transcription[J]. RNA, 2009, 15(2):287-293. [10] Yang Z, Chen H, Si H, et al. Serum miR-23a, a potential biomarker for diagnosis of pre-diabetes and type 2 diabetes[J]. Acta Diabetol, 2014, 51(5):823-831. [11] 杨庆宇, 郜 娜. 利拉鲁肽通过调节microRNA-375对胰岛细胞凋亡的影响[J]. 中国病理生理杂志, 2016, 32(9):1627-1634. [12] Liu Y, Gao G, Yang C, et al. The role of circulating microRNA-126 (miR-126): a novel biomarker for screening prediabetes and newly diagnosed type 2 diabetes mellitus[J]. Int J Mol Sci, 2014, 15(6):10567-10577. [13] Párrizas M, Brugnara L, Esteban Y, et al. Circulating miR-192 and miR-193b are markers of prediabetes and are modulated by an exercise intervention[J]. J Clin Endocrinol Metab, 2015, 100(3):407-415. [14] Zampetaki A, Kiechl S, Drozdov I, et al. Plasma micro-RNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes[J]. Circ Res, 2010, 107(6):810-817. [15] Chen HY, Lin YM, Chung HC, et al. miR-103/107 promote metastasis of colorectal cancer by targeting the metastasis suppressors DAPK and KLF4[J]. Cancer Res, 2012, 72(14):3631-3641. [16] Hyvönen ME, Ihalmo P, Sandholm N, et al. CD2AP is associated with end-stage renal disease in patients with type 1 diabetes[J]. Acta Diabetol, 2013, 50(6):887-897. [17] Ha TS, Hong EJ, Han GD. Diabetic conditions downregulate the expression of CD2AP in podocytes via PI3-K/Akt signaling[J]. Diabetes Metab Res Rev, 2015, 31(1):50-60. [18] Yan S, Wang T, Huang S, et al. Differential expression of microRNAs in plasma of patients with prediabetes and newly diagnosed type 2 diabetes[J]. Acta Diabetol, 2016, 53(5):693-702. [19] Qi W, Yang C, Dai Z, et al. High levels of pigment epithelium-derived factor in diabetes impair wound healing through suppression of Wnt signaling[J]. Diabetes, 2015, 64(4):1407-1419.
讨 论

