一株产耐高温β-甘露聚糖酶菌株的筛选鉴定
罗长财,缪静,李国莹,杜瑶,余晓斌
1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;
2.鲁东大学 生命科学学院,山东 烟台 264025
β-甘露聚糖酶(EC3.2.1.78)广泛存在于动物、植物及微生物中,是一种能降解β-1,4-甘露糖苷键的水解酶,可应用于饲料、食品加工、生物能源、纺织、造纸、石油开采等领域[1-2]。
采用微生物生产β-甘露聚糖酶,具有表达量高、易于工业化发酵生产及后处理、生产成本相对低廉等特点,因而成为β-甘露聚糖酶工业化生产的主要方式[3]。目前已有来源于黑曲霉(Asper⁃gillus niger)[4]、枯草芽胞杆菌(Bacillus subtilis)[5]、费氏新萨托菌(Neosartorya fischeri)[6]、硫色曲霉(A.sulphureus)[7]、热杆梭菌(Clostridium thermocel⁃lum)[8]等菌种的β-甘露聚糖酶获得表达及应用。
β-甘露聚糖酶在工业化应用时,经常会涉及到高温处理过程,而导致酶失活。因此,为满足各种工业应用要求,提高β-甘露聚糖酶的耐高温性能一直是急需解决的问题。
近年来,一些极端环境下生长的微生物被分离、筛选出来,如从海底火山口的硫磺矿区分离出来的极端铁代谢嗜热菌Pyrodictium abyssi,可在80~110℃范围内生长[9]。这些可耐受极端环境的微生物蕴藏着丰富的酶基因资源[10],因此,寻找产β-甘露聚糖酶的嗜热菌,就成为开发耐高温β-甘露聚糖酶的有效途径。
我们从热泉(水温高于68℃)中分离、筛选出一株产β-甘露聚糖酶的极端嗜热细菌。在本研究中,我们采用多种方法鉴定出该菌为一种极端嗜热的枯草芽胞杆菌。另外,通过对该菌所产β-甘露聚糖酶进行测试,发现其耐高温性能良好。
1 材料与方法
1.1 材料
槐豆胶(G0573)购自Sigma-Aldrich公司;酵母粉、胰蛋白胨购自Oxoid公司;魔芋精粉购自湖北强森魔芋科技有限公司;Ezup柱式细菌基因组DNA抽提试剂盒购自上海生工生物工程股份有限公司。
富集培养基:胰蛋白胨1.5 g/L,酵母粉1 g/ L,氯化钠1 g/L,MgSO4·7H2O 1 g/L,KCl 0.5 g/ L,KH2PO40.5 g/L,FeCl31 g/L,CaCl20.23 g/L,(NH4)2SO41 g/L,pH7.0。
LB琼脂筛选固体培养基[11]:胰蛋白胨10 g/ L,酶母粉5 g/L,氯化钠10 g/L,槐豆胶6 g/L,刚果红5 g/L,琼脂粉20 g/L。
LB固体培养基:胰蛋白胨10 g/L,酶母粉5 g/L,氯化钠10 g/L,琼脂粉20 g/L(LB液体培养基不含琼脂)。
发酵培养基:磨芋精粉20 g/L,(NH4)2SO410 g/L,NaNO35 g/L,MgSO4·7H2O 2.5 g/L,KH2PO41.5 g/L。
恒温恒湿培养箱、恒温摇床(上海一恒科学仪器有限公司);紫外-可见光分光光度计(岛津公司);梯度PCR扩增仪(珠海黑马医学仪器有限公司);高速冷冻离心机(湖南湘仪离心机仪器有限公司);精密pH计(上海雷磁仪器厂)。
1.2 菌体富集培养及筛选
将取自热泉(位于江西省抚州市境内,水温高于68℃)出水口处的水样及泥沙样本于无菌条件下分别接入富集培养基中,60℃、200 r/min培养24 h,取培养物涂布LB琼脂筛选固体培养基,于42℃培养箱中静置培养48 h。
1.3 菌株鉴定
1.3.1 形态观察 将筛选出的单菌落于LB固体培养基上划线培养,培养2 d后观察菌落特征,并送江南大学分析测试中心进行电镜检测。
1.3.2 生理生化培养鉴定 参照《常见细菌系统鉴定手册》[12]及《微生物学实验手册》[13]中的鉴定方法,对筛选出的产β-甘露聚糖酶菌种进行生理生化检测,初步完成菌种鉴定。
1.3.3 16S rDNA鉴定 采用Ezup柱式细菌基因组DNA抽提试剂盒,提取所筛选菌株的基因组DNA,利用通用引物27F(AGAGTTTGATCCTCGC TCAG)和1492R(TACGGYTACCTTGTTACGACTT)进行PCR扩增(94℃预变性3 min;94℃变性60 s,55℃退火45 s,72℃延伸60 s,30个循环;72℃延伸10 min),获得目标菌株的16S rDNA。PCR产物经琼脂糖凝胶电泳回收纯化后,送上海生工公司测序,所测定的16S rDNA序列通过NCBI进行比对,寻找同源性高的序列,再利用MEGA5.2软件绘制出该菌株的系统发育树。
1.4 菌体在不同温度、pH值下的生长测试
在30~85℃及不同pH值条件下,分别采用LB液体培养基以200 r/min培养24 h,8000×g离心10 min,菌体于120℃烘干至恒重,检测不同条件下的菌体生长量。根据菌体量以确定该菌株在不同条件下的生长状况。
1.5 菌株发酵及酶液制备
分离、筛选获得的菌株在500 mL三角瓶中进行发酵产酶培养,初始装液量为100 mL,初始pH7.0,温度50℃,转速200 r/min,发酵36 h。发酵结束后,8000×g下离心10 min,对上清液进行后续检测。将该菌株所产的β-甘露聚糖酶命名为BS-Man。
1.6 甘露聚糖酶活力测定
1.6.1 测定方法 采用DNS法检测β-甘露聚糖酶酶活。用0.1 mol/L、pH5.5的乙酸-乙酸钠缓冲液稀释酶液及配制反应底物(6 g/L槐豆胶),吸取2.0 mL经37℃预热的待测酶液至试管中,加入2.0 mL经37℃预热的底物溶液,振荡,37℃精确水浴30 min,然后加入5.0 mL DNS试剂,振荡混匀,以终止酶解反应。整个反应体系在沸水中加热5 min后,用自来水冷却至室温,加水定容至25.0 mL,振荡混匀。以标准空白样作为空白对照,测定D540nm值,通过标准曲线计算相应的酶活。1.6.2 酶活定义 在37℃、pH5.5的条件下,每分钟从3 mg/mL甘露聚糖溶液中水解释放1 μmol还原糖所需酶量为一个酶活单位(U)。
1.7 BS-Man的最适反应pH值
分别添加等量的BS-Man酶液,在37℃、不同pH值(1.5~10)条件下反应30 min(pH1.5~5.0:磷酸氢二钠-盐酸缓冲液;pH5.0~8.5:磷酸氢二钠-磷酸二氢钾缓冲液;pH8.5~10.0:甘氨酸-氢氧化钠缓冲液),测定不同pH值下的酶活性,以所测得最高酶活性为100%,其余不同pH值条件下所测酶活力与之相比,得到该酶在不同pH值下的相对酶活,从而确定其最适pH值。
1.8 BS-Man的最适反应温度及耐热性能测试
在最适pH值条件下,于不同温度(30~80℃)反应30 min,设定最高酶活为100%,其余反应温度下所测出的酶活力与之相对比,获得各反应温度下的相对酶活,以确定该酶的最适反应温度。
另外,为确定该酶的耐高温性能,在相同条件下,各组取等量酶液在不同温度(60~90℃)预处理不同时间,以未经热处理的酶液酶活力为100%,各处理组与之相比,获得该酶经不同温度处理后的剩余相对酶活,确定其耐高温性能。
2 结果
2.1 产β-甘露聚糖酶的菌株筛选
对富集培养后的培养产物,采用添加魔芋精粉及刚果红的LB固体筛选培养基进行菌种筛选,结果如图1,在LB固体培养基上生长出的菌落呈白色,表面粗糙不规则,有隆起、皱褶。所挑选菌落的水解透明圈与菌落大小见表1,根据H/C比值,选取2号菌落进行后续鉴定,并将该菌株命名为TBS2。
2.2 菌种鉴定
2.2.1 形态观察 TBS2在电镜下的形态见图2,该菌呈杆状,可见内生孢子,无荚膜,长有鞭毛,符合芽孢杆菌的形态特征。
2.2.2 生理生化鉴定 TBS2的生理生化测试结果见表2,参照鉴定手册,可以初步判定TBS2为芽胞杆菌属菌株。
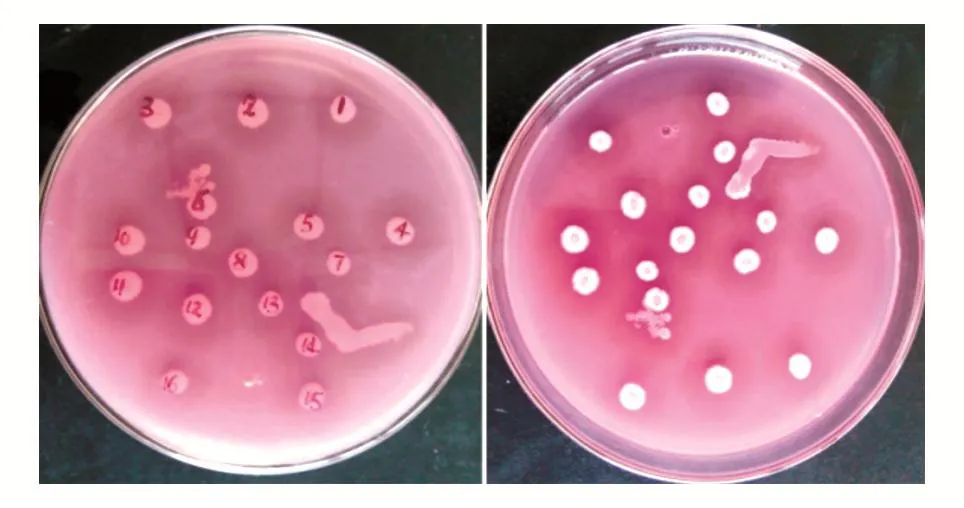
图1 产β-甘露聚糖酶生产菌株筛选

图2 TBS2在电镜下的形态(10 000×)

表1 各菌落水解透明圈与菌落直径
2.2.3 16S rDNA鉴定 以提取的TBS2基因组DNA为模板、27F和1492R为引物进行PCR扩增,获
得一条约1.5 kb的条带(图3),测序结果表明该序列总长为1503 bp。在NCBI数据库中进行BLAST比对,选取相似序列,采用MEGA5.2构建菌株的系统发育树如图4。可以看出,TBS2与枯草芽孢杆菌位于同一分支,同源性最高,达到99%。因此,结合以上菌体形态、生理生化特征,可以确定我们从热泉中分离、筛选获得的微生物为一种嗜热枯草芽孢杆菌。
2.3 TBS2在不同温度及pH值条件下的生长性能

图3 TBS2的16S rDNA PCR产物分析M:DNA marker;1:PCR扩增产物

图4 TBS2系统发育进化树

表2 TBS2生理生化特征
将筛选出的嗜热枯草芽胞杆菌TBS2,在不同温度及pH值条件下,于LB液体培养基中进行生长培养。结果表明,TBS2可在35~80℃下生长,温度低于35℃及高于85℃时均不生长,最适生长温度为50℃。此外,该菌株可在pH4.0~9.0范围内生长,最适生长pH值为6.0~7.0,该结果与段蕾等报道的枯草芽孢杆菌CD-3一致[14]。
2.4 BS-Man的最适pH值测定
由TBS2所产β-甘露聚糖酶BS-Man的反应pH值曲线(图5)可以看出,BS-Man的最适反应pH值为6.0。
2.5 BS-Man的最适反应温度及耐热性能
由BS-Man的反应温度曲线(图6)可以看出,BS-Man的最适反应温度为55℃。
BS-Man的耐热性能曲线如图7,在60~70℃处理不超过60 min时,酶活损失量很小,但随着处理温度及时间的增加,酶活损失加剧,但即使这样,该酶在 90℃处理 10 min,剩余酶活仍达63.6%,这表明我们筛选出的菌株所产β-甘露聚糖酶具有良好的耐高温性能。
3 讨论
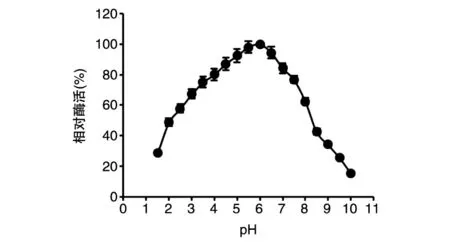
图5 BS-Man的反应pH值曲线
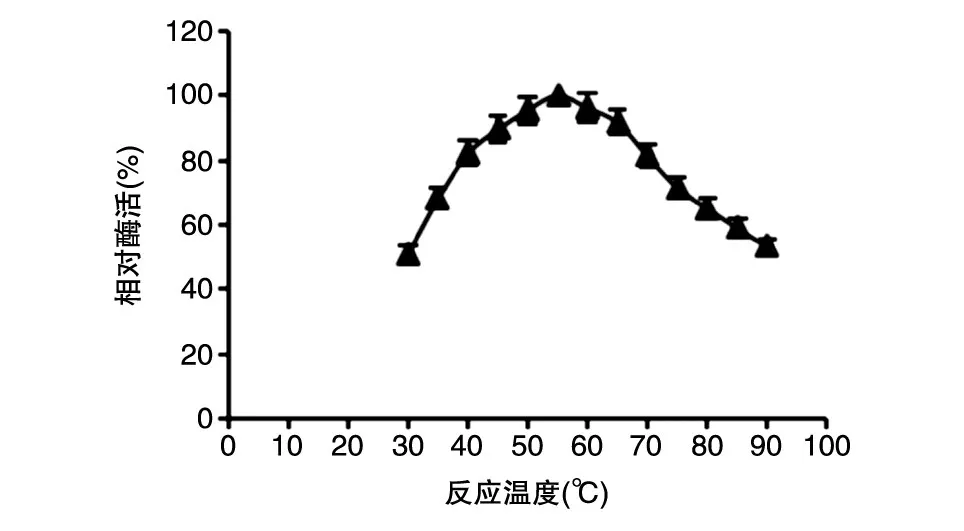
图6 BS-Man的反应温度曲线
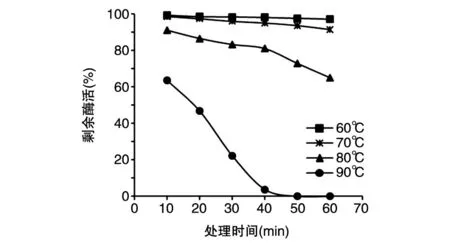
图7 BS-Man在不同温度下的耐热性能
β-甘露聚糖酶应用广泛,但在很多领域内应用时须具有良好的耐高温能力。如饲料制粒时,通常要求在85℃以上处理3 min左右,一般的酶在这种条件下极易完全变性,从而失去效果。因此,作为一种合格的饲料用酶,要求所开发的β-甘露聚糖酶至少能耐受85℃以上的高温。
目前已开发出的β-甘露聚糖酶的耐高温性能普遍不高,难以满足现有工农业生产需求,因此,开发出一种具有优良耐高温性能的β-甘露聚糖酶具有良好的市场应用前景。
为提高β-甘露聚糖酶的耐高温性能,有人尝试过采用定点突变、添加保护剂或在酶蛋白表面进行物理包被等方法,以改变酶蛋白的空间结构,或避免酶蛋白与热气直接接触来提高其耐高温性能[15-16],但所取得的效果并不理想。
极端环境下生长的微生物,如极端嗜热、极端嗜盐等微生物,往往有极强的耐受能力,具有优异而特殊的基因资源。因此,这些微生物成为目前生物资源开发的一大宝库。至2001年,已有60多种极端微生物被发现并利用[17]。通常,极端嗜热的微生物所产生的酶往往具有极高的热稳定性、pH值稳定性和耐受化学或物理变性剂的优良特性,如耐高温α-淀粉酶、DNA聚合酶等的开发即是非常有代表性的例子。因此,从环境中直接筛选极端嗜热微生物,通过分子生物学技术克隆相关基因,进一步进行相应的优化、改造,并选择合适的表达系统高效表达,是耐高温酶制剂开发的一个发展方向,更具有可行性和可操作性,可产生巨大的工业化生产、应用价值。
在本研究中,我们从热泉中分离、筛选出一株极端嗜热的枯草芽孢杆菌TBS2,该菌所产的耐高温β-甘露聚糖酶具有良好的耐高温性能,这为我们后续的重组耐高温β-甘露聚糖酶的开发及应用奠定了坚实的基础。
[1] Chauhan P S,Puri N,Sharma P,et al.Mannanases: microbial sources,production,properties and potential biotechnological applications[J].Appl Microbiol Biotech⁃nol,2012,93(5):1817-1830.
[2] Malherbe A R,Rose S H,Viljoen-Bloom M,et al. Expression and evaluation of enzymes required for the hydrolysis of galactomannan[J].J Ind Microbiol Bio⁃technol,2014,41(18):1201-1209.
[3] Luo H,Wang Y,Wang H,et al.A novel highly acid⁃ic beta-mannanase from the acidophilic fungus Bispo⁃ra sp.MEY-1:gene cloning and overexpression in Pi⁃chia pastoris[J].Appl Microbiol Biotechnol,2009,82(3): 453-461.
[4] Yu S,Li Z,Wang Y,et al.High-level expression and characterization of a thermophilic β-mannanase from Aspergillus niger in Pichia pastoris[J].Biotechnol Lett,2015,37(9):1853-1859.
[5] Vu T T,Quyen D T,Dao T T,et al.Cloning,highlevel expression,purification and properitie of a novel endo-beta-1,4-mannanase from Bacillus subtilis G1 in Pichia pastoris[J].J Microbiol Biotechnol,2012,22 (3):331-338.
[6] Yang H,Shi P,Lu H,et al.A thermophilic β-man⁃nanase from Neosartorya fischeri P1 with broad pH stabilityand significanthydrolysisability ofvarious mannan polymers[J].Food Chem,2015,173:283-289.
[7] Chen X L,Cao Y H,Ding W Q,et al.Cloning,func⁃tionalexpression and characterization ofAspergillus sulphureus β-mannanase in Pichia pastoris[J].J Bio⁃technol,2007,128(3):452-461.
[8] Ghosh A,Verma A K,Gautam S,et al.Structure and functional investigation of ligand binding by a family 35 carbohydrate binding module(CtCBM35)of β-man⁃nanase of family 26 glycoside hydrolase from clostridi⁃um thermocellum[J].Biochemistry(Moscow),2014,79(7): 672-686.
[9] Rieger G,Rachel R,Hermann R,et al.Ultrastructure of the hyperthermophilic archaeon Pyrodictium abyssi [J].J Struct Biol,1995,115:78-87.
[10]Leuschner C,Antranikian G.Heatstable enzymes from extremely thermophilic and hyperthermophilic microor⁃ganisms[J].World J Microbiol Biotechnol,1995,11(1): 95-114.
[11]Downie B,Hilhorst H W M,Bewley J D.A new as⁃say for quantifying endo-β-D-mannanase activity us⁃ing congored dye[J].Phytochemistry,1994,36(4):829-835.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13]周德庆.微生物实验手册[M].上海:上海科学技术出版社,1986.
[14]段蕾,高润池,许波,等.β-甘露聚糖酶产生菌的分离·鉴定及酶学特性研究[J].安徽农业科学,2008,36(24): 10311-10314.
[15]Zhou Haiyan,Yang Wenjiao,Tian Yun,et al.N-termi⁃nal truncation contributed to increasing thermal stabili⁃ty of mannanase Man1312 without activity loss[J].J Sci Food Agric,2016,96(4):1390-1395.
[16]刘朝辉,武伟娜,刘跃,等.保护剂提高β-甘露聚糖酶热稳定性的研究[J].天津大学学报,2008,41(1):114-118.
[17]唐雪明,王正祥,诸葛健.具有工业应用价值的高热稳定性极端酶[J].食品与发酵工业,2001,27(5):65-70.

