阿尔茨海默病重组4Aβ15-TF亚单位疫苗的免疫原性研究
周果,李庆丽,陈博阳,师丹阳,陆健昇,周晓巍,余云舟
军事医学研究院 生物工程研究所,北京 100071
阿尔茨海默病(Alzheimer's disease,AD)俗称老年痴呆,是一种伴随着记忆力减退、认知功能障碍的神经退行性疾病,由德国医生Alzheimer Alois于1906年首次发现[1]。目前它是老年人中仅次于心、脑血管病和癌症的第四大致死病,给患者的家庭和社会造成了极大的经济负担和压力。AD发病机制的主流假说是由Hardy于1992年提出的淀粉样蛋白级联假说(amyloid cascade hypothesis),该假说认为患者脑内淀粉样前体蛋白(amyloid precursor protein,APP)水解产生过量有毒性的β淀粉样蛋白(β-amyloid,Aβ)的聚集,是产生神经毒性的主要原因[2-3]。目前认为AD的主要组织病理学特征是患者大脑中胞外过度积累的Aβ42形成的淀粉样斑块,以及细胞内由过度磷酸化的Tau蛋白形成的神经纤维缠结[4]。因此,以毒性Aβ作为靶标,成为很多研究者治疗AD的着力方向。
将Aβ作为重要靶标,通过主动免疫或被动免疫的方式清除过多聚集的Aβ是预防或治疗AD的主要方法[4-5]。1999年Schenk等首次将人纤维化的Aβ42用于免疫AD转基因小鼠并取得了一定的效果[6-7];一年后,Elan和Wyeth研究的AN-1792疫苗以人源纤维化Aβ42联合QS21佐剂首次进行了临床试验,在Ⅰ期实验中取得初步性良好反应后,临床Ⅱ期有6%的患者出现了脑膜炎而被迫终止了实验[8-9],多数人认为患者存在自身毒性T细胞免疫反应可能是炎症出现的原因[10]。Aβ42是由1个B细胞表位(1~15)和2个T细胞表位(17~21,29~42)组成的多肽,研究发现,许多利用Aβ的N端B细胞表位制备的抗原蛋白免疫动物或AD模型动物后均能诱发Th2型免疫反应,避免Th1型炎症细胞反应[11],因此AD免疫治疗的研究方向是选择靶向Aβ42的B淋巴细胞表位作为抗原疫苗。
本研究中重组融合抗原4Aβ15-TF采用的是Aβ42的B淋巴细胞表位Aβ15,同时基于研究表明Aβ分子中具毒性的是Aβ寡聚体[12-13],而进行了4个拷贝多重复串联,形成多聚体结构,并加入一个辅助T细胞表位(AKFVAAWTLKAAA,简称TF),能够刺激机体产生相应的T淋巴细胞反应,增加抗原的免疫原性。结果显示,该重组融合抗原免疫C57BL/6小鼠取得了良好的免疫效果,为进一步研究靶向Aβ的AD重组亚单位疫苗奠定了基础。
1 材料与方法
1.1 材料
6~8周龄雌性SPF级C57BL/6小鼠购自军事医学研究院实验动物中心;大肠杆菌BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;大肠杆菌Top10感受肽细胞和DNA纯化回收试剂盒购自天根生物科技(北京)有限公司;pTIG-Trx原核表达载体为本实验室保存;DNA聚合酶Prime STAR和T4DNA连接酶购自TaKaRa公司;限制性内切酶购自NEB公司;质粒小提试剂盒购自Omega公司;山羊抗小鼠IgG-HRP购自ZSGBBIO公司;山羊抗小鼠IgG1/IgG2a/IgG2b/IgG3/IgMHRP购自Santa Cruz公司;蛋白质分子量标准、转膜缓冲液和Western印迹显色试剂盒购自Thermo公司;基因和引物合成、基因测序、Aβ42多肽合成由上海生工生物工程股份有限公司完成。
1.2 原核表达载体的构建
重组融合蛋白4Aβ15-TF的基因序列由上海生工生物工程股份有限公司合成,并引入EcoRⅠ和XhoⅠ酶切位点,琼脂糖凝胶电泳后纯化回收得到目的片段,与原核表达载体pTIG-Trx双酶切后室温连接2 h,然后将连接产物转化大肠杆菌Top10感受态,37℃过夜孵育,挑取单克隆菌落培养并提取质粒进行双酶切鉴定,将阳性克隆测序验证。
1.3 重组融合蛋白4Aβ15-TF的表达和纯化
将测序正确的质粒转化大肠杆菌表达菌株BL21(DE3)感受态细胞,过夜培养,挑取单克隆接种到5 mL 2×YT培养基(含100 μg/mL氨苄西林)中,37℃、220 r/min培养至菌液D600nm值达到0.6~1.0,按1%的比例转至200 mL培养基中,37℃、220 r/min培养至菌液D600nm值达到0.6~1.0,加入终浓度为0.2 mmol/L的IPTG诱导表达,16℃、220 r/min过夜培养,8000 r/min离心10 min收集菌体,去掉上清培养基,用20 mmol/L pH8.0的PB缓冲液重悬,冰水浴条件下超声波破碎,待破碎完全后4℃、8000 r/min离心20 min,收集上清用0.45 μm的滤纸过滤,加入终浓度为20 mmol/L的咪唑,以1 mL/min的速度让上清穿过Ni柱使目的蛋白与其结合,上样结束后用50~500 mmol/L咪唑进行梯度洗脱,最后用SDS-PAGE对收集的蛋白进行纯度和含量鉴定,
1.4 Western印迹鉴定目的蛋白
纯化好并脱去咪唑的目的蛋白用Western印迹进一步鉴定。样品电泳结束后于转膜缓冲液中浸泡15 min,按下层滤纸、PVDF膜、SDS-PAGE胶、上层滤纸的顺序叠加铺于转膜仪上(避免气泡),620 mA转膜20 min,将膜于5%脱脂牛奶中室温封闭2 h,加入1∶500稀释的抗Aβ42抗体,室温孵育2 h,用TBS-T洗膜3次,每次10 min,加入1∶5000稀释的山羊抗小鼠IgG-HRP,室温孵育30 min,TBST洗膜3次,每次10 min,将West⁃ern印迹显影液A液和B液按1∶1的体积配制1 mL,用凝胶成像仪曝光显影。
1.5 重组亚单位疫苗免疫C57BL/6小鼠
将6~8周龄的SPF级雌性C57小鼠随机分成实验组和阴性对照组,每组8只。实验组每只小鼠每次免疫蛋白的剂量为5 μg,将重组抗原蛋白用无菌的PBS稀释至50 μg/mL,并在配制疫苗时加入1/10体积的铝佐剂(10 mg/mL)而成亚单位疫苗,采用肌内注射方式,注射体积100 μL,免疫3周后剪尾采血,每间隔3周加强免疫,共4次,免疫方案不变。
1.6 重组亚单位疫苗免疫后抗体水平、滴度和亚型测定
用包被液稀释人工合成抗原Aβ42至终浓度为2 μg/mL,酶联板每孔加入100 μL,4℃过夜包被抗原;用PBS-T洗涤6次,每孔加入200 μL 2%牛血清白蛋白(BSA),37℃封闭2 h;将采集的血清样品于4℃、5500 r/min离心10 min后取上清,按1∶100稀释(抗体滴度和亚型的测定先进行1/ 100稀释,再按1/4梯度稀释),每孔加入稀释好的血清100 μL,37℃孵育2 h,PBS-T洗6次,每孔50 μL加入1∶5000用封闭液稀释的山羊抗小鼠的IgG-HRP(或IgG1-HRP/IgG2a-HRP/IgG2b-HRP/ IgG3-HRP/IgM-HRP),37℃孵育0.5 h,PBS-T洗6次,加入50 μL现配的显色液(240 mmol/L柠檬酸,50 mmol/L Na2HPO4,0.4 mg/mL OPD,0.1% H2O2),避光显色10 min后用2 mol/L的H2SO4终止反应,酶标仪读取D492nm及D630nm值。血清抗体水平取样品的平均值,抗体滴度用终末稀释ELISA法计算,以D492nm≥0.3为阳性结果。
1.7 细胞免疫水平测定
小鼠断颈处死后在75%乙醇溶液中浸泡30 min,于超净台中取脾,用玻璃棒在400目细胞筛上研磨,用5 mL RPMI-1640培养基冲洗细胞筛,收集脾细胞悬液于15 mL离心管中,800 r/min离心10 min,弃上清;用5 mL NH4Cl吹打重悬沉淀,放置5 min,800 r/min离心10 min,弃上清;重复2次后加入5 mL RPMI-1640培养基(含10% FBS)重悬并计数;用RPMI-1640培养基稀释脾细胞悬液至1×106/mL,在96孔板每孔中加入100 μL脾细胞悬液,并加入浓度为5 μg/mL的Aβ42和TF 100 μL,同时设置未刺激的空白对照组和ConA刺激的阳性对照组,每个组设置3个重复孔;将混匀后的96孔细胞板放入CO2细胞培养箱中,37℃培养3 d后在超净工作台中于每孔分别加入10 μL MTS,继续培养4~5 h,测定各孔的D492nm值,计算刺激指数(stimulate index,SI)。

1.8 统计学分析
实验数据以x±s表示,用SPSS统计学软件采用单因素方差进行分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 原核表达载体的构建
用柔性肽GS将4个Aβ15串联,加入辅助T细胞表位,并对氨基酸表位进行密码子优化,N端添加EcoRⅠ酶切位点,C端添加XhoⅠ酶切位点,合成基因序列4Aβ15-TF(图1),将该基因克隆到原核表达载体pTIG-Trx中,用试剂盒提取该质粒进行双酶切鉴定,鉴定正确的载体测序验证,构建成pTIG-Trx-4Aβ15-TF。
2.2 重组融合蛋白4Aβ15-TF的表达、纯化及鉴定
鉴定正确的质粒转化表达后,用pH8.0的PB缓冲液重悬收集的菌体,冰水浴下进行超声波破碎,破碎后收集上清,表达的目的蛋白主要以可溶性方式存在于上清中,用0.45 μm的滤纸过滤后经Ni柱纯化,将纯化后的蛋白进行SDS-PAGE和Western印迹(图2),蛋白大小约为20 000(二聚体),且能特异性与抗Aβ42抗体结合,经鉴定为本研究所设计的蛋白。
2.3 重组亚单位疫苗免疫C57BL/6小鼠后抗体水平、滴度和亚型测定
用ELISA检测小鼠免疫后的体液免疫反应。抗体水平测定结果表明(图3),重组融合抗原4Aβ15-TF免疫小鼠产生了较强的针对Aβ42的特异性抗体,初次免疫后的血清抗体水平免疫组明显高于PBS组,具有极其显著的差异(P<0.01),抗体的水平随免疫次数的增加而提高。抗体滴度结果如图4,4次免疫后免疫组抗体滴度可达1∶120 000左右,相对于PBS组具有明显差异(P< 0.01),由此表明嵌合疫苗能够诱导机体产生较强的体液免疫反应。
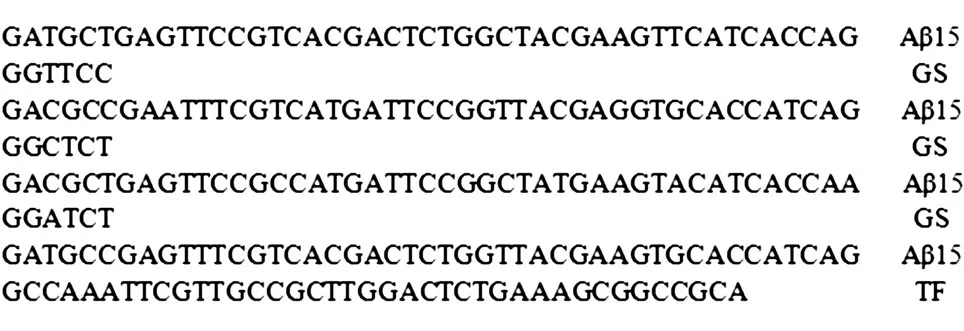
图1 重组融合蛋白4Aβ15-TF的基因序列
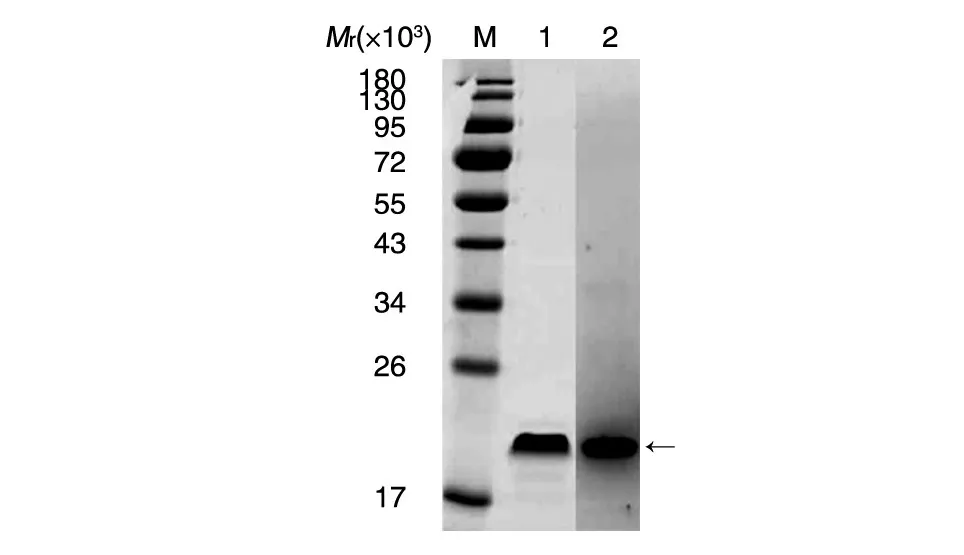
图2 目的蛋白纯化后的SDS-PAGE和Western印迹M:蛋白marker;1:SDS-PAGE鉴定纯化产物;2:Western印迹鉴定纯化产物;箭头示目的蛋白条带(20 000)
另外,对第3次免疫后采取的血清的抗体亚型进行了测定,结果表明(图5)这种抗原免疫小鼠后产生的抗体亚型主要是IgG1,并且伴随着少量的IgG2b,这说明抗原免疫后所产生抗体的主要来源是Th2型免疫反应。
2.4 重组亚单位疫苗免疫C57BL/6小鼠后T淋巴细胞增殖实验
将免疫后小鼠的脾脏取出,分离淋巴细胞,用抗原刺激后,在CO2孵箱中培养 4 d,测定细胞的增殖情况,结果见图6。经Aβ42抗原刺激的免疫组淋巴细胞增殖情况与对照组相比没有明显差异(P>0.05),没有产生特异性的针对Aβ42的T细胞免疫反应;而经TF刺激的免疫组产生了相应的T细胞免疫反应,且与对照组相比有极其显著的统计学差异(P<0.01)。
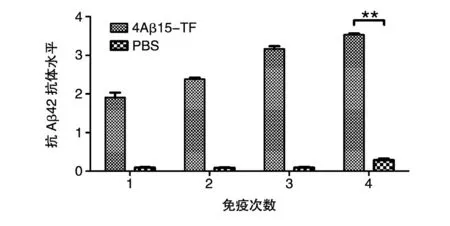
图3 重组亚单位疫苗免疫小鼠后产生的特异性抗体水平
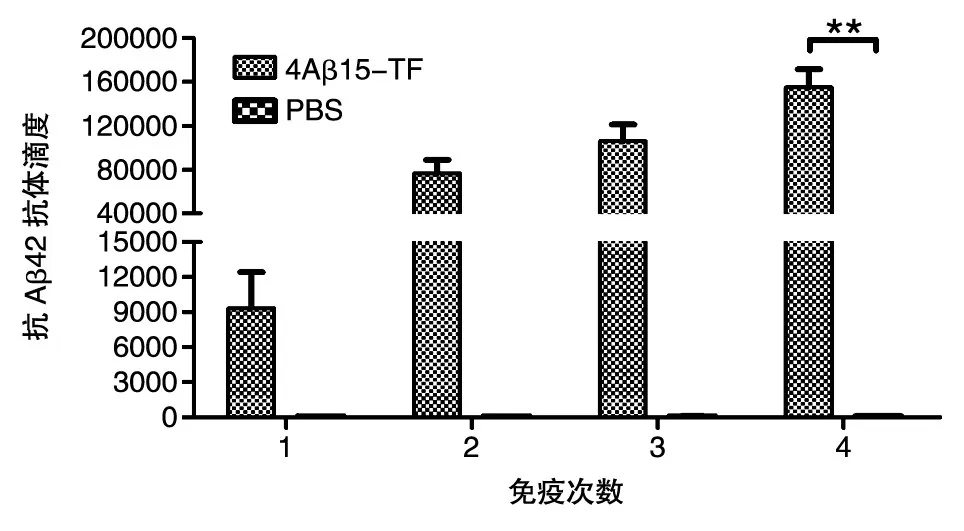
图4 重组亚单位疫苗免疫小鼠后的抗体滴度
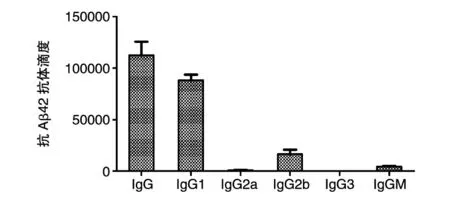
图5 重组亚单位疫苗免疫小鼠后抗体亚型测定
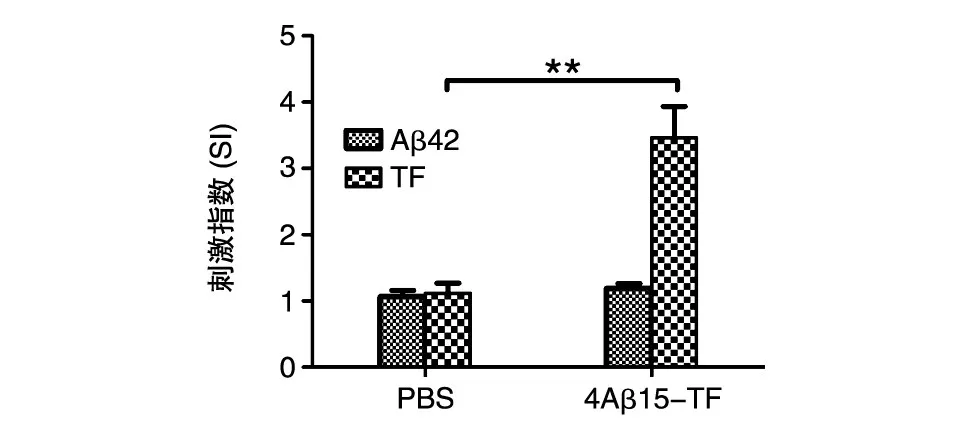
图6 重组蛋白免疫小鼠后脾细胞经抗原刺激的增殖情况
3 讨论
早期针对Aβ的主动免疫治疗研究有2个问题,一是主动免疫用抗原免疫原性相对较差;二是临床试验中出现了炎症反应,研究表明炎症的出现是因为机体产生了针对Aβ42的Th1型细胞免疫反应。针对这些问题,我们只选取Aβ42中的B细胞表位Aβ15构建疫苗抗原分子,以避免出现自身Th1型炎症细胞免疫反应;另外,Aβ分子中具毒性的是Aβ寡聚体,故将多个Aβ15分子用GS串联,形成多聚体结构,同时融合了一个辅助性T细胞表位TF,以增强抗原的免疫原性。先前,本研究室利用这种策略研究6Aβ15-T重组融合蛋白抗原,结果表明该分子作为抗原疫苗具有良好的免疫原性,免疫小鼠后产生了高滴度的针对Aβ42的特异性抗体,并进一步证明其在AD模型鼠上也有着良好的免疫治疗效果[14-15]。
将分子佐剂与蛋白疫苗结合,再共同作用于机体,也能增强疫苗的免疫原性。本实验室在先前研究中用重组融合抗原联合了几种常见的佐剂免疫小鼠,结果发现铝佐剂相对于其他佐剂,在快速增强抗原的免疫原性和诱使趋向Th2型抗体反应等方面更具优势[15],而且铝佐剂应用更加广泛,也是适用于人的安全佐剂。另外,先前本实验室对6Aβ15-T的研究结果也显示铝佐剂增强了抗原的免疫原性,并且产生的抗体反应趋向于Th2型[14]。因此,本研究采用铝佐剂联合重组嵌合抗原4Aβ15-TF免疫C57BL/6小鼠评价其免疫原性,证实其有效性。
在本研究中,我们探讨了4个拷贝串联的重组分子作为AD疫苗的可行性,设计了一个重组融合抗原分子4Aβ15-TF,人工合成其基因序列后用基因工程技术构建了原核表达载体pTIGTrx-4Aβ15-TF,表达且纯化到了稳定性好、纯度较高的4Aβ15-TF抗原,用其结合铝佐剂免疫小鼠后产生了较强的针对Aβ42的特异性抗体,抗体水平随免疫次数的增加而提高,4次免疫后的血清抗体滴度水平可达1∶120 000,证明此抗原有较好的免疫原性。血清抗体亚型主要是IgG1型和少量IgG2b型,证明免疫反应主要趋向于Th2型。免疫后没有产生针对Aβ42而只产生了针对TF的特异性细胞免疫反应。后续,还将对重组融合抗原4Aβ15-TF作为亚单位疫苗在AD模型鼠上进行更进一步的研究,明确其免疫预防或治疗效果,并与6Aβ15-T进行比较,为预防和治疗AD提供安全有效的候选亚单位疫苗。
[1] Selkoe D J.Alzheimer's disease:gene,proteins,and therapy[J].Physiol Rev,2003,81:741.
[2] Crews L,Rockenstein E,Masliah E.APP transgenic modeling of Alzheimer's disease:mechanisms of neuro⁃degeneration and aberrant neurogenesis[J].Brain Struct Funct,2010,214(2-3):111-126.
[3] Hardy J,Selkoe D J.The amyloid hypothesis of Al⁃zheimer's disease:progress and problems on the road⁃to therapeutics[J].Science,2002,297(5580):353-356.
[4] Godyñ J,Joñczyk J,Panek D,et al.Therapeutic strate⁃gies for Alzheimer's disease in clinical trials[J].Phar⁃macol Rep,2016,68(1):127-138.
[5] Salomone S,Caraci F,Leggio G M,et al.New phar⁃macological strategies for treatment of Alzheimer's dis⁃ease:focusondiseasemodifyingdrugs[J].BrJClin Pharmacol,2012,73:504-517.
[6] Schenk D,Barbour R,Dunn W,et al.Immunization with amyloid-beta attenuates Alzheimer-disease-likepa⁃thology in the PDAPP mouse[J].Nature,1999,400:173-177.
[7] Schenk D,Hagen M,Seubert P.Current progress in beta-amyloidimmunotherapy[J].Curr Opin Immunol, 2004,16:599-606.
[8] Panza F,Logroscino G,Imbimbo B P,et al.Is there still any hope for amyloid-based immunotherapy for Alzheimer's disease[J]?Curr Opin Psychiatry,2014,27 (2):128-137.
[9] Panza F,Solfrizzi V,Imbimbo B P,et al.Amyloidbased immunotherapy for Alzheimer's disease in the time ofpreventiontrials:the way forward[J].Expert Rev Clin Immunol,2014,10(3):405-419.
[10]Cribbs D H,Ghochikyan A,Vasilevko V,et al.Adju⁃vant-dependent modulation of Th1 and Th2 responses to immunization with beta amyloid[J].IntImmunol, 2003,15:505-514.
[11]Agadjanyan M G,PetrovskyN,Ghochikyan A.A fresh perspective from immunologists and vaccine re⁃searchers:active vaccination strategies to prevent and reverse Alzheimer's disease[J]. Alzheimers Dement, 2015,11:1246-5129.
[12]WisniewskiT,Drummond E.Developingtherapeutic vaccines againstAlzheimer's disease[J].ExpertRev Vaccines,2016,15:401-415.
[13]Meli G,Lecci A,Manca A,et al.Conformational tar⁃geting ofintracellularAbeta oligomers demonstrates their pathological oligomerization inside the endoplas⁃mic reticulum[J].Nat Commun,2014,5:3867.
[14]Yu Y Z,Liu S,Wang H C,et al.A novel Aβ B-cell epitope vaccine(rCV01)for Alzheimer's disease im⁃proved synaptic and cognitive functions in 3x Tg-AD mice[J].J Neuroimmune Pharmacol,2016,11:657-668.
[15]刘思,赵萌,许文惠,等.融合辅助性T细胞表位的重组Aβ15表位嵌合抗原免疫原性研究[J].军事医学, 2014,38(1):44-47.

