脂肪间充质干细胞条件培养基诱导结肠癌HT29细胞凋亡*
胡继军 王 梅 方 静 马春梅 沈加裙 凃 星 陈文莹 杨 超
间充质干细胞(Mesenchymal Stem Cell,MSC)是成体干细胞中的一类常见干细胞,具有多向诱导分化潜能。脂肪来源间充质干细胞(Adipose Derived Mesenchymal Stem Cells,ASC)由于脂肪组织取材方便、易于分离和体外培养、供者损伤较小、应用不涉及道德伦理问题、ASC低表达主要组织相容性复合物(MHC) I类抗原及不表达MHC II类抗原、对宿主基本无免疫原性[1]等而用于抗肿瘤研究。
肿瘤作为发病率较高的一类恶性疾病,临床主要治疗方案为手术、化疗和放疗。鉴于很多肿瘤对常规化疗和放疗不敏感,有研究通过肿瘤生长微环境角度探讨治疗新策略[2],包括调控有关细胞,如上皮细胞、成纤维细胞、MSC及各种炎性细胞水平及其病理生理作用[3],其中有关MSC调节肿瘤微环境作用的报道逐渐增多,既有其抑制肿瘤生长作用的观察结果[4],也有其促进肿瘤生长的实验报道[5]。我们通过收集培养ASC后上清液制备ASC条件培养基(ASC-Conditioned Medium,ASC-CM)再培养结肠癌HT29细胞,观察其对HT29细胞增殖和凋亡的影响,为MSC抗肿瘤作用提供部分实验依据。
1 材料与方法
1.1 材料
1.1.1实验细胞:人结肠癌HT29细胞由华中科技大学同济医学院附属协和医院肿瘤中心惠赠,人ASC由华中科技大学同济医学院附属协和医院干细胞中心惠赠。
1.1.2主要试剂:改良Eagle培养基(Dulbecco's Modified Eagle Media: Nutrient Mixture F-12, DMEM/F12) (批号:AAJ207798)、胎牛血清(FBS)(批号:GXB0081)购自美国Hyclone公司;0.25%胰蛋白酶(批号:1748050)、100×青霉素和链霉素(批号:15140-122)购自美国Gibco公司;细胞计数试剂盒(Cell Counting Kit-8,CCK-8)购自日本Dojindo公司(批号:CK-04);Annexin-V 凋亡检测试剂盒购自南京凯基生物科技发展有限公司(批号:KGA106);SYBR Green PCR 试剂盒购自德国Qiagen公司(批号:145049083);RNA提取试剂盒购自美国Omega公司(批号:R6834-01);反转录试剂盒购自美国Thermo公司(批号:K1622)。
1.1.3主要仪器:流式细胞仪(型号:FACSCalibur,美国Becton Dickinson公司);实时荧光定量PCR扩增仪(型号:ABI 7500,美国应用生物系统公司)
1.2 方法
1.2.1ASC-CM制备:取ASC置于T25细胞培养瓶中,用含10%FBS和1%青霉素和1%链霉素的DMEM/F12培养基培养至密度80%-90%,换用新鲜无血清 DMEM/F12,继续培养2天后,收集上清至15ml无菌离心管中,1 000rpm离心5min,吸取上清层至新的无菌离心管中,4℃保存。实验时37℃预温。
1.2.2人结肠癌HT29细胞培养及增殖抑制实验:置HT29细胞于10%FBS和1%青霉素和1%链霉素的DMEM/F12培养基、37℃、5%CO2及饱和湿度条件下培养,待其生长密度达到90%时,0.25%胰酶消化后,收集细胞,离心去上清,加入含10%FBS和1%青霉素和1%链霉素的DMEM/F12培养基,配制成细胞浓度5×104个/ml悬液,在96孔板中每孔接种100μl,使细胞密度为5×103个/孔,边缘孔只加入DMEM/F12培养基。培养6h,待细胞完全贴壁,弃去原培养基,分为实验组和对照组(各6个复孔),分别加入37℃预温的ASC-CM 100μl和DMEM/F12培养基100μl再培养HT29细胞,空白孔为DMEM/F12培养基,无HT29细胞。分别培养24h、48h及72h,每孔加入CCK-8试剂10μl,37℃继续培养2h,在酶标仪上检测各孔吸光度(OD值,测定波长450nm)表示其增殖率水平,并计算实验组HT29细胞增殖率[=(As-Ab)/(Ac-Ab)×100%,As:实验组各孔OD;Ac:对照组各孔OD;Ab:空白孔OD],分析其与培养时间的相关性。
1.2.3HT29细胞凋亡检测:采用流式细胞术。将HT29细胞接种于10个T25细胞培养瓶中,在含10%FBS和1%青霉素和1%链霉素的DMEM/F12培养基、37℃、5%CO2及饱和湿度条件下培养,待其生长密度达90%时,弃去原培养基,平分为实验组和对照组(n均=5),分别加入ASC-CM和DMEM/F12培养基培养48h,0.25%胰酶消化,收集细胞,PBS洗涤后离心,收集5×105个细胞于试管中,加500μl binding buffer 制成细胞悬液后,再加入Annexin V-FITC染液和PI染液,室温下避光孵育30min,上流式细胞仪于1h内检测完毕。结果判断:在流式散点图上,左下象限为Annexin V-FITC和PI双阴性的活细胞,右下象限为Annexin V-FITC阳性、PI阴性的凋亡细胞。
1.2.4细胞凋亡因子半胱天冬酶(Caspase)-3、Caspase-9、存活素(Survivin)及X连锁凋亡抑制蛋白(XIAP)mRNA表达:提取两组HT29细胞总RNA,将其反转录成cDNA,采用实时荧光定量PCR扩增cDNA,根据CT值计算mRNA的相对表达量。
(1)总RNA提取:取1.2.3中对照组及实验组培养48h的HT29细胞,按照RNA提取试剂盒说明书提取总RNA。(2)cDNA制备:RNA和Oligo(dT)混合,70℃ 5min后,冰上1min;再加入dNTP、RNA酶抑制剂、反转录酶M-MLV和5×Buffer,混匀;37℃ 1h,85℃ 10min,反转录成cDNA,-20℃保存,备用。(3)荧光定量PCR检测:HT29细胞的几种mRNA引物和内参β-actin引物均由Invitrogen公司合成。各引物序列见表1。

表1 引物序列
PCR反应体系根据试剂盒说明书配制。包括SYBR Green Master Mix、上下游引物、无RNA酶水、DNA模板。PCR反应条件:95℃ 5min,此后95℃ 10s,60℃ 30s,循环40次。
PCR结果用扩增产物的荧光信号达到设定阈值时所经过的扩增循环次数(CT值)表示,并据此计算各凋亡因子的mRNA相对表达量[6]=2-Δ(CT目的基因-CT内参基因)。
1.3 统计学处理

2 结果
2.1 ASC-CM抑制HT29细胞增殖率
结果显示,实验组HT29细胞在ASC-CM培养24h的OD值与对照组比较,差异无统计学意义(P>0.05),ASC-CM培养48h、72h的OD值水平实验组较对照组明显降低(均P<0.01);实验组HT29细胞24h增殖率为90%±8%,48h增殖率为81%±7%,72h增殖率为57%±14%,即随ASC-CM培养时间延长,实验组HT29细胞增殖率逐渐下降,两者呈显著负相关(r=-0.974,P<0.01)。见表2和图1。

表2 两组HT29细胞培养不同时间增殖水平(OD值)比较均=6)
注:与对照组相同时点比较,1)P<0.01

图1 ASC-CM培养时间与HT29细胞增殖率的相关性曲线
2.2 ASC-CM诱导HT29细胞凋亡
实验组HT29细胞凋亡率为7.84%±2.52%,对照组为3.69%±0.73%,实验组明显高于对照组(t=3.409,P<0.01),其流式检测结果散点图如图2。
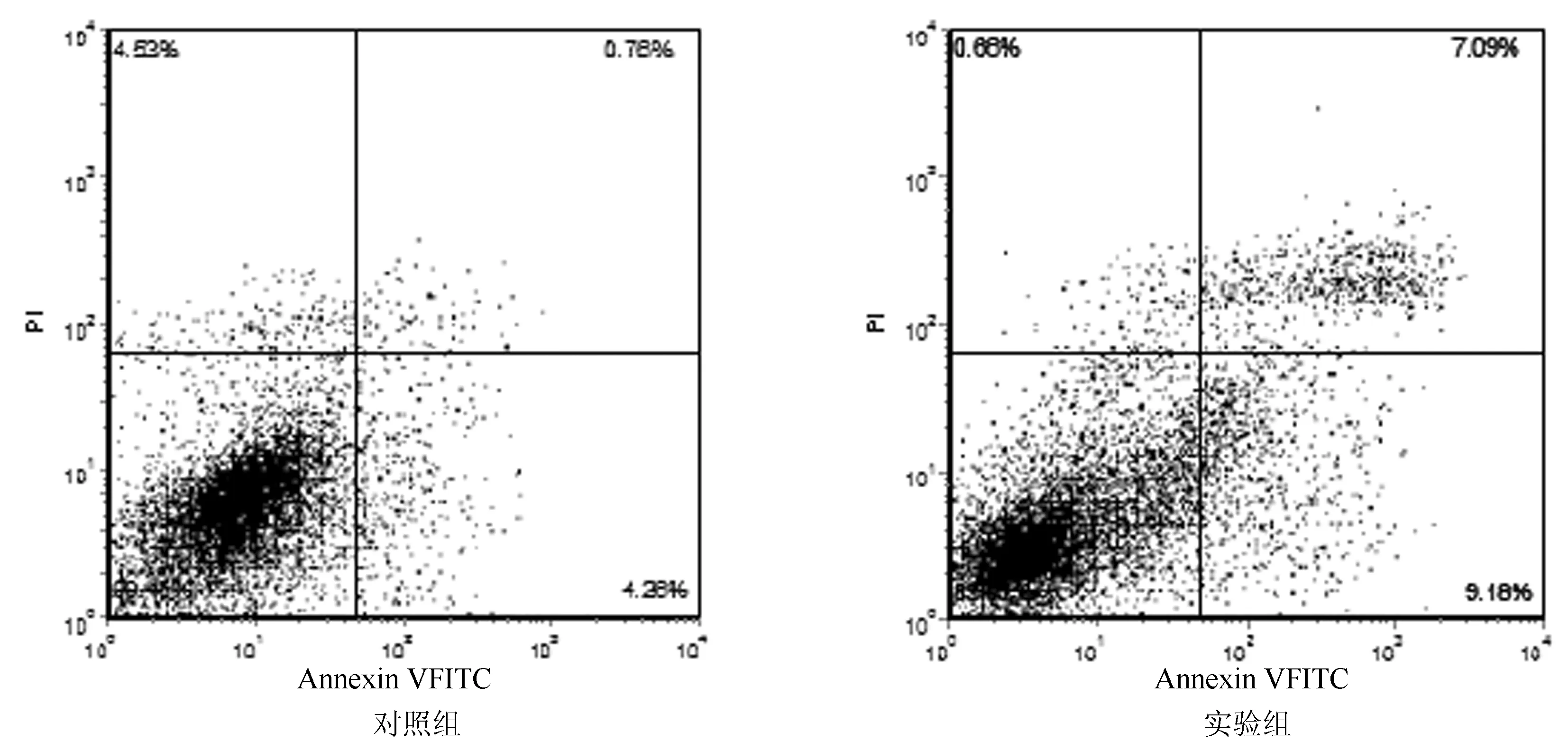
图2 ASC-CM诱导HT29细胞凋亡流式检测散点图(n均=5)
2.3 ASC-CM对HT29细胞凋亡因子mRNA表达的影响
实验组HT29细胞Caspase-3、Caspase-9 mRNA表达明显高于对照组(P<0.01),而Survivin和XIAP mRNA表达明显低于对照组(P<0.01),见表3。

表3 ASC-CM培养对HT29细胞凋亡因子mRNA表达的影响均=5)
注: 与对照组比较,1)P<0.01
3 讨论
MSC对肿瘤细胞效应的实验结果不尽相同,有研究显示,MSC能有效诱导肿瘤细胞凋亡[4],显著抑制小鼠胶质瘤细胞生长、肿瘤血管形成[7],以及由化学致癌剂3-甲基胆蒽和二乙基亚硝胺诱导产生的肺癌生长[8];但另有实验表明,MSC可促进肿瘤细胞增殖[5],诱导乳腺癌细胞转移[9],还可能增强肿瘤细胞对化疗的耐药性[10]。表明MSC对肿瘤细胞的作用可能比较复杂,MSC的类型和来源,肿瘤细胞的种类,MSC在肿瘤微环境中与肿瘤细胞的相互作用都会使实验出现不同结果,因而也增加了相关研究的难度和挑战性。
本文参考有关实验报道,并结合我们前期的研究[11],设计了针对结肠癌HT29细胞采用ASC-CM培养,观察和探讨ASC-CM抑制HT29细胞增殖的作用和诱导凋亡效应及其部分机制。结果表明,ASC-CM培养能够明显抑制结肠癌HT29细胞增殖,并随培养时间延长,增殖率逐渐降低;流式细胞术证实ASC-CM培养可明显增加HT29细胞凋亡率,而且凋亡诱导因子Caspase-3、Caspase-9 mRNA表达量显著上调,凋亡抑制因子Survivin和XIAP mRNA表达显著下调。
研究表明,XIAP可直接抑制凋亡起始因子Caspase-9 以及灭活效应因子Caspase-3[12]。Survivin可通过多条信号通道发挥抗凋亡作用[13], 而核因子κB(NF-κB)通路活化是它们抗结肠癌细胞凋亡的关键途径[14],抑制结肠癌细胞NF-κB通路活化,则有可能降低XIAP及Survivin表达,进而促进癌细胞凋亡。MSC可分泌多种细胞因子,包括白细胞介素-1受体拮抗剂(IL-Ra)来调控肿瘤微环境中各种细胞的生理活动,如MSC通过分泌的IL-Ra即可阻断NF-κB通路,达到抑制黑色素瘤A375细胞增殖的效果。从本文实验结果分析我们所用ASC-CM,可能存在IL-1等功能性细胞因子,同样能够阻断HT29细胞的NF-κB通路,从而降低XIAP和Survivin表达,增强Caspase-3和Caspase-9活性,提高HT29细胞凋亡率。而且,Visweswaran等[16]采用ASC-CM培养乳腺癌MCF-7 和 MDA-MB-231细胞,也发现癌细胞增殖下降,凋亡增加,Caspase-3表达增加,并认为ASC-CM的上述作用可能通过Wnt信号通路来抑制Survivin,上调Caspase-3表达得以实现。Yu等[17]利用ASC-CM培养膀胱癌EJ和T24细胞,也观察到癌细胞凋亡增加,Caspase-3表达升高的结果,并分析其与3-磷脂肌醇激酶/丝氨酸苏氨酸蛋白激酶(PI3K/Akt)信号通路的激活有关[15]。这些均与本研究中ASC-CM培养结肠癌HT29细胞效应和机制有较好的一致性,说明ASC对抗肿瘤生长有积极作用。
综上所述,ASC-CM体外培养人结肠癌HT29细胞可抑制其增殖,增加其凋亡。HT29凋亡机制与Caspase-3、Caspase-9 mRNA水平升高和Survivin、XIAP mRNA水平降低有关。该研究为ASC对肿瘤的细胞治疗和机制治疗提供了一定的实验依据。但由于肿瘤的表现和机制以及MSC与肿瘤的相互作用十分复杂,尚需更多更全面深入的相关研究,方能真正发挥MSC在肿瘤治疗中的重要作用。
◀
本文第一作者简介:
胡继军(1969-),男,汉族,副主任技师,主要从事免疫检验工作
1 Uccelli A, Moretta L, Pistoia V. Immunoregulatory function of mesenchymal stem cells[J]. Eur J Immunol, 2006, 36(10): 2 566-2 573.
2 Koontongkaew S. The tumor microenvironment contribution to development, growth, invasion and metastasis of head and neck squamous cell carcinomas[J]. J Cancer, 2013, 4(1): 66-83.
3 Zischek C, Niess H, Ischenko I, et al. Targeting tumor stroma using engineered mesenchymal stem cells reduces the growth of pancreatic carcinoma[J]. Ann Surg, 2009, 250(5): 747-753.
4 Clarke MR, Imhoff FM, Baird SK. Mesenchymal stem cells inhibit breast cancer cell migration and invasion through secretion of tissue inhibitor of metalloproteinase-1 and -2[J]. Mol Carcinog, 2015, 54(10): 1 214-1 219.
5 Beckermann BM, Kallifatidis G, Groth A, et al. VEGF expression by mesenchymal stem cells contributes to angiogenesis in pancreatic carcinoma[J]. Br J Cancer, 2008, 99(4): 622-631.
6 Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6):1 101-1 108.
7 Ho IA, Toh HC, Ng WH, et al. Human bone marrow-derived mesenchymal stem cells suppress human glioma growth through inhibition of angiogenesis[J]. Stem Cells, 2013, 31(1): 146-155.
8 Liu T, Zhu K, Ke C, et al. Mesenchymal stem cells inhibited development of lung cancer induced by chemical carcinogens in a rat model[J]. Am J Transl Res, 2017, 9(6): 2 891-2 900.
9 Gonzalez ME, Martin EE, Anwar T, et al. Mesenchymal stem cell-induced DDR2 mediates stromal-breast cancer interactions and metastasis growth[J]. Cell Rep, 2017, 18(5): 1 215-1 228.
10 Devarasetty M, Wang E, Soker S, et al. Mesenchymal stem cells support growth and organization of host-liver colorectal-tumor organoids and possibly resistance to chemotherapy[J]. Biofabrication, 2017, 9(2): 21 002.
11 Yang C, Lei D, Ouyang W, et al. Conditioned media from human adipose tissue-derived mesenchymal stem cells and umbilical cord-derived mesenchymal stem cells efficiently induced the apoptosis and differentiation in human glioma cell lines in vitro[J]. Biomed Res Int, 2014, 2014:109 389.
12 Savitskaya MA, Onishchenko GE. Mechanisms of apoptosis[J]. Biochemistry (Mosc), 2015, 80(11):1 393-1 405.
13 Jaiswal PK, Goel A, Mittal RD. Survivin: A molecular biomarker in cancer[J]. Indian J Med Res, 2015, 141(4):389-397.
14 Moto K, Maeda S, Hikiba Y, et al. Constitutive NF-κB activation in colorectal carcinoma plays a key role in angiogenesis, promoting tumor growth[J]. Clin Cancer Res, 2009, 15(7):2 248-2 258.
15 Zhang J, Hou L, Zhao D, et al. Inhibitory effect and mechanism of mesenchymal stem cells on melanoma cells[J]. Clin Transl Oncol, 2017, 19(11):1 358-1 374.
16 Visweswarana M, Arfusoa F, Dilley RJ, et al. The inhibitory influence of adipose tissue-derived mesenchymal stem cell environment and Wnt antagonism on breast tumour cell lines[J]. Int J Biochem Cell Biol, 2018, 95(2):63-72.
17 Yu X, Su B, Ge P, et al. Human adipose derived stem cells induced cell apoptosis and S phase arrest in bladder tumor[J]. Stem Cells Int, 2015, 2015:619 290.