冠状动脉慢血流患者危险因素分析*
卢 聪 周 敏 赵龙宝 陈 航 张 俊 刘 童
冠状动脉慢血流(Coronary Slow Flow,CSF)是指原发性冠脉内血流速度减慢的现象,但应排除相关继发性因素,如冠脉扩张、冠脉痉挛、冠脉严重狭窄、冠脉介入治疗等原因。1972年,CSF首次被正式报道[1],此后随着冠脉介入术的普及和提高,对其认识和研究不断深入。目前认为CSF是动脉粥
样硬化(AS)等的早期表现,其CSF现象检出率可高达7%[2],患者常伴有静息性胸闷、胸痛等心肌缺血症状,常以急性冠脉综合症发病,且可能会诱发致死性心律失常、猝死等[3]。但一直以来学界对CSF发生的确切机制尚未完全清楚,有研究提示可能包括内皮功能及内源性舒缩因子异常、微血管舒缩功
本文2017-08-28收到,2017-10-24修回
能障碍、炎症反应、氧化应激等均参与其中[3]。虽有较多研究探讨了CSF的危险因素,但样本量较小,不同研究之间的结论差异较大。本文回顾性分析183例CSF患者危险因素的独立价值及与CSF冠脉数量的关系,为进一步探讨其机制提供线索和依据。
1 资料与方法
1.1 研究对象和分组
收集2015-01—2016-09于本院行冠脉造影检查未见明显狭窄,但存在远端灌注延迟,符合CSF标准[4]的患者183例作为实验组(CSF组),其中164例(89.62%)患者有临床症状,包括胸痛70例,胸闷60例和其它症状34例;70例(38.25%)为左前降支(LAD)单支病变,64例(34.97%)为左旋回支(LCX)和右冠状动脉(RCA)双支病变,49例(26.78%)为LAD+LCX+RCA 3支病变。选取同期冠脉造影正常且无远端灌注延迟者124例作为正常对照组。
1.1.1CSF组纳入标准:(1)年龄为18-75岁;(2)冠脉造影显示左主干及主要分支血管(LAD、LCX和RCA)狭窄程度<10%。(3):CSF判断:使用左、右冠脉标准投射体位进行选择性冠状动脉造影,以30帧/s速度采集造影图像。分析诊断主要分支的CSF:LAD血流评价使用正头位及右头位,LCX血流评价采用正足位和右肝位,RCA血流评价采用左侧位和左头位。计数造影剂完全充满血管的第一帧至远端分支血管被造影剂完全充盈时的末帧图像帧数,根据校正的TIMI血流分级方法(Corrected TIMI Frame Count, CTFC),以至少一支冠脉帧数大于27诊断为CSF[4]。LAD远端标志为心尖部“鲸尾”样分叉,LCX远端标志为最远端分叉血管,RCA远端标志为第一后降支发出的第一个分叉。因LAD较长,故帧数需除以1.7作为校正。
1.1.2CSF组排除标准:(1) 既往有明确冠心病(冠脉造影证实)或陈旧性心肌梗死病史者;(2)既往已行冠脉支架术或冠脉搭桥术者;(3)合并其它严重心脏疾病患者,包括先天性心脏病,严重心脏瓣膜病(任何瓣膜中、重度狭窄或反流)、心肌病、心力衰竭(左室射血分数小于或等于45%)等;(4)合并其它严重疾病患者,包括恶性肿瘤、严重感染、重度贫血,肝肾功能损害(胆红素或转氨酶大于3倍上限,血肌酐(SCr)大于220μmol/L);(5)造影提示其它冠脉病变,包括心肌桥、冠状动脉瘘、冠状动脉瘤样扩张、冠状动脉变异、血栓、夹层等;(6)造影导管与冠脉开口不同轴或造影图质量不佳者。
1.2 检查指标和方法
1.2.1临床检查:于患者收住院时登记和询问性别、年龄、吸烟史(大于10支/天)、嗜酒史(大于100ml/天)和相关病史(如糖尿病、高血压病、房颤等),同时测量体重指数(BMI)、血压、心率,常规心脏彩超测量左室射血分数(LVEF)。
1.2.2实验室检查:患者住院次日清晨空腹采集肘静脉血,其中2ml常规抗凝检查血液常规指标,如血红蛋白(HGB)、红细胞压积(HCT)、白细胞计数(WBC)、血小板计数(PLT),仪器(BC-6900全自动血细胞分析仪)及配套试剂均由迈瑞公司提供;另2ml不抗凝,室温离心分离血清,检测生化指标低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、SCr、空腹血糖(FBG)、C反应蛋白(CRP),仪器(AU5800 全自动生化分析仪)及配套试剂均由贝克曼公司提供。
1.3 统计学处理

2 结果
2.1 CSF患者临床及实验室检查结果
表1显示,与正常对照组相比,CSF组男性比例、有吸烟史者比例更高(P<0.05或P<0.01),其余指标组间均无明显差异(P>0.05)。表2显示CSF组的HGB、HCT、SCr水平均明显高于正常对照组,差异有统计学意义(P<0.05,P<0.01)。其它指标两组间无明显差异(P>0.05)。

表1 两组临床指标比较
注:与正常对照组比较,1)P<0.05,2)P<0.01
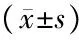
表2 两组实验室指标比较
注:与正常对照组比较,1)P<0.05,2)P<0.01
2.2 独立危险因素分析
将表1、表2中CSF组与正常对照组存在显著差异的临床和实验室指标作为自变量进行多因素二
元Logistic回归分析,结果显示,HCT 及性别为CSF的独立危险因素,其回归方程为logit(P)=-3.129+0.08(HCT%)+0.619(男性);R2=0.106,详见表3。

表3 CSF危险因素logistic回归分析结果
注:B,回归系数;S.E,标准误;Wals,卡方值;Sig,P值;Exp(B),相对危险度;95%CI,95%可信区间
2.3 有关指标与慢血流冠脉的相关性分析
随着男性数量、吸烟人数、HGB、HCT、SCr水平升高,其慢血流的冠脉支数逐渐增多(P<0.05,P
<0.01)。Spearman相关性分析结果显示,慢血流的冠脉数量与尤其男性,HGB和HCT水平与慢血流冠脉支数呈非常显著正相关(P<0.001),见表4。

表4 有关指标与慢血流冠脉数量的相关性
3 讨论
研究资料表明,CSF总的发生率约1%—7%[3],多见于男性吸烟者,患者可反复出现胸痛症状,但与X综合征不同的是,CSF患者较少出现劳力性胸痛或呼吸困难,多于静息状态下发病[5]。CSF可导致心肌缺血,诱发急性冠脉综合征或者心肌梗死,导致恶性心律失常,甚至引起猝死等[6-8]。 Sadr-Ameli 等[9]随访CSF患者5-7年的结果显示,22.2%的患者出现轻度冠脉狭窄,16.6%的患者出现显著冠脉狭窄;提示CSF可能是动脉粥样硬化和阻塞性冠心病的前期表现。 其可能原因为慢血流状态可使血管壁周围白细胞及血小板浓度升高,并粘附于血管壁后被激活,分泌炎性因子等,同时CSF可导致某些血浆成分,如LDL、胆固醇(TC)、纤维蛋白原(Fib)更容易渗透进入血管壁,从而导致动脉硬化[10]。
到目前为止,CSF的确切机制尚不完全清楚,已经报道的相关影响因素包括:(1)微血管阻力增加,如Rim等[11]发现CSF患者的冠状动脉阻力 (平均动脉压/冠状窦血流量)比对照组明显增加,冠脉血流明显减慢。(2)内皮功能障碍与内源性舒缩因子功能异常,有研究表明CSF患者的血浆内皮素1 (Endothelin-1, ET-1 )浓度升高,而NO浓度降低[12]、同型半胱氨酸也可能会影响内皮功能[13]。(3)炎症反应,CSF患者CRP、白细胞介素-6、E-选择素等炎性因子水平显著升高[14]、红细胞分布宽度、血尿酸水平等也可能增加[15]。(4)血液流变性改变,红细胞低变形能力和高聚集性被证明可降低血流速度,引起血液黏滞度及血流阻力增加和血管剪切应力降低,从而导致血流速度减慢[16],以及HCT升高与CTFC呈正相关(r=0.288 和r=0.217)[17],HCT每增加5%,CSF发生风险增加1.9 倍,(P=0.02, 95% CI 1.1-3.5)[18]。(5)血压升高和血脂异常, Sanati等[19]报道高血压、低HDL-C均为CSF影响因素。本文选择与上述影响因素不相重复的常见临床检查和实验室指标与CSF关系进行了有关分析,结果显示,与正常对照组相比,CSF组男性比例、吸烟者比例,HGB、HCT和SCr水平均显著升高,而且这些指标变化与出现慢血流的冠脉支数呈正相关;进一步多因素回归分析表明其中HCT和男性为CSF的独立危险因素, 进而验证了HCT作为CSF危险因素[17,18]的正确性,也认同了Hawkins 等[20]研究显示男性是CSF独立危险因素(OR=3.36,95%CI1.17-8.61,P=0.02)的客观存在。对于HCT影响CSF的机制,普遍认为其与上述血流变性异常有关;而男性对CSF的影响可能提示雄性激素参与CSF的病理生理过程。本文结果中,传统冠心病危险因素,如LDL-C、CRP、高血压、糖尿病等,与CSF的关系不显著,关于具有组间统计学差异的检测指标与CSF冠脉支数的相关性,分析结果表明,随着CSF冠脉支数的增多,男性、吸烟者比例、HGB、HCT和SCr水平呈升高趋势,尤其0—2支组升高明显,但3支组水平较2支组略有下降,原因可能是3支组中男性比例有所降低,导致其它指标的总水平下调。
本文回顾性分析纳入病例相对较少,可能存在选择性偏倚;选择指标并不全面,也没有其它研究较少涉及的新指标如临床药物对CSF的作用等,但本文结果客观验证了男性、吸烟、常伴有胸闷胸痛症状、较高HGB、HCT和SCr水平者是CSF危险人群,尤其较高HCT水平和男性是CSF发生的独立危险因素,从而有利于确定CSF危险因素,并形成统一认识和结论,也有助于临床防治CSF。
◀
本文第一作者简介:
卢聪(1985-),男,汉族,硕士,主治医师,主要从事冠心病基础与临床研究
1 Tambe AA, Demany MA, Zimmerman HA, et al. Angina pectoris and slow flow velocity of dye in coronary arteries-a new angiographic finding[J] .Am Heart J, 1972,84(1):66-71.
2 Fineschi M, Gori T. Coronary slow flow: description of a new "cardiac Y" syndrome[J] . Int J Cardiol, 2009,137(3):308-310.
3 Wang X, Nie SP. The coronary slow flow phenomenon: characteristics, mechanisms and implications [J] .Cardiovasc Diagn Ther, 2011,1(1):37-43.
4 Gibson CM Cannon CP, Daley WL, et al. TIMI frame count: a quantitative method of assessing coronary artery flow [J].Circulation, 1996,93(5):879-888.
5 Arbel Y, Rind E, Banai S, et al. Prevalence and predictors of slow flow in angiographically normal coronary arteries [J]. Clin Hemorheol Microcirc, 2012,52(1):5-14.
6 Cutri N, Zeitz C, Kucia AM, et al. ST/T wave changes during acute coronary syndrome presentation in patients with the coronary slow flow phenomenon[J]. Int J Cardiol, 2011,146(3):457-458.
7 Horjeti B, Goda A. Acute ischemia manifestation in a patient with coronary slow flow phenomenon[J]. J Electrocardiol, 2012,45(3):277-279.
8 Saya S, Hennebry TA, Lozano P, et al. Coronary slow flow phenomenon and risk for sudden cardiac death due to ventricular arrhythmias: a case report and review of literature[J].Clin Cardiol, 2008,31(8):352-355.
9 Sadr-Ameli MA, Saedi S, Saedi T, et al. Coronary slow flow: Benign or ominous? [J]. Anatol J Cardiol, 2015,15(7):531-535.
10 Marossy A, Svorc P, Kron I, et al. Hemorheology and circulation[J]. Clin Hemorheol Microcirc, 2009,42(4):239-258.
11 Rim SJ, Leong-Poi H, Lindner JR, et al. Decrease in coronary blood flow reserve during hyperlipidemia is secondary to an increase in blood viscosity[J] . Circulation, 2001,104(22):2 704-2 709.
12 Chen Z, Chen X, Li S, Huo X, et al. Nicorandil improves myocardial function by regulating plasma nitric oxide and endothelin-1 incoronary slow flow[J]. Coron Artery Dis,2015,26(2):114-120.
13 Yucel H, Ozaydin M, Dogan A, et al, Plasma concentrations of asymmetric dimethylarginine, nitric oxide and homocysteine in patients with slow coronary flow[J]. Scand Jclin Lab Invest 2012,72(6):495-500.
14 Li JJ, Qin XW, Li ZC, et al. Increased plasma C-reactive protein and interleukin-6 concentrations in patients with slow coronary flow.[J] Clin Chim Acta, 2007,385(1-2):43-47.
15 Kalay N, Aytekin M, Kaya MG, et al. The relationship between inflammation and slow coronary flow: increased red cell distribution width and serum uric acid levels[J]. Turk Kardiyol Dern Ars, 2011,39(6):463-468.
16 Ergun-Cagli K, Ileri-Gurel E, Ozeke O, et al. Blood viscosity changes in slow coronary flow patients [J]. Clin Hemorheol Microcirc, 2011,47(1):27-35.
17 Soylu K, Gulel O, Yucel H, et al. The effect of blood cell count on coronary flow in patients with coronary slow flow phenomenon [J]. Pak J Med Sci, 2014,30(5):936-341.
18 Arbel Y, Rind E, Banai S, et al. Prevalence and predictors of slow flow in angiographically normal coronary arteries. [J] Clin Hemorheol Microcirc, 2012,52(1):5-14.
19 Sanati H, Kiani R, Shakerian F, et al. Coronary slow flow phenomenon clinical findings and predictors[J] . Res Cardiovasc Med, 2016,5(1):e30 296.
20 Hawkins BM, Stavrakis S, Rousan TA, et al. Coronary slow flow-prevalence and clinical correlations[J]. Circ J, 2012,76(4):936-942.
·医学前沿·
运动可降低肺癌手术后并发症风险
澳大利亚研究人员最新发现,在肺癌手术前进行常规锻炼可以将术后出现并发症的风险降低近一半,同时还可以减少住院时间。
外科手术是肺癌的主要治疗方法,但术后可能出现胸腔感染、呼吸衰竭、胸内出血等并发症,严重时可危及生命。澳大利亚悉尼大学等机构研究人员在新一期《英国运动医学杂志》上发表的论文说,术前锻炼可有效降低肺癌手术后并发症的发生率。
研究人员对数据库中13项相关临床试验结果进行了分析。参与试验的对象为806位分别患有肠癌、肝癌、食道癌、肺癌、口腔癌及前列腺癌的患者。试验对象在手术前进行了2周左右的体育锻炼,锻炼项目多为散步、抗阻力训练等,频率为每周3次或每天3次不等。分析显示,运动对肺癌患者的影响最为明显。与不运动的患者相比,参加锻炼的患者出现并发症的风险降低48%,住院时间也缩短了近3天。研究人员表示,由于相关试验数据较少,术前锻炼对其它癌症患者的影响尚不明确。但曾有研究显示,运动可以改善口腔癌和前列腺癌患者的术后生活质量。
(来源:科学网)