HPV阳性与阴性宫颈病变患者外周血中Foxp3 mRNA及RORγt mRNA的表达*
张 伟 蔡小凤 汪宏良 朱杰稳 肖 苏 黄 炜 胡 芳 尚小玲
宫颈癌(Cervical Cancer,CC)是全球女性发病率居第二位的恶性肿瘤[1]。很多研究[2,3]表明,90%以上宫颈癌与HPV感染有关。HPV的持续感染能否引起宫颈病变的发生发展与感染者自身的免疫状态、激素分泌水平等因素有关,其中宿主的免疫状态在HPV介导的致癌作用中发挥关键作用[4]。调节性T细胞(Treg)与辅助性T细胞17(T helper cell 17, Th17)在机体免疫调节和免疫耐受中发挥重要作用[5],同时,Treg介导的肿瘤细胞逃逸机制及Th17细胞的失衡可能是宫颈病变发生发展的重要原因,而叉头状转录因子(Foxp3)和视黄酸相关孤儿受体γt(RORγt)分别是它们高表达的特异性转录因子[6],推测这两种转录因子在宫颈病变中起着重要作用。
1 资料与方法
1.1 对象与分组
2016-01—2017-06来鄂东医疗集团市中心医院门诊及住院的宫颈病变患者373例,采用聚合酶链式反应(PCR)和基因芯片检测技术对送检者宫颈脱落细胞标本进行HPV基因分型检测,筛选出HPV阳性者158例,HPV阴性者215例,再依据不同疾病分为若干亚组。宫颈炎、宫颈上皮内瘤变分级(CIN)、宫颈癌的诊断根据妇产科学第七版诊断标准[7]。随机选取在黄石市中心医院同期健康体检女性39例为正常对照组,无HPV感染、无自身免疫性疾病及其它恶性肿瘤,肝肾功能、血尿常规及白带分泌物检查均正常。疾病各组与正常对照组年龄差异无统计学意义(P>0.05),见表1。
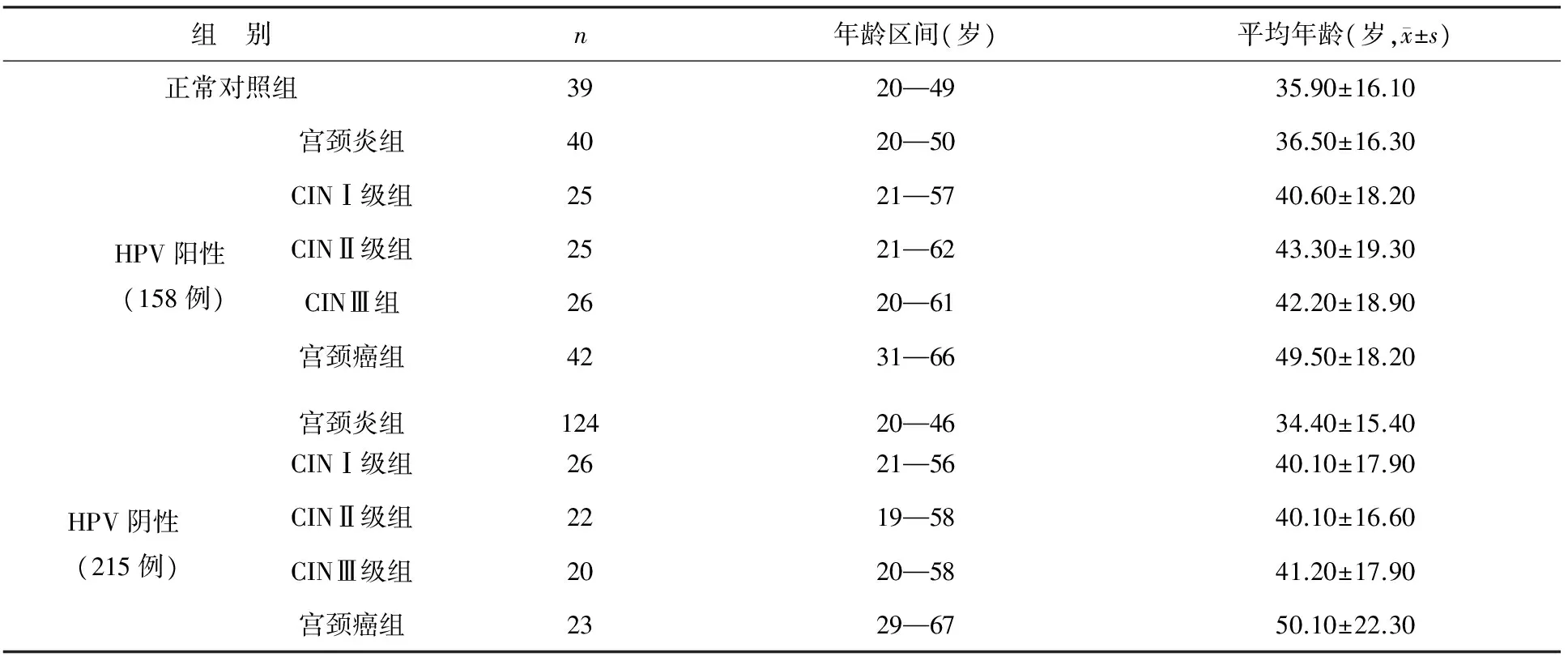
表1 各组一般资料比较
1.2 仪器与试剂
基因扩增检测系统(ABI 7500型),美国应用生物系统公司;分子杂交仪(LF-Ⅲ型),上海比朗仪器制造有限公司;HPV基因分型试剂盒(批号:16A001),广东凯普生物;总RNA提取试剂盒(批号;2016001),武汉百翌博科技有限公司提供;RNA纯化试剂盒(批号:20160102):武汉百翌博科技有限公司提供;cDNA合成试剂盒(批号:2016100010),武汉百翌博科技有限公司提供;热启动荧光定量PCR核心试剂盒(批号:001-25-2016),武汉百翌博科技有限公司提供;Foxp3基因、RORγt基因和内参基因β肌动蛋白(β-actin)引物:宝生物工程(大连)有限公司合成(表2)。
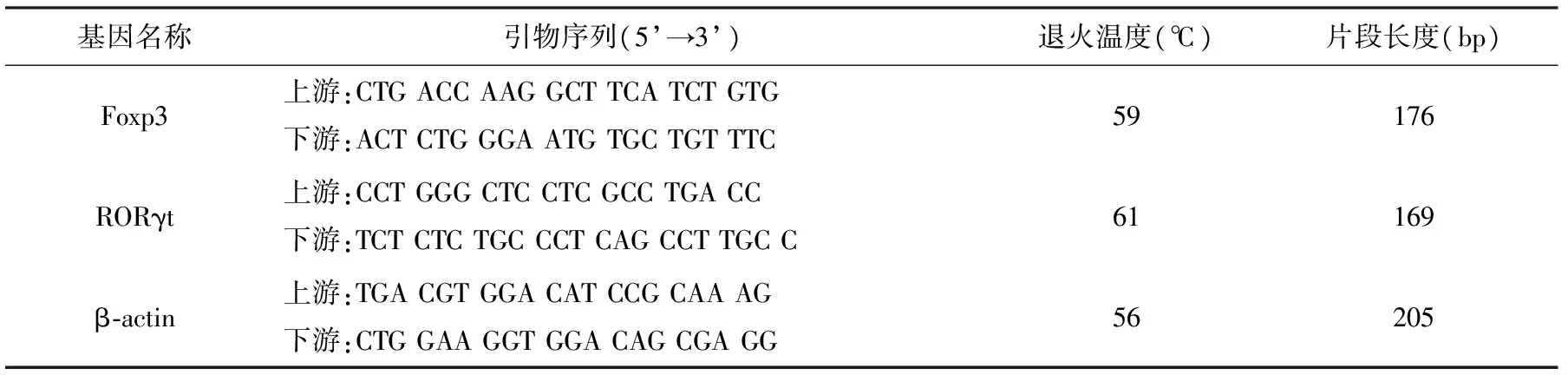
表2 检测基因与对应的引物序列
1.3 方法
1.3.1HPV分型检测:由妇科医生利用HPV专用采样刷采取标本后置于有标记的专用细胞保存液中。离心去上清加树脂颗粒提取液200μl充分混匀,100℃煮沸15min,高速离心5min,取上清液5μl 加入含通用引物的PCR混合液中,总体系 25μl。扩增条件:50℃ 15min; 95℃ 10min ;94℃ 30s,42℃90s, 72℃30s, 35个循环后72℃延伸 5min。将标记好的基因芯片膜条及扩增的PCR产物加入6ml A 液(2×SSC,0.1%十二烷基磺酸钠(SDS , pH7.4)沸水浴10min, 使 DNA变性,用于基因芯片检测,操作按试剂盒说明书进行。通过显色判断HPV阳性或阴性。
1.3.2Foxp3 mRNA和RORγt mRNA检测:(1)人外周血单个核细胞(PBMC)的分离:无菌条件下采集受试对象肘静脉血3ml于EDTA-K2抗凝管中,6h内用Ficoll-Hypaque密度梯度离心法获取PBMC,—80℃冰箱保存备用。(2)PBMC总RNA提取及浓度、纯度测定:取冻存PBMC室温下自然解冻,4℃ 8 000r/min 离心 2min,弃上清液,加入1ml RNAisoTMPlus,充分振荡混匀后,严格按照说明书操作步骤进行。取RNA 溶解液置于紫外分光光度仪中进行RNA浓度测定,读取260nm与280nm的A值,利用A260/A280的比值(R)估计核酸的纯度,R值范围控制在1.8—2.0。(3)逆转录合成cDNA:按照试剂盒说明书分两步进行,首先除去基因组DNA,依次加入gDNA Eraser Buffer 2μl、gDNA Eraser 1μl、RNA 1μg,用RNase Free dH2O调整成10μl反应液,42℃静置2min后进行逆转录。逆转录反应体系20μl:PrimeScript Buffer 4μl,PrimeScript RT Enzyme MixⅠ1μl,RT Prime Mix 1μl,第一步制成的 10μl反应液,RNase Free dH2O 4μl。采用ABI7500型基因扩增仪进行逆转录,反应条件:37℃ 15min, 85℃ 5s。将合成的cDNA 置于-20℃保存。(4)实时荧光定量PCR:实验步骤参照 SYBR green荧光定量 PCR 试剂盒说明书进行。整个反应液的配置在冰上进行。 反应体系25μl∶SYBR Premix Ex TaqTM12.5μl(使用过程中注意避光),上游引物0.5μl,下游引物0.5μl (终浓度达 到0.2μmol/L),DNA模板2μl (cDNA溶液),ddH2O(灭菌蒸馏水)9.5μl。反应条件如下:预变性95℃ 30s。两步法PCR反应:变性 95℃ 5s,退火/延伸 60℃ 30s,35 个循环。(5)计算检测指标的相对表达量:得到每个PCR反应管不同指标的Ct值后,根据公式2-△△Ct计算出所测指标的相对表达量。
1.4 统计学处理
2 结果
2.1 不同宫颈病变HPV感染状况
不同宫颈病变的HPV感染率差异有统计学意义(P<0.05);且有随着宫颈病变程度的逐渐加重,HPV感染率呈逐渐增高的趋势(r=0.712,P均<0.05),见表3。

表3 不同宫颈病变中HPV感染率(n,%)
2.2 HPV阳性和阴性患者FOXP3 mRNA和RORγt mRNA表达状况
2.2.1各组FOXP3 mRNA表达比较:HPV阴性的各组宫颈病变患者Foxp3 mRNA表达差异无统计学意义(P>0.05)。HPV阳性的各组宫颈病变患者Foxp3 mRNA表达差异有统计学意义(P<0.05);宫颈炎组与CINI级组Foxp3 mRNA相对表达水平差异无统计学意义(P>0.05);其余各组呈CINI级组 表4 各组FOXP3 mRNA表达比较 注:与CINⅠ级组比较,1)P<0.05;与CINⅡ级组比较,2)P<0.05;与CINⅢ级组比较,3)P<0.05 2.2.2各组RORγt mRNA表达比较:HPV阴性的各组宫颈病变患者RORγt mRNA表达差异无统计学意义(P>0.05)HPV阳性的各组宫颈病变患者RORγt mRNA表达差异有统计学意义(P<0.05);宫颈炎组与CINI级组RORγt mRNA相对表达水平差异无统计学意义(P>0.05);其余各组呈CINI级组>CINⅡ级组>CINⅢ级组>宫颈癌组,差异有统计学意义(P均<0.05)。见表5。 表5 各组RORγt mRNA表达比较 注:与CIN I级组比较,1)P<0.05;与CIN Ⅱ级组比较,2)P<0.05;与CIN Ⅲ级组比较,3)P<0.05 相关性分析结果显示,HPV阴性的各组宫颈病变患者Foxp3 mRNA、RORγt mRNA相对表达水平与宫颈病变严重程度无明显相关性(r=0.131、-0.068,P均>0.05)。HPV阳性各组宫颈病变患者中,Foxp3 mRNA的相对表达水平与宫颈病变严重程度呈显著正相关(r=0.697,P<0.05);RORγtmRNA的相对表达水平与宫颈病变严重程度呈显著负相关(r=-0.657,P<0.05)。 HPV是引起宫颈病变的主要原因,尤其是CIN和宫颈癌[8]。HPV持续感染可导致基因的不稳定表达,使细胞增殖加强,凋亡衰减,从而促进局部瘤变新生血管的生成,进而侵犯组织基底膜,是引诱宫颈癌变的关键[9]。 本实验研究了373例受试者,其中HPV阳性者158例,感染率为42.35%(158/373)。随着宫颈病变程度的逐渐加重,HPV阳性感染率亦逐渐增高(P<0.05)。反映出HPV感染与宫颈病变的进展有关。因此,应当重视HPV的筛查工作,发现阳性患者,并及时给以正确的干预,可有效的减轻宫颈病变的进一步发展。 目前国内外研究表明,HPV感染以及宫颈病变发生发展均与人体的免疫功能密切相关,特别是与T淋巴细胞的关系最为密切[10]。正常人外周血和脾脏组织的CD4+T细胞中约有5%—10%的细胞高表达CD25分子,称之为CD4+CD25+调节性T细胞(Treg)[11]。Treg细胞是CD4+T淋巴细胞的一个亚群,对维持机体免疫的稳定性起着重要的调节作用[12]。特异性高表达转录因子Foxp3[13];Foxp3在B细胞和CD8+γT细胞中无明显表达,在天然CD4+CD25-细胞和非成熟的胸腺细胞中亦不表达,而仅在胸腺和外周血的CD4+CD25+T细胞中表达,可作为 Treg 细胞的一个特异标志[14]。 近年来研究[15]认为,Treg细胞是形成免疫耐受的关键成分,是重要的免疫抑制细胞。在免疫耐受的形成与维持过程中,Th17细胞也起着十分重要的作用,主要参与机体的免疫炎症性反应调节。RORγt是Th17细胞特异性转录因子,在分化成熟的Th17细胞中高表达,对Thl7细胞的分化起关键作用,是控制Thl7细胞分化的特异性转录因子[16]。在正常的生理情况下,Treg 细胞与Th17细胞的功能表现为抑制炎症和促进炎症,互为抑制,共同调节机体的免疫平衡,维持免疫稳态。但是,当Treg细胞减少或Th17细胞增多时,其介导的炎症反应则会加强,发挥免疫负性调节的Treg细胞不足以抑制炎症反应时,免疫稳态就会被破坏,导致疾病的发生。 Foxp3和RORγt作为两个细胞亚型的特异转录因子,两者的表达情况也日益受到关注。本研究发现,随着宫颈病变程度的加重, Foxp3 mRNA的相对表达量逐渐升高,而RORγt mRNA的相对表达量呈降低趋势。一方面证实了Foxp3和RORγt参与了宫颈病变免疫的调节;同时,二者在病变发展的免疫调节中相对表达量呈负相关,Foxp3 mRNA的相对表达量升高、RORγt mRNA的相对表达量降低则会导致病变的发生,增加病变恶变的发生几率。另一方面也证实了HPV感染的宫颈病变在疾病的恶变过程中机体细胞免疫平衡存在着从Th17向Treg方向的偏移,表明Th细胞亚群之间的失衡与宫颈病变的发展存在关联。 综上所述,Foxp3和RORγt在宫颈病变发展进程中起着重要作用。通过检测外周血Foxp3 mRNA和RORγt mRNA的相对表达水平可以推测机体在疾病变化中的免疫状态,从而预测病变的变化动向,为患者预后评估及临床治疗开辟了新思路。 ◀ 本文第一作者简介: 张伟(1986-),男,汉族,主管技师,主要从事临床免疫学检验与教学 1 秦美婷,张 双,范懿隽.健康视角下国内外近25年宫颈癌筛查之研究和分析[J].中华疾病控制杂志,2016,20(10):1 043—1 046. 2 张 倩,胡尚英,冯瑞梅,等.高危型人乳头瘤病毒感染变化与宫颈癌及癌前病变发病风险的15年前瞻队列随访研究[J].中华肿瘤杂志,2016,38(10):792—797. 3 Asih T S, Lenhart S, Wise S, et al. The dynamics of HPV infection and cervical cancer cells[J]. Bulletin of Mathematical Biology, 2016, 78(1):1—17. 4 Song D, Li H, Li H, et al. Effect of human papillomavirus infection on the immune system and its role in the course of cervical cancer[J]. Oncol Lett, 2015, 10(2): 600—602. 5 尤亚红, YouYahong. 调节性T淋巴细胞/辅助性T淋巴细胞17失衡在自身免疫性疾病中的研究进展[J]. 国际输血及血液学杂志, 2015, 38(6):541—545. 6 Etesam Z, Nemati M, Ebrahimizadeh M A, et al. Altered expression of specific transcription factors of Th17 (RORrt, RORa) and treg lymphocytes (FOXP3) by peripheral blood mononuclear cells from patients with multiple sclerosis[J]. Journal of Molecular Neuroscience, 2016, 60(1):1—8. 7 乐 杰.妇产科学[M].北京:人民卫生出版社,2008:257—269. 8 揭伟霞, 薛武进, 史志华,等. 宫颈上皮内瘤变与宫颈癌患者人乳头状瘤病毒感染的临床分析[J]. 中华医院感染学杂志, 2016, 26(6):1 380—1 381. 9 Day PM, Schiller JT. The role of furin in papillomavirus infection[J]. Future Microbiology, 2015, 4(10):1 255—1 256. 10 谭秋梅. HPV感染、阴道局部T淋巴细胞亚群与宫颈病变的关系研究[J]. 湖北医药学院学报, 2016(6):557—560. 11 Schmidt A, Zhang XM, Joshi RN, et al. Human macrophages induce CD4(+)Foxp3(+) regulatory T cells via binding and re-release of TGF-β[J]. Immunology & Cell Biology, 2016, 94(8):747—748. 12 张剑英,刘 班,张毅敏,等.宫颈癌患者外周血中调节性 T 细胞的变化及其临床意义[J].中华微生物学和免疫学杂志,2015,35(10):753—758. 13 Luo X, Tsun A, Yang J, et al. FOXP3+, treg cells and systems biology approaches to studying their function[M].Single Cell Sequencing and Systems Immunology. Springer Netherlands, 2015:73—93. 14 Bhairavabhotla R, Kim Y C, Glass D D, et al. Transcriptome profiling of human Foxp3+regulatory T cells[J]. Human Immunology, 2016, 77(2):201—202. 15 Park BV, Pan F. The role of nuclear receptors in regulation of Th17/Treg biology and its implications for diseases[J]. Cell Mol Immunol, 2015, 12(5): 533—542. 16 Ding Q, Zhao M, Bai C, et al. Inhibition of RORrt activity and Th17 differentiation by a set of novel compounds[J]. BMC Immunology, 2015, 16(1):1—9.
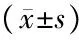
2.3 Foxp3 mRNA、RORγt mRNA相对表达水平与宫颈病变严重程度的相关性
3 讨论