异叶青兰总黄酮对血管紧张素Ⅱ诱导的大鼠心肌细胞肥大的抑制作用
蒋 红, 何 雯, 张 晨
(1新疆医科大学; 2新疆医科大学第五附属医院, 乌鲁木齐 830011)
心肌肥大(cardiac hypertrophy)是心脏应对长期压力超负荷缓慢产生的一种代偿机制,常伴随蛋白质合成增加、心脏结构重构和细胞器的功能障碍,主要表现为心肌细胞体积增大、胶原纤维形成的肌节增加及胚胎基因的再表达,是先天性心脏病、高血压、心肌梗死、心力衰竭等多种心血管疾病共有的病理过程[1]。导致心肌肥厚的因素除机械性因素(各种原因导致的压力或容量超负荷)外,神经体液性因素[去甲肾上腺素(NE)、血管紧张素Ⅱ(Ang-Ⅱ)、甲状腺素、加压素、内皮素以及多种生长因子等]也在心肌肥厚的进展中起着重要作用[2]。其中,肾素-血管紧张素系统(RAS)在心脏重构发生中起重要作用,而 Ang Ⅱ 是 RAS 中最主要的生物活性物质,可促进心肌肥厚的发生和发展,是心肌肥厚的重要启动因子。异叶青兰总黄酮(Dracocephalum Heterophyllum Benth Flavonoid, DHBF)是民间传统用药,有研究表明[3],其可治疗高血压、肺热咳嗽、支气管炎等,具有良好的抗氧化活性,且本课题前期研究发现[4],DHBF可降低肾血管性高血压大鼠血压,可改善左室收缩舒张功能和心肌收缩力,其作用机制尚不明确。鉴于此,本研究拟进一步观察DHBF对Ang Ⅱ诱导的大鼠心肌细胞肥大的影响,从离体水平上探讨 DHBF 对心肌细胞肥厚的抑制作用,为进一步探讨其作用机制提供依据。
1 材料与方法
1.1实验动物0~3 d的SD新生乳鼠,由新疆医科大学实验动物中心提供。许可证号: SCXK(新)2003-0001。饲养于新疆医科大学SPF环境,许可证号:SCXK(新)2011-0004。
1.2药品、试剂与主要设备异叶青兰黄酮(中国科学院新疆理化技术研究所提供);缬沙坦(中美上海施贵宝);血管紧张素Ⅱ(阿拉丁,中国);双抗、谷氨酰胺、D-Hanks溶液、胰蛋白酶、5-溴脱氧尿嘧啶核苷(Brd U)和CCK8细胞试剂盒(Sigma公司,美国),Ⅱ型胶原酶购置于(Worthington公司,美国);DMEM培养基,胎牛血清(Gibco公司,美国);抗心肌肌钙蛋白T抗体、Dy Light594标记驴抗鼠Ig G二抗(abcam公司,英国);逆转录酶试剂盒(Thermo);驴血清(索莱宝,北京);定量PCR试剂盒(ABI);LSM 710共聚焦显微镜(LEICA公司,德国);逆转录仪(Bio-RAD);定量PCR仪(ABI 7500)。
1.3方法
1.3.1 心肌细胞培养[5]无菌开胸,迅速取出心脏,置于盛有4℃的D-Hanks 溶液培养皿中,清除残留血液,减去整个心脏的1/3~1/2,留心尖部心室组织后,分别沿横、纵两个方向剪开,使心尖部相连,呈花瓣状。加入 0.1% 的胰蛋白酶溶液,置于摇床上,4℃震荡过夜。第2天加入和胰蛋白酶等量的培养液,置37℃水浴箱震荡10 min后终止消化。加入浓度为0.08% Ⅱ 型胶原酶置37℃水浴箱震荡消化4~5次,每次10 min。消化完毕后,细胞用200目的尼龙筛网除去残留的组织块,用DMEM培养液制成单细胞悬液,吹打均匀,接种于100 mm培养皿中,置于5% CO2, 37℃培养箱中静置90 min 差数贴壁后,取上清液,并加入0.1 mmol/L Brdu抑制非心肌细胞增殖,细胞分别以 3×105个/mL接种于96孔板、 1×106个/mL接种于6孔板和 1.5×106个/mL接种于60 mm培养皿中,送入5% CO2孵箱中培养。
1.3.2 实验分组 A组: 对照组;B组: AngⅡ(1 μmol/L);C组: Ang Ⅱ+ 缬沙坦(50 μmol/L); D组:AngⅡ+DHBF(10 μmol/L)组 ;E组:AngⅡ+DHBF(25 μmol/L)组;F组: AngⅡ+DHBF (50 μmol/L)。
1.3.3 细胞肥大模型的建立及给药 将上述细胞用含10% 小牛血清的 DMEM 培养液培养48 h后,换无血清培养液,用Ang Ⅱ(1 μmol/L)作用72 h 即可诱导心肌细胞肥大[6]。用不同浓度的 DEBF (10、25、50 μmol/L)和缬沙坦(50 μmol/L)作用细胞30 min 后,加入AngⅡ(1 μmol/L),作用72 h 后进行各项指标的测定。将未给予任何处理的细胞作为正常对照组。
1.3.4 细胞生存率检测 细胞生存率用 CCK-8 法进行测定。将接种在96 孔板的各组原代心肌细胞用含10% 小牛血清的 DMEM 培养液培养48 h后,换无血清培养液,加药72 h 后,对照组加入0.5% DMSO作为溶媒对照,其他各组用PBS洗3遍,加入10 μL CCK-8检测液孵育2 h,于430 nm 波长处检测吸光度值(A值)。检测过程中设立不加细胞的调零孔。实验每组设 5 个复孔,重复3次,取平均值。细胞生存率(%)=(待测组A值-调零组A值)/(对照组A值-调零组A值)×100%。
1.3.5 RT-PCR法检测心肌细胞心钠肽(ANP)、脑利钠肽(BNP)及β-MHC的mRNA 表达水平 将接种在60 mm培养皿中的各组原代心肌细胞用含10% 小牛血清的DMEM培养液培养48 h后,换无血清培养液,加药72 h 后,加入 TRIzol试剂1 mL裂解细胞,收集细胞裂解液,氯仿抽提,异丙醇沉淀,用DEPC处理水回收总RNA,紫外分光光度计A260/A280鉴定其浓度及纯度,并反转录成cDNA。反应条件:95℃ 30 s,95℃ 5 s,62℃ 20 s,40个循环。取1 μg cDNA 进行RT-PCR 检测,将甘油醛-3-磷酸脱氢酶(GAPDH)作为内参因子,以2-ΔΔCt法计算目标基因的相对表达水平。 本文所用PCR 引物由上海生工有限责任公司提供,序列见表1。
1.3.6 激光共聚焦进行心肌细胞的鉴定及心肌细胞表面积的检测 取出接种在6孔板用药处理过的各组心肌细胞,弃培养基,用PBS 清洗细胞3次,用4%多聚甲醛固定15 min,再用0.25%Triton X-100透化10 min,驴血清室温封闭30 min,加入抗心肌肌钙蛋白T抗体室温孵育1 h。加入荧光二抗,避光室温孵育1 h。避光加入1 g/mL的DAPI 3 min。心肌细胞图像通过LSM 710 的激光共聚焦仪获取。每次独立实验中,每组各取3孔细胞进行处理,重复3次实验。每孔细胞样品随机获取3个不同视野的图片,每个图片取10个细胞,并通过Image-Pro Plus 6.0软件测量3次实验的细胞表面积,并计算其相对平均表面积。

2 结果
2.1DHBF对细胞生存率的影响使用CCK-8检测各组细胞生存率显示,原代心肌细胞使用不同剂量的DHBF(10、25和50 μmol/L)和AngⅡ (1 μmol/L)处理72 h后,与A组(0 μmol/L DHBF)比较,使用AngⅡ (1 μmol/L) 处理的细胞生存率明显下降(P<0.05);但与B组比较,使用DHBF处理的细胞生存率明显升高,并且具有浓度依赖性,其中以F组处理的细胞活性最为显著(P<0.05)。结果表明DHBF可使 AngⅡ诱导的心肌细胞的生存率提高,结果见图1。

注: 与A组比较, *P<0.05; 与B组比较, #P<0.05。
2.2DHBF对心肌细胞c-jun、ANP和BNP的mRNA表达的影响RT-PCR 检测分析显示:原代心肌细胞使用 AngⅡ (1 μmol/L) 处理72 h后,和对照组相比,心肌肥大标志物c-jun、ANP和BNP 的 m RNA表达均上调,分别增加了(1.78±0.19)、(1.59±0.42)和(1.97±0.39)倍(n=6,P<0.05);但用不同剂量 DHBF (10、25和50 μmol/L)与AngⅡ共同作用72后,与AngⅡ (1 μmol/L) 组比较,心肌肥大标志物c-jun、ANP和BNP的mRNA表达均下调,且具有浓度依赖性,其中以F组DHBF 处理的细胞的抑制作用最为明显(P<0.05)。结果表明 DHBF可阻断由 Ang Ⅱ诱导的心肌细胞ANP、BNP和β-MHC mRNA 的表达增高,见图 2 。

a: c-jun的mRNA相对表达

b: ANP的mRNA相对表达

c: BNP的mRNA相对表达
注:与A组比较,*P<0.05; 与B组比较,#P<0.05。
图2不同浓度的DHBF对AngII诱导心肌细胞肥大基因c-jun、ANP和BNP的mRNA表达的影响
2.3DHBF对AngⅡ诱导的肥大心肌细胞表面积的影响使用Image-Pro Plus 6.0软件计算各组心肌细胞横截面积显示,与A组相比,AngⅡ组心肌细胞表面积明显增大(P<0.05);与 B组比较,缬沙坦+AngⅡ组及不同剂量DHBF(10、25和50 μmol/L)+ AngⅡ组的心肌细胞表面积明显缩小(P<0.05),其中以F组DHBF作用最为明显(P<0.05),结果表明DHBF可减小由AngⅡ诱导的心肌细胞表面积,见表2和图3。

表2 不同浓度的DHBF对AngⅡ诱导心肌细胞肥大的细胞表面积的影响
注:与A组比较,*P<0.05; 与B组比较,#P<0.05。

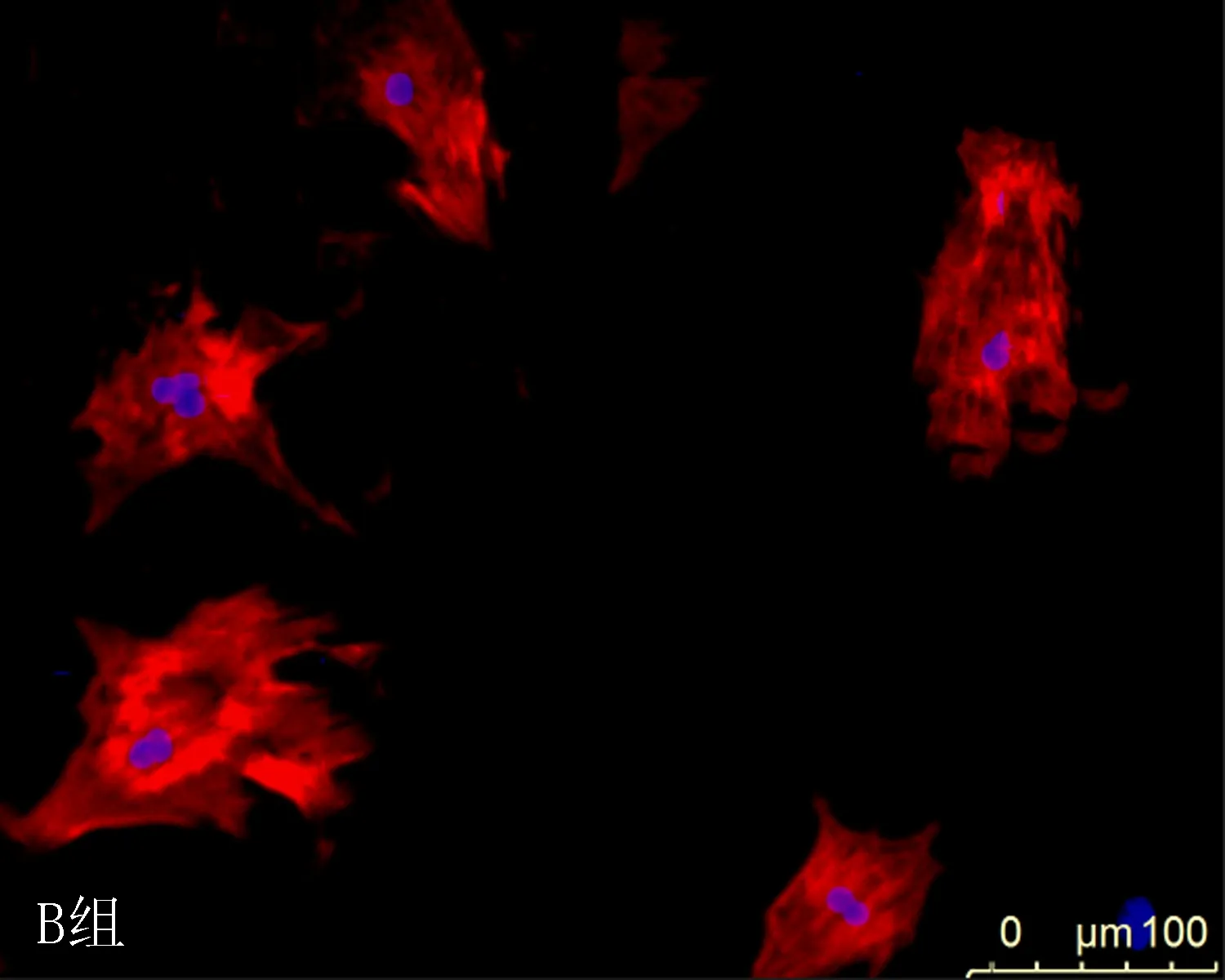
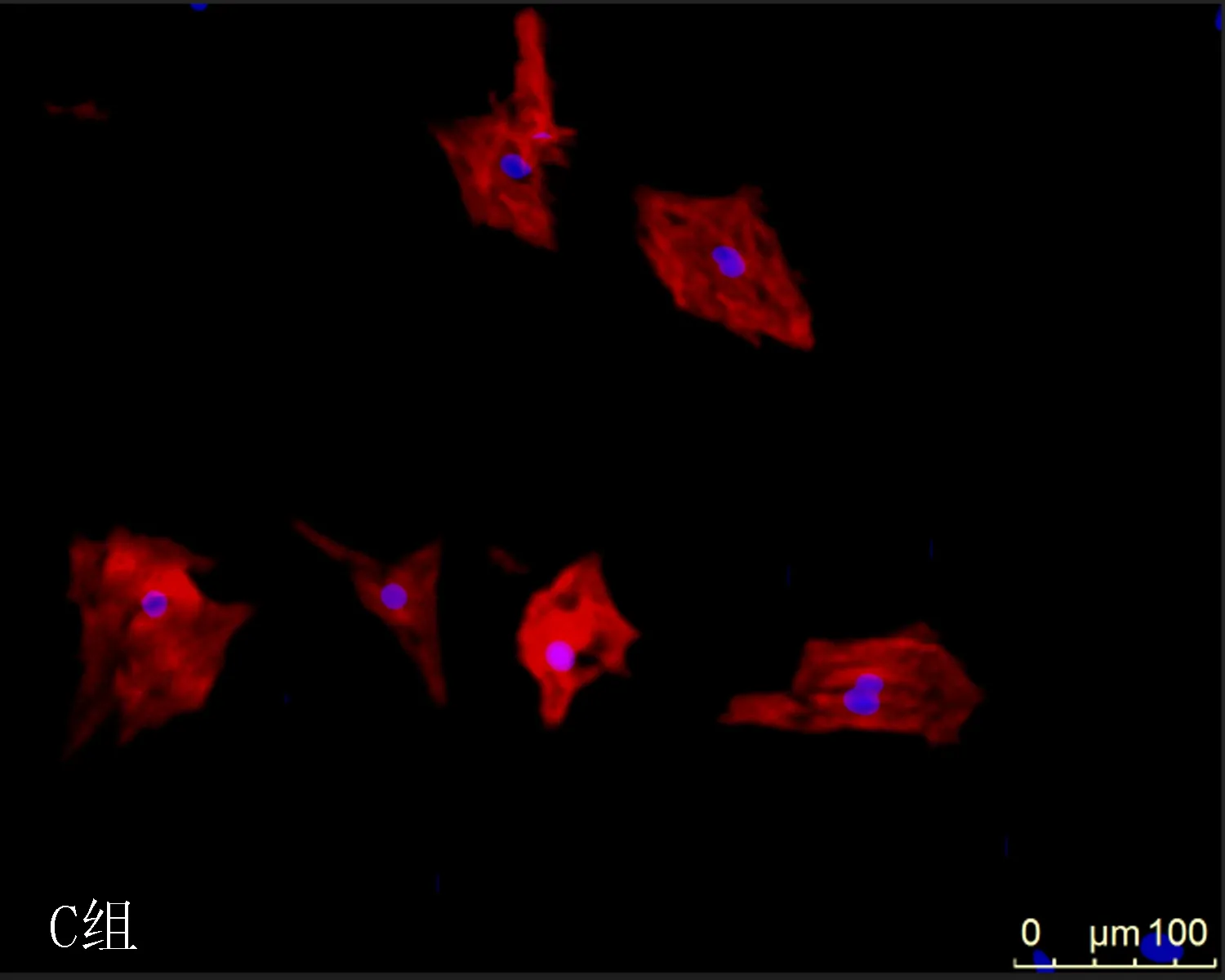



图3 不同浓度DHBF对AngⅡ诱导的肥大心肌细胞大小的相差显微镜测定结果(×200)
3 讨论
Brouwers等[7]报道,心力衰竭发生后,男性和女性患者的5年生存率分别为25%和38%。近年来,经过包括利尿剂、血管紧张素转换酶抑制剂(ACEI)、β受体阻滞剂、醛固酮受体阻滞剂等药物优化治疗等综合治疗后,心衰患者预后较前改善,但仍不容乐观。目前认为,心脏重构是心力衰竭发生发展的基本机制,因而对心脏重构学说的研究不断深入。心脏重构是在各种病理刺激下,心脏出现实质和间质的结构改变,是心肌细胞肥大、心脏间质纤维化等心血管疾病向终末期发展的共同病理生理基础[8]。心脏肥厚是心脏重构的重要环节,其诱发因素有高血压、心肌梗死、瓣膜病等,在细胞形态学方面主要表现为心肌细胞体积增大,蛋白合成增加,并伴有心肌细胞凋亡、心肌纤维化等;因此,阻断心肌肥大是干预心力衰竭的重要策略。
心肌肥大是一种由多种因素参与调节的复杂动态过程,其中已经被证实持续输注血管紧张素Ⅱ不仅能够升高动脉血压,增加心脏后负荷和导致心肌重构,而且能够直接作用于心肌细胞,调控细胞收缩、代谢和肥厚性生长[9]。在分子水平,心肌重构时心肌细胞核内基因表达模式改变,BNP、ANP产生增多,成熟基因表达下降以及心肌蛋白合成增加,单个细胞蛋白含量增高、心肌细胞肥大,收缩力减弱。在细胞、组织水平上,因为心肌细胞是一种高度分化的细胞,不能在数量上增殖,只能是单个细胞的体积增大,同时心肌细胞肥大、成纤维细胞和内皮细胞等非心肌细胞增殖和以胶原沉积为主要表现的细胞外基质重建;在器官水平为心脏质量增加,心室壁增厚或心腔扩大;反映到功能上表现为心脏收缩、舒张紊乱,心脏顺应性降低[10]。
同时研究发现,Ang Ⅱ结合G蛋白偶联受体,通过丝裂原活化的蛋白激酶(MAPK)通路进行信号传导。丝裂原信号传入核内引起立早反应基因c-jun等的表达。c-jun是细胞增殖调控相关的主要原癌基因之一,其编码的核蛋白作为反式作用因子,通过激活某些基因的转录而参与细胞增殖信号的传递[11]。体外培养的细胞在受到丝裂原和表皮生长因子的刺激后,c-jun都快速瞬间进行表达。这些原癌基因编码转录因子(第三信使)作用于次级反应基因端的调控元件,从而调控肥大晚期基因的表达,导致心肌细胞蛋白质合成增加,蛋白表型向胚胎型转化等心肌肥厚的特征性变化。ANP和BNP是心肌合成和分泌的多肽,属于胚胎基因,主要在心脏发育期表达,在出生之后通常低表达或者不表达。而在发生心肌肥厚时,心肌细胞除了客观上表现为心肌细胞体积明显增加,显微镜下可观察到细胞表面积增加以外,同时心肌细胞胚胎基因重新表达,表现为ANP、BNP等mRNA表达上调,因此作为心肌细胞肥大的标志物[12]。本研究结果显示,与对照组相比,AngⅡ(1 μmol/L)处理后,心肌肥大标志物c-jun、ANP和BNP的mRNA水平显著升高,这证明肥大心肌细胞模型构建成功。DHBF能明显降低c-jun、ANP和BNP的m RNA水平,并呈现剂量依赖性,这提示DHBF对肥大的心肌细胞有一定的抑制作用。
有研究显示:血管内皮活性物质在调节血管平滑肌舒缩活动中具有相当重要的作用。尤其是缩血管的内皮素(Endothelin,ET)和舒血管的一氧化氮(Nitric oxide,NO)。除了在血管系统发挥作用外,ET还可致钠排泄减少,刺激醛固酮的合成和释放;可增强心肌收缩性,并促进心室肌细胞和成纤维细胞的生长作用。ET有与ACE相类似的活性,可增加AngⅡ的催化合成,而反过来AngⅡ又能使ET基因表达增强,所以通常认为ET和AngⅡ具有相互促进的作用[13]。同时,ET-1可激活磷脂酶C/三磷酸肌醇途径,使细胞内Ca2+浓度增加或通过激活丝裂原活化蛋白激酶MAPK通路,最终启动相关基因表达从而诱导心肌细胞肥大。已有研究发现,异叶青兰醇提物可降低肾血管性高血压大鼠血压,可改善左室收缩舒张功能和心肌收缩力,其机制可能与降低血循环、心肌组织、肾组织中ET水平,升高NO水平,调整体内ET与NO平衡状态,以及影响心肌组织和肾组织中的RAS,抑制 ACE 的活力,降低 AngⅡ水平,从而达到保护内皮细胞和心、脑、肾等靶器官损害,从而达到改善血流动力学等原因有关[14]。
在本项研究中,采用AngⅡ诱导原代培养的心肌细胞肥大,建立心肌肥大模型,使用临床常用治疗心肌肥厚药物缬沙坦和DHBF进行干预,通过检测心肌细胞的活性、表面积的大小、肥大基因的表达,发现DHBF可呈剂量依赖性地提高AngⅡ诱导的心肌细胞的活性,降低c-jun、ANP和BNP的mRNA表达以及减小肥大心肌细胞表面积的大小。但本研究仅在细胞层面验证了DHBF下调介导了AngⅡ引起的心肌肥厚,如果能在成年鼠心肌细胞上进行研究,实验设计将会更加严谨。至于DHBF抑制心肌肥厚的作用机制是通过何种途径完成的,以及DHBF是否对整体动物心肌肥厚模型具有抑制作用,有待在动物体内进一步研究。^
综上所述,已得到的数据明确显示,DHBF能够抑制去甲肾上腺素诱导的心肌细胞肥大,因此观察其对心肌肥厚的作用,探讨其分子机制,可以为临床心肌肥厚、纤维化及其诱导的心血管病提供有效的药物防治。
[1] FONTES M S, KESSLER E, STUIJVENBERG L, et al. CTGF knockout does not affect cardiac hypertrophy and fibrosis formation upon chronic pressure overload[J]. J Mol Cell Cardiol, 2015,(9):82-90.
[2] YANG T. Crosstalk between (Pro)renin receptor and COX-2 in the renal medulla during angiotensin Ⅱ-induced hypertension[J]. Curr Opin Pharmacol, 2015,21:89-94.
[3] 高雪.三种菊科和一种唇形植物的化学成分和生物活性研究[D].兰州:兰州大学,2007.
[4] 何雯,邬利娅·伊明,司丽君,等.异叶青兰总黄酮对高血压大鼠心肌肥厚的影响[J].中国药理学通报,2013,29(1):1008-1011.
[5] 陶静,马依彤,李晓梅,等.原代乳鼠心肌细胞培养方法的改进[J].中华心血管病杂志,2014,42(1):53-56.
[6] BAO Q, CHEN L, LI J, et al. Role of microRNA-124 in cardiomyocyte hypertrophy inducedby angiotensin Ⅱ[J]. Cell Mol Biol, 2017,63(4):23-27.
[7] BROUWERS F P, BOER R A, HARST P, et al. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort:11-year follow-up of prevend[J]. Euro Heart J, 2013,34(19):1424.
[8] MADANIEH R.Cardiac magnetic resonance imaging might complement two-dimensional echocardiography in the detection of a reversible nonischemic cardiomyopathy[J]. Clin Med Ins Case Rep,2015,8(8):109-114.
[9] LING Y, XIANG W, TANG Q, et al. Cardiac-specific mindin over expression attenuates cardiac hypertrophy Via blocking AKT/GSK3B and TGF-B1-smad signalling[J]. Cardiovasc Res, 2011, 92(1):85-94.
[10] 刘可,颜玲娣,雍政,等.新型可溶性鸟苷酸环化酶激动剂sGC003对内皮素诱导的心肌细胞肥大的作用[J]. 中国药理学与毒理学杂志,2016,30(4):338-343.
[11] INOUE N, OHKUSA T, NAO T, et al. Rapid electrical stimulation of contraction modulates gap junction protein in neonatal rat cultured cardiomyocytes:involvement of mitogen-activated protein kinases and effects of angiotensin Ⅱ-receptor antagonist[J]. J Am Coll Cardiol, 2004,44(4):914-922.
[12] 刘思宁,栾天竺.阿托伐他汀对异丙肾上腺素诱发的鼠心肌细胞肥大的抑制作用[J].哈尔滨医科大学学报,2015, 29(4):305-308.
[13] JOHN T, PARISSIS M, SOCRATES K, et al. Plasma profiles of peripheral monocyte-related inflammatory markers in patients with arterial hypertension. Correlations with plasma endothelin-1[J]. Int J Cardiol , 2002, 83(1):13.
[14] 马晓玲.异叶青兰醇提物对肾血管性高血压大鼠的影响及机制初探[D].乌鲁木齐:新疆医科大学,2012.

