免疫组织化学法与荧光原位杂交技术检测乳腺癌HER-2状态一致性的对比研究
张 欢, 罗洞波, 赵 兵
(1新疆医科大学, 新疆医科大学附属肿瘤医院2胸外科, 3日间病房, 乌鲁木齐 830011)
在乳腺癌患者中,大约20%~30%存在人类表皮生长因子受体2(HER-2)基因的扩增或者过度表达,在临床实践中,对石蜡包埋组织HER-2/neu蛋白进行检测的有免疫组织化学法(immunohistochemistry,IHC)、Southern blot、逆转录聚合酶链反应法(RT-PCR)、原位杂交技术(CISH)和荧光原位杂交技术(fluorescence in situ hybridization,FISH),这些技术都可以用于评估HER-2基因扩增状态[1-2]。FISH因其敏感性和特异性较高,是检测HER-2基因状态的金标准,但其价格昂贵在临床中未能够广泛使用。因此,目前的临床工作中,普遍采用IHC进行HER-2基因状态检测。国外诸多研究显示,IHC和FISH检测乳腺癌HER-2蛋白表达和基因状态的一致性在73%~98%[3-5]。国内相关报道的一致性在69.0%~97.7%[6-7]。因此,为进一步比较IHC和FISH检测HER-2状态的一致性,本研究对新诊断的原发或复发浸润性乳腺癌患者的HER-2基因状态进行FISH检查,并评估与IHC检测结果的一致性,现报道如下。
1 样本来源与检测方法
1.1样本来源选取2010年1月-2016年6月在新疆医科大学附属肿瘤医院乳腺外科就诊的女性乳腺癌患者病理组织标本1 032例,术前未接受过化疗、放疗等治疗,年龄16~90岁,中位年龄50岁。
1.2IHC检测及结果判读标准[8]采用VECTASTAIN ABC试剂盒检测石蜡切片中HER-2蛋白表达情况(PK 4002,Vector实验室,Burlingame,CA,美国)。石蜡切片用二甲苯脱蜡,溶解于不同浓度乙醇溶液中(100%、90%和80%),在室温下30 min。用兔抗人单克隆抗HER-2进行免疫组织化学染色(迈新生物技术,福州,中国,1∶200)。在倒置光学显微镜下观察玻片。为保证结果判读的准确性,由2名病理科主任医师根据美国临床肿瘤学院/美国病理学家协会(ASCO/CAP)临床实践指南在双盲的情况下进行重复阅片,判定阳性结果。阳性反应细胞膜为棕黄色颗粒。HER-2的表达分为0~+++,基于阳性细胞比例和染色强度划分等级,0:没有染色或不完整的染色,淡染色肿瘤细胞≤10%;+:>10%的侵袭性肿瘤细胞出现微弱的/几乎察觉不到的不完整膜染色;++:>10%的浸润癌细胞呈现细胞膜棕黄着色,且周边膜染色不完整或/和染色弱或一般,膜染色强且完整的侵袭性肿瘤细胞数量≤10% ;+++:>10%的肿瘤细胞呈现强烈的、完整的细胞膜染色。0和+被视为阴性,+++为阳性,++为不确定。
1.3FISH检测及结果判读标准[8]FISH采用美国FDA批准的PathVysion HER-2 DNA探针试剂盒进行(雅培公司,德斯普兰斯,IL,美国),一个双色探针包括位点特异的标识符(LSI)HER-2/neu和17号染色体着丝粒探针(CEP)。操作步骤:组织切片65℃下烤片3 min,二甲苯脱蜡2次(每次10 min),100℃煮 30 min,蛋白酶K处理后消化5 min,并用2×SSC洗涤缓冲液洗两次,56℃烤片5 min,在78℃水浴杂交缓冲液中5 min。组织切片在-20℃70%乙醇中脱水。加探针混合在玻片上,42℃恒温过夜。暗室内0.3%NP 40/0.4×SSC、0.1%NP40/2×SSC、70% 乙醇漂洗。玻片在空气中自然干燥,并进行探针标记。2种DNA探针过夜杂交。细胞核DAPI染色。玻片在荧光显微镜下观察(Axio 100, Carl Zeiss)。收集每个玻片上两个不同显微区域的30个随机选择细胞核的红色和绿色信号。计算出平均HER-2数(红色信号)与CSP 17(绿色信号)的比值。据ASCO/CAP指南,比值<1.8为阴性,比值>2.2为阳性,比值在1.8~2.2为不确定。对于不确定的病例,需要另外计数40个细胞核(总共100个)进行了复测,或者重新进行FISH测试,直到得出确定的结果。 为保证结果判读的准确性,由2名病理科主任医师进行重复阅片,判定阳性结果。
1.4统计学处理采用SAS(Statistical Analysis System,统计分析系统)软件9.3版进行统计分析。组间比较采用卡方检验,采用配对比较分析免疫组化与FISH检测的差异,灵敏度采用Fisher精确概率分析。Kappa常数用于评估免疫组化和FISH检测之间的一致性。Kappa标准如下:<0:表示没有一致性;0~0.2:一致性轻微;0.21~0.4:一致性差;0.41~0.6:一致性一般;0.61~0.8:基本一致;与0.81~1:完全一致,以P<0.05为差异有统计学意义。
2 结果
2.1IHC与FISH检测HER-2蛋白表达和基因状态HER-2蛋白表达阴性显示≤10%的癌细胞有弱的不完整的细胞膜染色或无浸润性癌细胞染色; HER-2蛋白表达阳性显示>10%的肿瘤细胞呈现强烈的、完整的细胞膜染色,见图1。FISH检测HER-2基因扩增见图2。
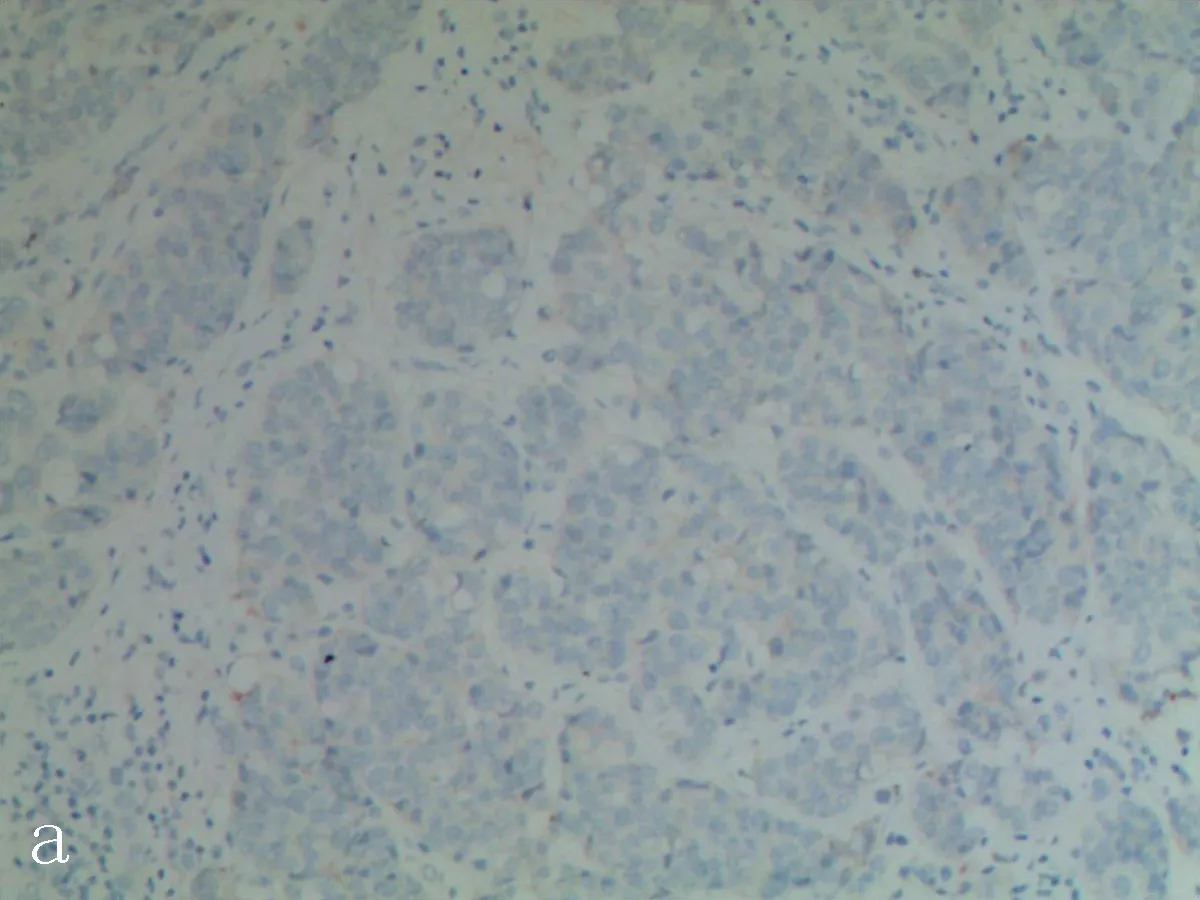
a: HER-2蛋白表达阴性

b: HER-2蛋白表达阳性
图1IHC检测乳腺癌中HER-2蛋白的表达(SP×200)

a:17号染色体二倍体,HER-2/CSPl7<2.0,提示该样本无HER-2基因扩增
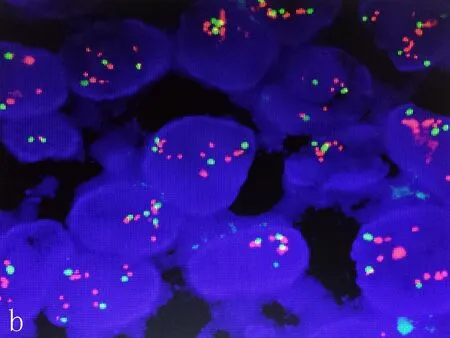
b:17号染色体二倍体,HER-2/CSPl7≥2.0,提示该样本存在HER-2基因扩增
图2FISH检测乳腺癌中HER-2基因扩增(×1000)
2.2FISH和IHC检测HER-2状态符合率比较1 032例乳腺癌患者中IHC检测HER-2蛋白表达阳性者373例,占36.1% (373/1 032);表达阴性者659例,占63.8%(659/1 032)。FISH检测HER-2基因扩增325例,占31.5% (325/1 032);基因非扩增707例,占68.5% (707/1 032)。373例HER-2蛋为阳性的患者中,HER-2基因扩增293例,符合率为78.6%(293/373);659例HER-2蛋白为阴性的患者中,HER-2基因非扩增627例,符合率为95.1% (627/659)(表1)。

表1 FISH和IHC检测HER-2状态符合率比较/例(%)
2.3FISH和IHC检测HER-2基因状态对比结果HER-2 蛋白表达阴性者(659例)中有32例存在基因扩增,193 例蛋白表达阳性者中有177例基因扩增,180例疑似蛋白表达阳性者中有116例基因扩增。此结果表明IHC 检测HER-2 蛋白和FISH 检测HER-2基因扩增有较高的一致性(Kappa=0.758 1,P<0.000 1)(表2)。
3 讨论
HER-2基因位于17号染色体长臂(17q12-21.32),编码p185蛋白,是一种受体酪氨酸激酶,与多个信号转导途径相关。已经发现在许多类型的恶性肿瘤中都存在HER-2基因表达,尤其是乳腺癌、卵巢癌、胃癌、胰腺癌、前列腺癌、结直肠癌,女性生殖道和肺癌中均存在过度表达[9]。近年的研究结果显示,HER-2是与乳腺癌发生、发展有密切关系的癌基因,HER-2阳性的乳腺癌其生物学行为和临床特点有其特殊性,该类患者虽然预后较差,但却可以从单克隆抗体曲妥珠单抗(trastuzumab, Herceptin)的治疗中获益[10-11]。美国食品药品监督管理局已批准人源化抗-HER-2单克隆抗体曲妥珠单抗用于HER-2蛋白过度表达的患者。因此准确评价HER-2基因状态是患者能否从曲妥珠单抗治疗中获益的关键。

表2 FISH和IHC检测HER-2基因状态对比结果/例
注:Kappa检验分析FISH与IHC 2种方法检测HER-2表达状态的一致性(Kappa=0.758 1,P<0.000 1)。
国外研究结果显示应用IHC检测HER-2蛋白表达+++,++,+和阴性者,应用FISH检测其基因扩增率分别为91.7%,23.2%,7.4%和4.1%。但对于IHC和FISH检测HER-2状态的一致性的比较结果差异性较大[12]。Kuo等[13]比较了IHC和FISH检测HER-2状态的一致性,结果显示IHC++的乳腺癌患者FISH检测基因扩增率为53.3%,IHC+++者FISH检测基因扩增率结果为83.3%,总的基因扩增率结果为69.7%。上述研究结果显示,IHC和FISH检测HER-2状态的一致性仍然存在争议,考虑以下因素[14]影响了IHC检测结果的准确性:(1)IHC组织固定时间长、一抗种类影响检测结果;(2)IHC属于半定量检测,稳定性和重复性差;(3)IHC检测缺乏统一的评价标准,结果判读人为因素影响大。
本研究采用IHC和FISH 2种检测方法,分析女性乳腺癌患者HER-2状态的一致性。Panjwani等[14]研究结果显示两种方法检测的一致性分别为:+++占93.9%、++占66%、 0/+占85.9%。Bahreini等[15]研究结果显示,IHC和FISH2种检测方法的一致性为78.1%到98.0%。本研究结果显示,当IHC检测HER-2结果为阴性0/+、FISH检测HER-2基因非扩增时,二者检测结果一致性较好,IHC结果为阳性++和+++,FISH 检测HER-2基因扩增时,二者检测结果的一致性较好;而当IHC为++时,2种方法检测结果差异性较大;当IHC为0/+和+++时,2种方法检测结果的一致性最好。本研究结果进一步说明,IHC和FISH都可以用于HER-2状态的评估,当IHC检测结果为++时,由于2种方法检测的差异性较大,对于该类患者建议进一步行FISH检测,明确HER-2扩增状态。本研究中IHC为+++、++和0/+与FISH 一致性分别为91.7% 、64.4%和95.1%,与既往研究结果基本相符。除了以上分析的原因引起HER-2检测在IHC和FISH结果出现差异之外,HER-2位于的17号染色体为多倍体也是需要考虑的因素。既往研究结果显示:l7号染色体多倍体的出现导致了HER-2拷贝数目较正常水平增高,从而导致了蛋白水平过表达,而HER-2基因检测并无扩增[16]。这部分患者单纯应用IHC检测可能出现HER-2蛋白表达假阳性。因此,为了避免由于l7号染色体多倍体引起FISH检测结果的误差,国内外大多数研究支持应用HER-2基因数/17号染色体着丝粒比值用于判读FISH检测结果。
综上所述,为了更好地提高HER-2蛋白表达阳性患者进行靶向性抗HER-2治疗的准确性,对于IHC检测为++,尤其是肿瘤学分级高的的患者,必须行FISH检测进一步明确HER-2基因扩增状态;而对于IHC法初筛结果为阴性0/+或强阳性+++的患者,IHC和FISH两种方法的一致性较好,可选择性进行FISH检测。随着分子实验技术的迅速发展,相对于既往IHC技术,FISH逐渐显示了优越性和可操作性,对今后基于精准医学的分子靶向治疗以及预后评价提供了更好的实验室诊断依据。
[1] GHEYBI M K, BARADARAN A, MOHAJERI M R, et al. Validity of immunohistochemistry method in predicting HER-2 gene status and association of clinicopathological variables with it in invasive breast cancer patients[J]. APMIS,2016,124(5):365-371.
[2] MOHAMED A, KRAJEWSKI K, CAKAR B, et al. Targeted therapy for breast cancer[J]. Am J Pathol, 2013, 183(4):1096-1112.
[3] SUN Z, SHI Y, SHEN Y, et al. Analysis of different HER-2 mutations in breast cancer progression and drug resistance[J]. J Cell Mol Med,2015,19(12):2691-2701.
[4] FAN Y S, CASAS C E, PENG J, et al. HER2 FISH classification of equivocal HER2 IHC breast cancers with use of the 2013 ASCO/CAP practice guideline.[J]. Breast Cancer Res Treat,2016 ,155(3):457-462.
[5] HASHMI A A, EDHI M M, NAQVI H, et al. Molecular subtypes of breast cancer in south asian population by immunohistochemical profile and her2/neu gene amplification by fish technique:association with other clinicopathologic parameters[J]. Breast J, 2014, 20(6):578-585.
[6] 董海新,张仁亚,刘启龙,等.荧光原位杂交与免疫组化对乳腺癌HER-2检测的对比研究[J].济宁医学院学报,2009,32(4):246-248.
[7] 杜江,董朝,钟红,等.ER、PR以及HER-2在乳腺癌原发灶及复发灶间表达差异及其临床意义[J].新疆医科大学学报,2013,36(5):653-655.
[8] WOLFF A C, HAMMOND M E, HICKS D G, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer:American Society of Clinical Oncology/College of American Pathologists guideline[J]. Arch Pathol Lab Med,2013,138(2):241-256.
[9] FURRER D, JACOB S, CARON C, et al. Concordance of HER2 immunohistochemistry and fluorescence in situ hybridization using tissue microarray in breast cancer[J]. Anticancer Res,2017,37(6):3323-3329.
[10] PEREZ E, PRESS M, DUECK A, et al. Immunohistochemistry and fluorescence In situ hybridization assessment of HER2 in clinical trials of adjuvant therapy for breast cancer (NCCTG N9831, BCIRG 006, BCIRG 005)[J]. Breast Cancer Res Treat,2013,138(1):99-108.
[11] WOLFF A, HAMMOND E, HICKS D, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer:American society of clinical oncology/college of American pathologists clinical practice guideline update[J]. J Clin Oncol,2013, 31(31):3997-4013.
[12] FURRER D, JACOB S, CARON C, et al. Tissue microarray is a reliable tool for the evaluation of HER2 amplification in breast cancer[J]. Anticancer Res,2016, 36(9):4661-4666.
[13] KUO S J, WANG B B, CHANG C S, et al. Comparison of immunohistochemical and fluorescence in situ hybridization assessment for HER-2/neu status in Taiwanese breast cancer patients[J]. Taiwan J Obstet Gynecol,2007,46(2):146-151.
[14] PANJWANI P, EPARI S, KARPATE A, et al. Assessment of HER-2/neu status in breast cancer using fluorescence in situ hybridization & immunohistochemistry:Experience of a tertiary cancer referral centre in India[J]. Iindian J Med Res, 2010,132(9):287-294.
[15] BAHREINI F, SOLTANIAN A R, MEHDIPOUR P. A meta-analysis on concordance between immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH) to detect HER2 gene overexpression in breast cancer[J]. Breast Cancer,2014, 22(6):615-625.
[16] JI Y, SHENG L, DU X, QIU G, et al. Clinicopathological variables predicting HER-2 gene status in immunohistochemistry-equivocal (2+) invasive breast cancer[J].J Thorac Dis, 2014,6(7):896-904.

