亚砷酸钠对SD大鼠脏器损伤的实验研究
徐梦伟, 任冬燕, 孙高峰, 谢惠芳
(1新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室, 乌鲁木齐 830011; 2新疆乌鲁木齐市疾病预防控制中心, 乌鲁木齐 830000)
世界卫生组织(WHO)报道,无机砷剧毒,暴露于无机砷会增加癌症和非恶性疾病的风险,国际癌症研究机构(International Agency for Research on Cancer)已经将砷及其砷化物确定为人类致癌物。中国在20世纪60年代确认饮用砷污染的地下水会对健康构成威胁。据估计,中国约有1 960万人的饮用水受到砷污染[1]。沈雁峰等[2]调查发现,我国各地地下水砷浓度几何均值为1.597~6.216 μg/L,经面积校正后,全国地下水砷浓度几何均值为2.773 μg/L。本实验通过给SD(Sprague-Dawley)大鼠饮用含亚砷酸钠(NaAsO2)的水溶液,建立SD大鼠砷中毒的模型,通过记录SD大鼠体质量和脏器重量,测定体内砷含量,观察组织病理学改变,研究砷对SD大鼠脏器的毒性损伤,为进一步研究砷致SD大鼠脏器损伤的机制研究提供一定的理论基础。
1 材料与方法
1.1实验动物无特定病原级(specefic pathogen free,SPF)健康SD大鼠(32只)购自新疆医科大学,实验动物生产许可证号:SCXK(新)2011-0004;实验动物使用许可证编号:SYXK(新)2011-0001,雌雄各半,体质量为:(80±5)g。饲养温度控制在18℃~22℃,相对湿度为 40%~60%,12 h昼夜交替。实验期间SD大鼠自由摄食、饮水。
1.2仪器和试剂电子称(ACS-1.51A,上海友声衡器有限公司),分析天平[XS205,瑞士梅特勒-托利多仪器(上海)有限公司],超净工作台(YJ-1450,苏州医用机械厂),AA240FS原子吸收分光光度仪(美国VARIAN公司),DB-IVA型不锈钢电热板(金坛市医疗仪器厂),NaAsO2(山东西亚化学工业),水合氯醛(天津市福晨化学试剂厂),4%甲醛(武汉博士德生物工程有限公司),硝酸(成都市科龙化工试剂厂),高氯酸(成都市科龙化工试剂厂)。NaAsO2溶液配制: 称取NaAsO2加入超纯水定容至100 mL,配成浓度为100 mg/L的NaAsO2溶液,使用时以超纯水稀释至所需浓度。实验过程中用到的玻璃器具均用10%的硝酸浸泡过夜,再用蒸馏水冲洗、烘干后使用。
1.3方法
1.3.1 实验动物分组及染毒方法 SD大鼠按每4只/笼,雌雄各分装6笼,经1 w适应性饲养后,采用随机数字表法按性别和体质量随机分为对照组、低剂量组、中剂量组、高剂量组,每组8只,雌雄各半。采用经口自由饮水染毒,对照组SD大鼠自由饮用超纯水,3个剂量组SD大鼠分别饮用含0.45、2.25和11.25 mg/kg不同NaAsO2水溶液,连续染毒16 w[3]。染毒期间,观察SD大鼠摄食、饮水量、皮毛光泽度、精神和活动状况,每2天称量1次体质量。染毒结束后,用10%的水合氯醛处死SD大鼠。
1.3.2 脏器系数计算 SD大鼠处死后,在超净台内无菌操作快速取出心、肝、肺、肾、脾脏组织,用4%的生理盐水冲洗,滤纸吸干后称重,计算脏器系数,脏器系数=脏器重量(g)/体质量(g)×100%。
1.3.3 砷含量测定方法
1.3.3.1 取样 SD大鼠处死前1 d天禁食24 h,正常饮用超纯水或含砷水,用代谢笼收取尿样。待10%的水合氯醛麻醉处死SD大鼠后,取仰卧位固定,剪开腹部,腹主动脉采血3 mL,解剖SD大鼠取肝、肾和肺组织分装并放入液氮中迅速冷冻,随后保存于-80℃冰箱内。
1.3.3.2 血样和尿样预处理 从-80℃冰箱中取出冻存的样品,在室温下解冻,取0.5 mL血样或1 mL尿样加入50 mL锥形瓶内,加入混合酸(HNO3∶HClO4=4∶1)3 mL,摇匀后置于电热板上消化至无色透明印迹留于瓶底,冷却后用纯净水反复冲洗,转移到15 mL离心管中并定容至10 mL。
1.3.3.3 组织样品的预处理 取肝、肾或肺组织0.2 g,放入玻璃匀浆器,取预冷的生理盐水(组织重量的9倍)于小瓶中,置于冰上进行匀浆,制备10%肺组织匀浆。取1 mL肝、肾或肺组织匀浆加热消化同上,用于肝、肾和肺组织砷含量测定。
1.3.3.4 砷含量测定方法 采用石墨炉原子吸收法检测消化好的血样、尿样和组织样品中的砷含量。每个样本重复测量3遍,取平均值后比较。
1.3.4 组织病理学观察 各组SD大鼠组织标本于4%甲醛溶液固定24 h以上,石蜡包埋、4 μm切片、苏木素-伊红(HE)染色后封片,在光镜下观察心、肝、肺、肾脏的病理学变化。

2 结果
2.1SD大鼠一般状况实验初期,SD大鼠生长发育良好,饮食量和饮水量均正常,皮毛光泽度正常,精神佳,活动正常,未见明显的异常表现。染毒2个月后,中剂量组和高剂量组SD大鼠与对照组和低剂量组SD大鼠比较饮食量和饮水量相对减少;随着染毒时间延长,活动逐渐减少,应激性差,背部和尾部出现不同程度的皮毛脱落,皮毛光泽度降低,尤以高剂量组SD大鼠明显,甚至出现烦躁和互相抓咬现象。染毒第4个月末高剂量组1只SD大鼠死亡。
2.2SD大鼠体质量变化实验期间4组SD大鼠体质量均呈增长趋势,自第1个月后高剂量组SD大鼠体质量增长缓慢,而对照组、低剂量组和中剂量组SD大鼠体质量在第2个月后开始增长缓慢。染毒至第4个月时,中剂量组和高剂量组SD大鼠体质量出现下降趋势,而高剂量组SD大鼠体质量明显低于对照组和低剂量组,差异有统计学意义(P<0.05),见表1。
2.3脏器系数变化高剂量组SD大鼠肝脏脏器系数高于对照组,差异有统计学意义(P<0.05)。高剂量组SD大鼠肾脏脏器系数高于对照组和低剂量组,中剂量组SD大鼠肾脏脏器系数高于对照组,差异均有统计学意义(P<0.05),见表2。

表1 NaAsO2对SD大鼠体质量的影响
注:与对照组比较,▲P<0.05; 与低剂量组比较,▲P<0.05。

表2 NaAsO2对SD大鼠脏器系数的影响
注:与对照组比较,*P<0.05; 与低剂量组比较,▲P<0.05。
2.4SD大鼠血液、尿液和脏器组织中的砷含量随着染砷剂量和染砷时间的增加,染砷组SD大鼠血砷、尿砷和肝、肾、肺组织砷含量呈逐渐上升趋势。4组SD大鼠血砷、尿砷和肝、肾、肺组织砷含量分别比较差异均有统计学意义(P<0.05)。血砷、尿砷和肝、肾组织砷含量分别两两比较差异均有统计学意义(P<0.05)。高剂量组SD大鼠肺组织砷含量高于对照组、低剂量组和中剂量组,其中,中剂量组SD大鼠肺组织砷含量高于对照组,差异均有统计学意义(P<0.05),见表3。

表3 各组SD大鼠血砷、尿砷和组织砷含量比较
注:与对照组比较,*P<0.05;与低剂量组比较,▲P<0.05;与中剂量组比较,▼P<0.05。
2.5SD大鼠血砷、尿砷和组织砷含量之间的相关关系SD大鼠血砷、尿砷和肝、肾、肺组织砷含量两两之间均呈正相关(P<0.05),表4。
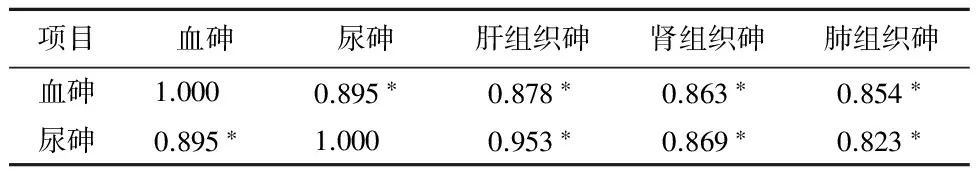
表4 SD大鼠血砷、尿砷和组织砷含量之间的相关关系(rs值)
注:*P<0.05。
2.6SD大鼠组织病理学形态的变化
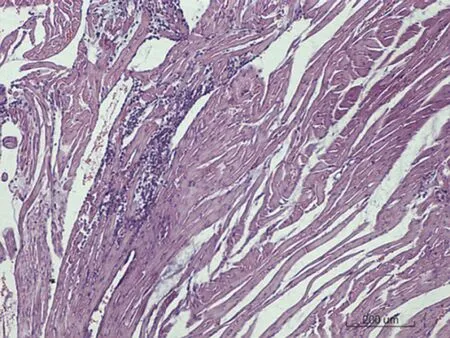
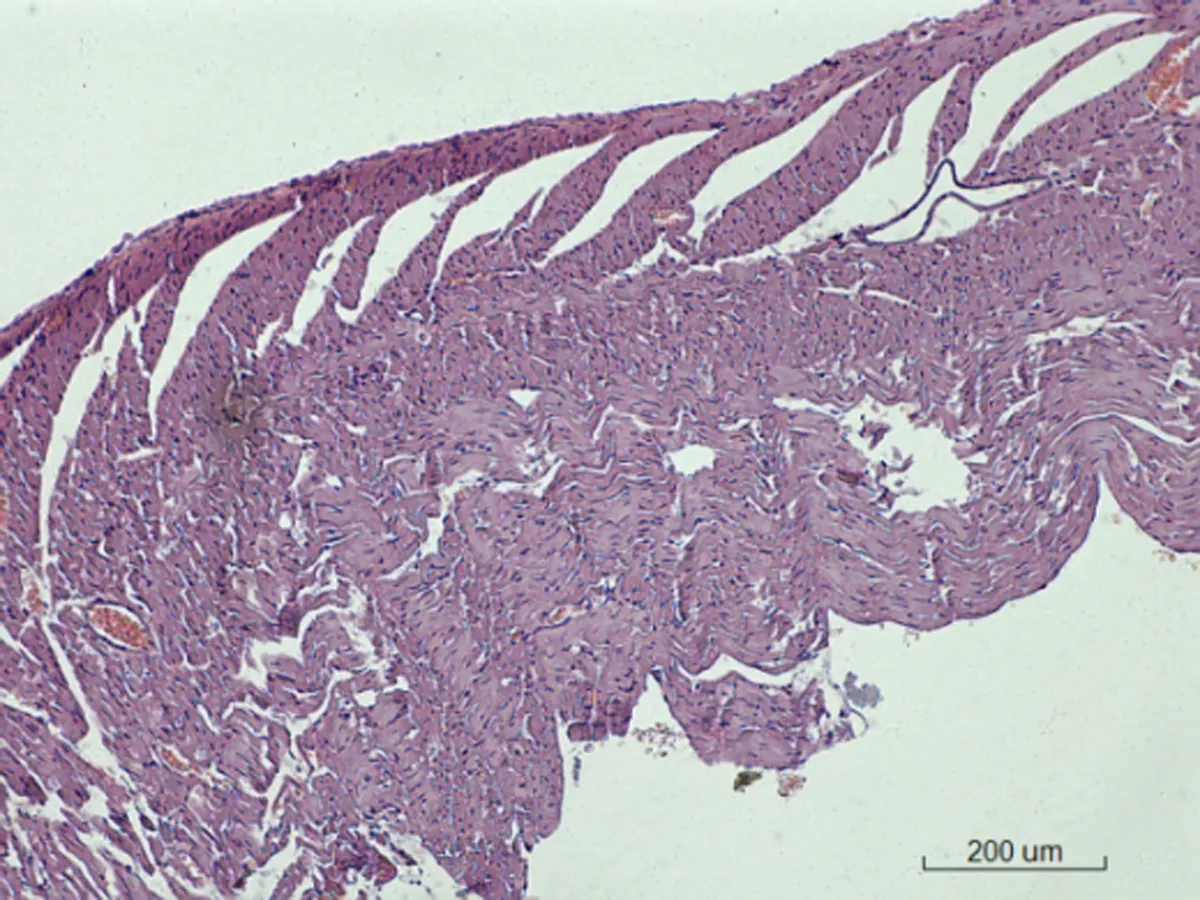
2.6.1 心脏病理学形态变化 对照组SD大鼠心脏病理学形态正常,心肌细胞呈梭形,排列正常;低剂量组出现微量炎性细胞浸润,心肌纤维增粗;中剂量组出现少量炎细胞浸润,间质少量出血;高剂量组出现心肌纤维化,见图1。
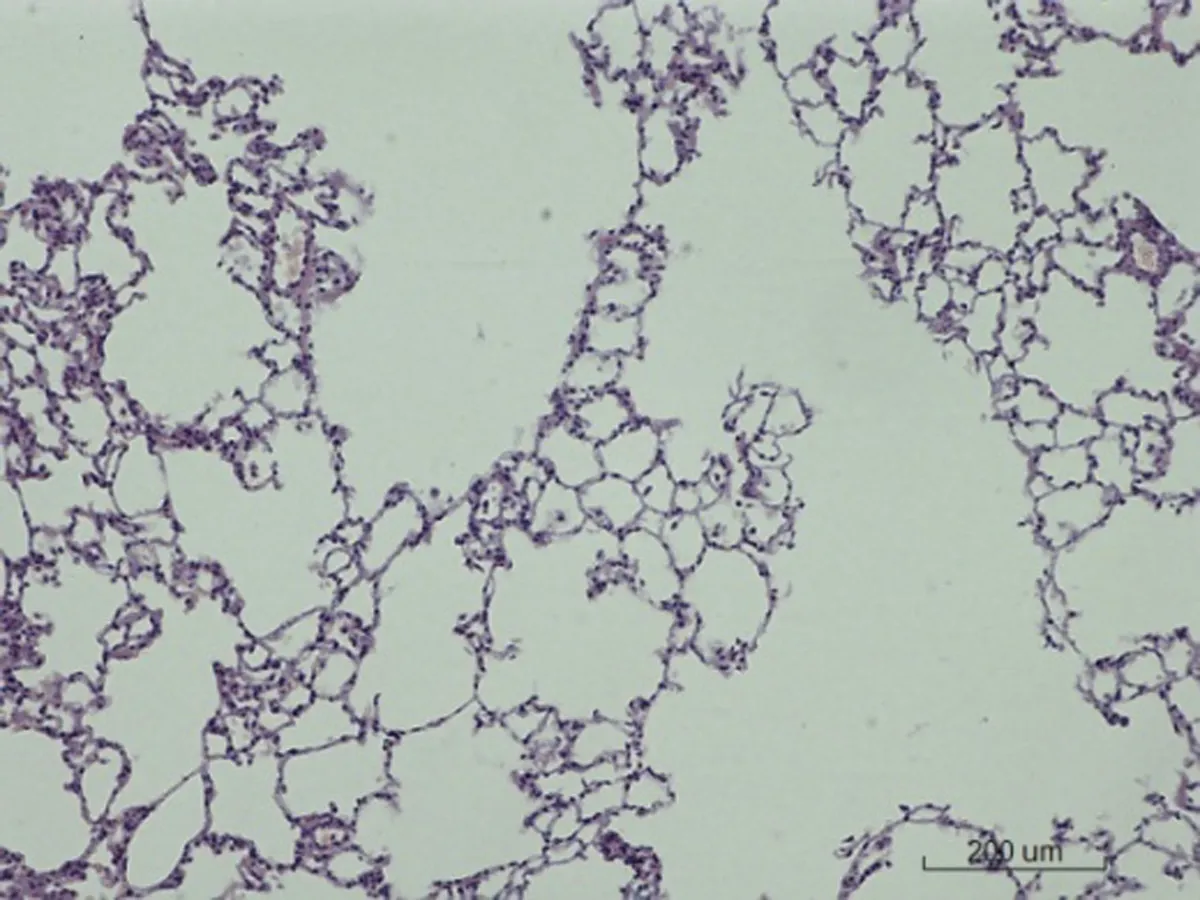
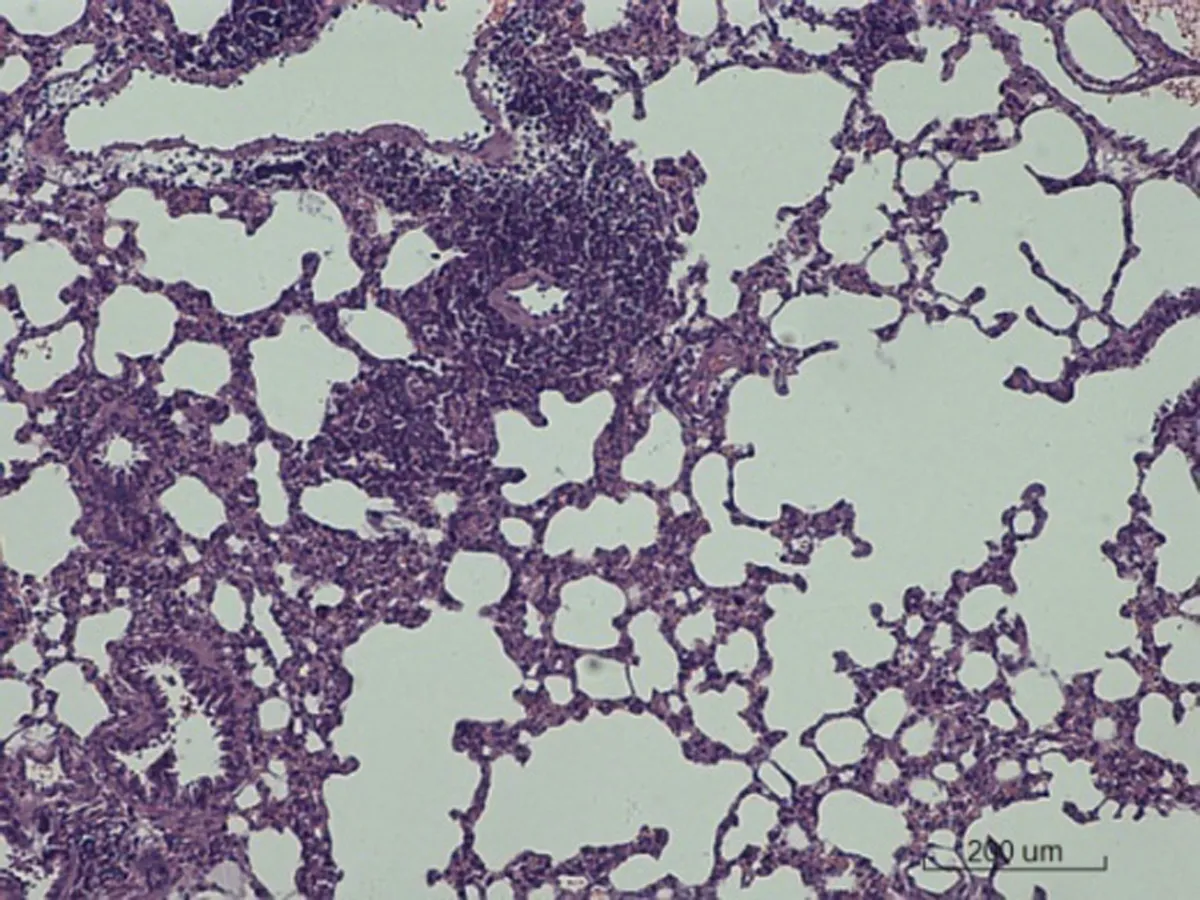
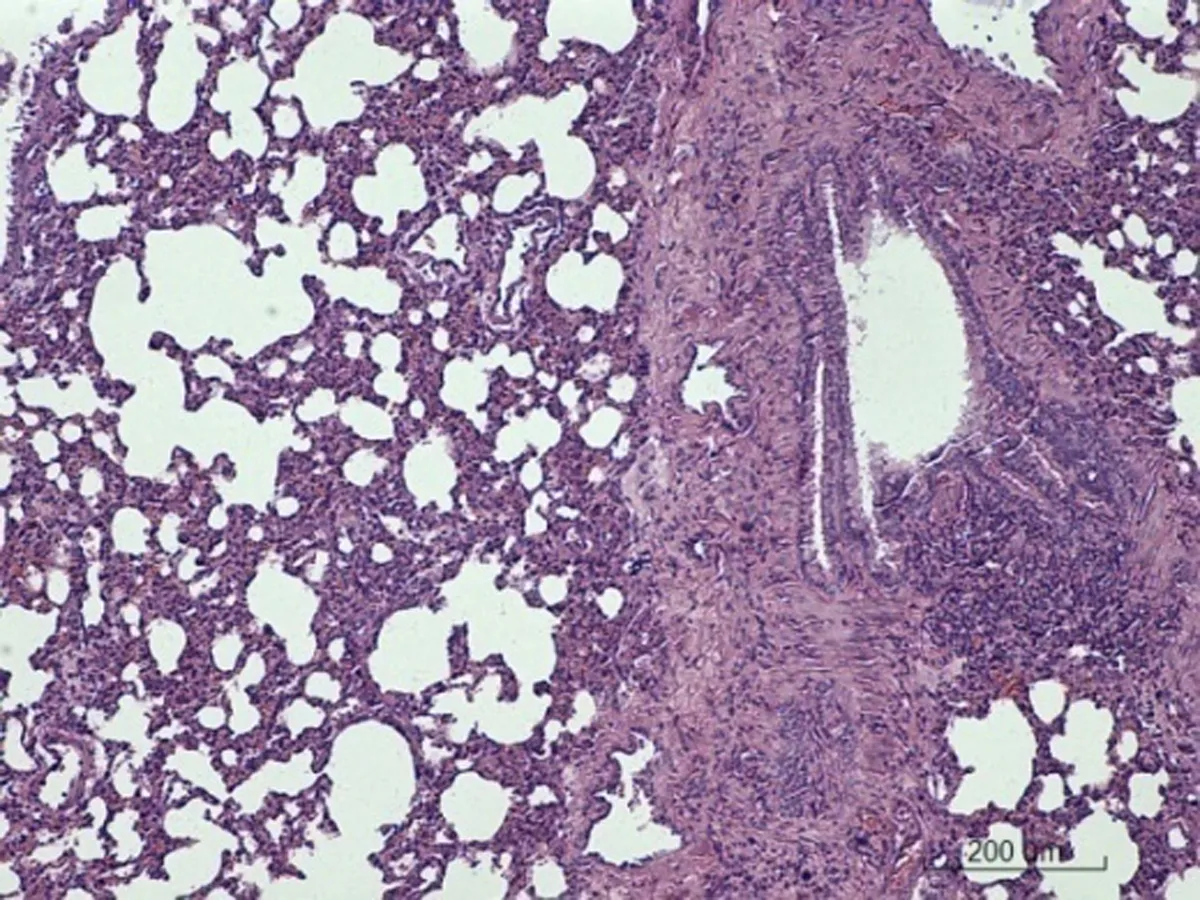
2.6.2 肺脏病理学形态变化 对照组SD大鼠肺脏病理学形态正常,肺泡壁薄,肺泡隔无明显增宽,其内毛细血管无明显扩张、充血和炎细胞浸润;低剂量组出现少部分肺泡隔增宽和少量炎细胞浸润,其余正常;中剂量组出现肺泡隔增宽30%以及局灶性炎细胞浸润;高剂量组出现局部肺泡融合,肺泡隔增宽50%,大量淋巴细胞浸润,有纤维素渗出,部分纤维化,见图2。

对照组

低剂量组
中剂量组
高剂量组
图1各组SD大鼠心脏病理学改变情况(HE×200)
对照组

低剂量组
中剂量组
高剂量组
图2各组SD大鼠肺脏病理学改变情况(HE×200)
2.6.3 肝脏病理学形态变化 对照组SD大鼠肝脏病理学形态正常,肝小叶结构正常,肝细胞形态基本正常,呈多边形,细胞核大而圆,无炎性细胞浸润,肝细胞与肝血窦以中央静脉为中心向周围呈放射状排列,中央细胞索排列正常,周边细胞索排列紊乱,无纤维组织增生;低剂量组出现肝小叶结构不明显,肝细胞水肿,偶见双核细胞,无纤维组织增生,轻微炎性细胞浸润;中剂量组出现肝细胞水肿,部分细胞细胞核固缩或溶解,局灶性炎性细胞浸润,无纤维组织增生;高剂量组出现肝细胞索排列紊乱伴有水肿,部分细胞细胞核固缩或溶解,汇管区有炎性细胞浸润,见图3。
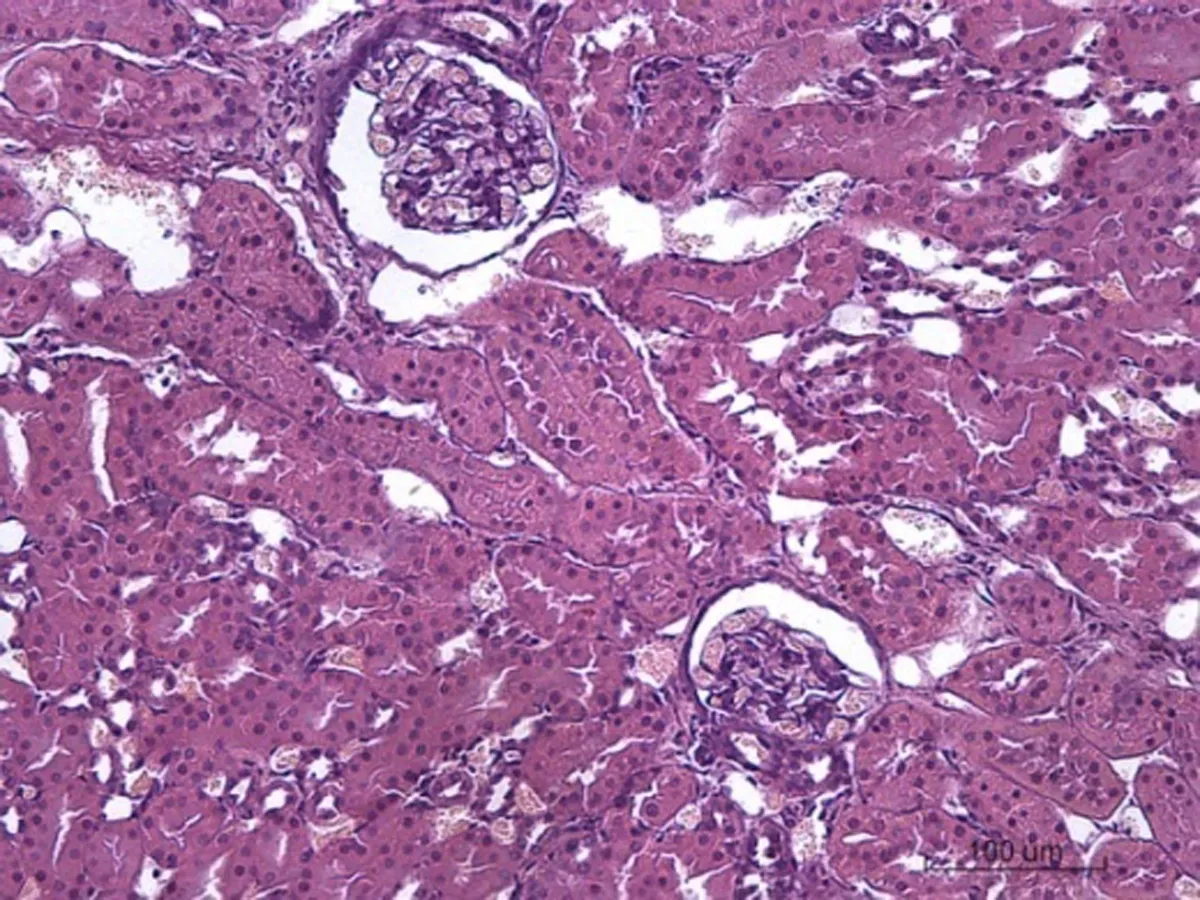
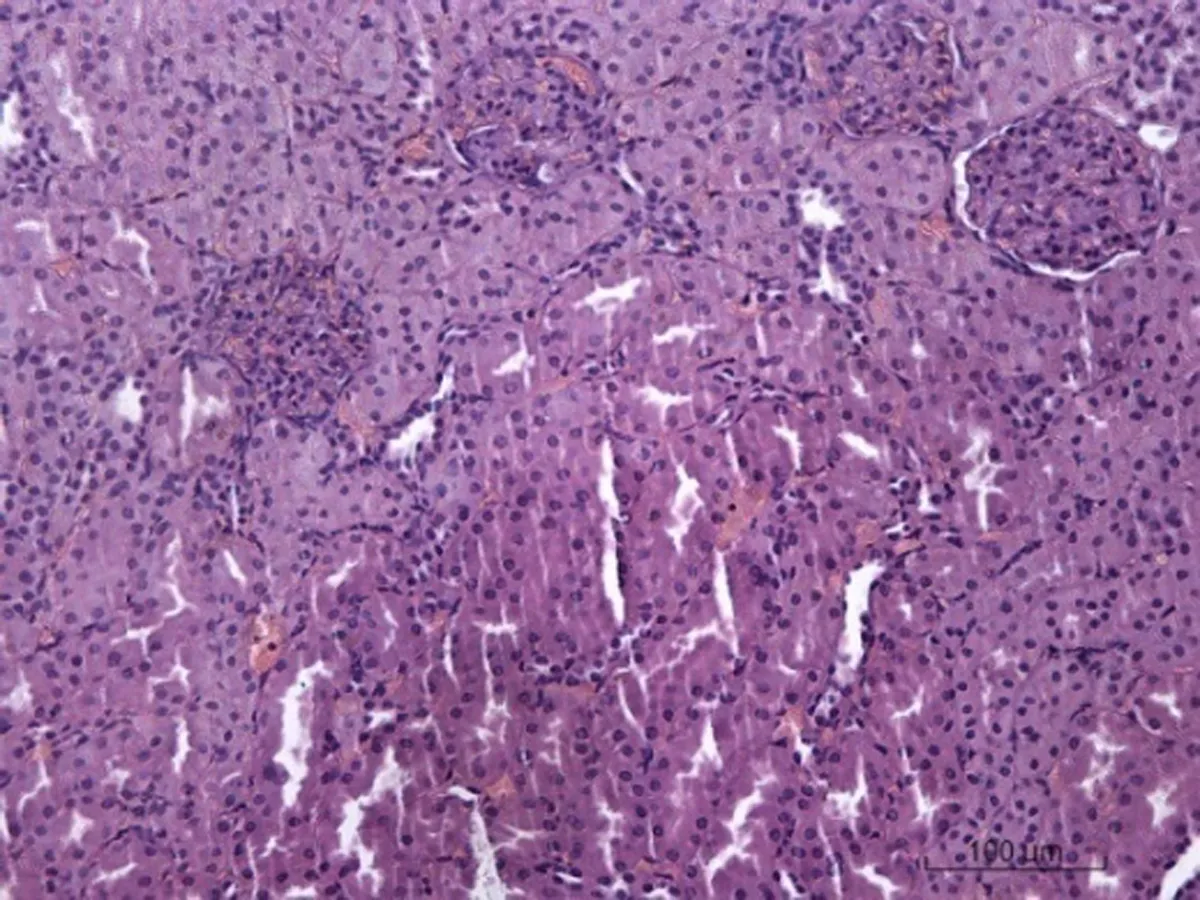
2.6.4 肾脏病理学形态变化 对照组SD大鼠肾脏病理学形态正常,肾小球和肾小管结构正常,肾小管上皮细胞无水肿,无炎性细胞浸润;低剂量组出现肾小管上皮细胞水肿,无炎性细胞浸润;中剂量肾小球毛细血管出现陈旧性出血,肾小管上皮细胞水肿明显并出现脂肪变性和脂肪空泡;高剂量组出现肾小囊、肾小管几近消失,肾小球毛细血管水肿,肾小管上皮细胞水肿明显,部分脂肪变性,近曲、远曲小管管腔狭窄,有炎性细胞浸润,见图4。

对照组

低剂量组

中剂量组

高剂量组
图3各组SD大鼠肝脏病理学改变情况(HE×200)

对照组
低剂量组

中剂量组
高剂量组
图4各组SD大鼠肾脏病理学改变情况(HE×200)
3 讨论
根据世界卫生组织(WHO),饮用水中砷的最大允许限量(MPL)为10 μg/L(WHO,1996),中国生活饮用水卫生标准(GB 5749-2006)中砷的毒理指标也是<10 μg/L。砷是地球上第20个最丰富的元素,地下水中的砷主要来自含砷矿物的岩石、土壤和沉积物[4]。水是人生存的基础,是人体循环系统、消化系统、呼吸系统、泌尿系统正常工作的必要物质保证,生命活动不可缺少的关键要素。微观上讲,饮水与健康的关系主要是元素与人体的关系[5]。世界上许多国家报告了地下水的砷污染及其产生的健康危害[6]。慢性砷暴露已覆盖全世界约2亿人,并会产生不利于人体健康的效应,包括一些脏器的癌症[7]。
在本实验中,染毒进行第4个月末时,1只高剂量组SD大鼠饮食量和饮水量明显减少,精神状况不佳,活动为缓慢爬行,体质量减轻明显,最终死亡,死亡体质量为160.00 g。提示长期饮用含砷的水会引起恶病质,最终导致机体处于严重的机能失调状态。通常把饮食量和饮水量作为受试对象毒理学中全身毒性和一般健康状况恶化的经典指标。随着染毒时间延长,中剂量组和高剂量组SD大鼠饮食量和饮水量均减少。体质量和脏器系数是判断毒性发展的两个重要指标,是综合分析实验动物某项指标异常的基础。本次实验在染毒至第4个月时,高剂量组SD大鼠体质量明显低于对照组和低剂量组(P<0.05),证实了高剂量组砷染毒可以导致实验动物体质量明显下降。
砷是细胞原生质毒,吸收入血的无机砷主要与血红蛋白结合,随血液分布到全身各组织和器官[8],其中包括心、肺、肝和肾脏。砷在人体内具有明显的蓄积性,长期高砷暴露可以导致多种非癌性健康损害和多系统的恶性肿瘤,对人类健康有巨大危害[9]。哺乳动物中无机砷代谢存在广泛差异[10]。SD大鼠具有与人类相似的分布、代谢和排泄功能[11]。血砷可直接反映砷在体内的近期暴露量,经过体内脏器组织的代谢,随尿液排出,因而尿砷可反映砷在体内的慢性暴露情况,即代谢情况。本研究显示,4组SD大鼠体内血砷和尿砷含量逐渐增加(P<0.05),血砷含量均大于尿砷含量,血砷与尿砷含量的相关关系较大(rs=0.895,P=0.000)。说明砷的排泄速度较慢,长期饮用含砷水会产生砷在体内蓄积的现象,可进一步通过计算脏器系数和测定组织砷含量证实。本研究的SD大鼠脏器系数数据分析显示,高剂量组SD大鼠肝脏脏器系数高于对照组(P<0.05),高剂量组SD大鼠肾脏脏器系数高于对照组和低剂量组,且中剂量组SD大鼠肾脏脏器系数高于对照组(P<0.05),与Naujokas等[12]的研究结果一致。结合肝、肾和肺组织的砷含量测定结果:4组肝、肾组织砷含量随着染毒剂量加大而逐渐升高(P<0.05);染砷组肺组织砷含量均高于对照组(P<0.05)。证实长期饮用含砷水则会导致砷在体内蓄积。本研究还发现砷在SD大鼠肝、肾和肺组织内的蓄积程度并非一致,低剂量组脏器组织内砷含量,从高到低依次表现为:肺脏>肾脏>肝脏;而中剂量组和高剂量组为:肾脏>肺脏>肝脏,与Cui等[13]的研究结果一致。推测饮用不用浓度的含砷水则砷在体内脏器组织的蓄积量不同,需进一步验证。
既然砷吸收首先在血液中聚集,血液由心室射出,经动脉、毛细血管和静脉返回心房,周而复始的进行血液循环分布到全身脏器,心脏和肺脏是这一过程中至关重要的两个器官,进而会对心脏和肺脏产生毒性作用。本实验在光镜下观察到,染毒组SD大鼠心脏内炎性细胞随着染毒剂量增加而增多,高剂量组甚至出现心肌纤维化;染毒组肺组织肺泡隔增宽随着染毒剂量增加而增宽,炎性细胞逐渐增多,而高剂量组还出现局部肺泡融合,纤维素渗出,甚至纤维化。提示砷可对心脏和肺脏产生毒性作用。心脏和肺脏是临床上观察心跳和呼吸两个生命体征的关键靶器官,因此不容忽视砷对心脏和肺脏的损伤。肝脏和肾脏是毒物代谢和排泄的重要器官,砷进入体内可能会对肝脏和肾脏产生毒害作用。大量文献报道,砷可致肝脏和肾脏损伤[3,14-16]。本实验光镜下观察到,染毒组肝细胞损伤和炎性损伤随着染毒剂量增加而加重;染毒组肾小球和肾小管损伤随着染毒剂量增加而加重,高剂量组有炎性细胞浸润,甚至出现肾小囊、肾小管甚至几近消失。以上分析表明随着染砷剂量加大,对SD大鼠脏器组织的损伤逐渐加深。
综合饮食量、饮水量、体质量和脏器系数以及脏器组织砷含量和病理改变,表明本实验成功建立SD大鼠砷中毒模型。长期饮用含不同浓度的NaAsO2水溶液,能够对SD大鼠脏器组织产生不同程度的毒性作用,并且,毒性作用随着剂量加大而加重。
[1] RODRIGUEZ-LADO L, SUN G, BERG M, et al. Groundwater arsenic contamination throughout China[J]. Science, 2013, 341(6148):866-868.
[2] 沈雁峰,孙殿军,赵新华,等.中国饮水型地方性砷中毒病区和高砷区水砷筛查报告[J].中国地方病学杂志,2005,24(2):172-175.
[3] 李远慧, 刘鲜林, 常傲霜,等. 慢性砷中毒大鼠肾脏超微结构的变化[J]. 环境与健康杂志, 2010, 27(12):1102-1104.
[4] JHA S K, MISHRA V K, DAMODARAN T, et al. Arsenic in the groundwater: Occurrence, toxicological activities, and remedies[J]. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev, 2017, 35(2):84-103.
[5] 段金叶,潘月鹏,付华,等.饮用水与人体健康关系研究[J].南水北调与水利科技,2006, 4(3):36-40.
[6] 于光前, 陈志, 赵丽军,等. 中国地方性砷中毒流行趋势分析[J]. 中华地方病学杂志, 2010, 29(1):3-8.
[7] SAGE A P, MINATEL B C, Ng K W, et al. Oncogenomic disruptions in arsenic-induced carcinogenesis[J]. Oncotarget, 2017, 8(15):25736-25755.
[8] 陈学敏,杨克敌.现代环境卫生学[M].北京:人民卫生出版社,2008:1273.
[9] 李伟,李冰.环境砷暴露对机体损伤的研究进展[J].环境与健康杂志,2016,33(9):836-841.
[10] NAIN S, SMITS J E. Pathological,immunological and biochemical markers of subchronic arsenic toxicity in rats[J]. Environ Toxicol, 2012, 27(4):244-254.
[11] ODANAKA Y, MATANO O, GOTO S. Biomethylation of inorganic arsenic by the rat and some laboratory animals[J]. Bull Environ Contam Toxicol,1980, 24(1):452-459.
[12] NAUJOKAUJAS M F, ANDERSON B, AHSAN H, et al. The broad scope of health effects from chronic arsenic exposure: update on a worldwide public health problem[J]. Environ Health Perspect, 2013, 121(3):295-302.
[13] CUI X, OKAYASU R. Arsenic accumulation, elimination, and interaction with copper, zinc and manganese in liver and kidney of rats[J]. Food Chem Toxicol, 2008, 46(12):3646-3650.
[14] 姚芹,吴顺华,汤红英,等.亚砷酸钠亚慢性染毒对小鼠肝脏肾脏的损伤作用[J].新疆医科大学学报,2010,33(12):1388-1390.
[15] 钱立全,刘涛.不同剂量砷暴露致大鼠肾脏损伤病理分析[J].中国继续医学教育,2017,9(10):66-67.
[16] 净锦飞,徐焰,骆文静,等.亚慢性砷暴露对大鼠肾脏功能和形态的影响[J].实用预防医学, 2011, 18(2):195-198.

